转染HBx改变Notch信号诱导肝癌HepG2细胞株多药耐药性研究
徐桐红,于冬艳,任 玲
肝癌多药耐药(MDR)是影响化疗效果及导致死亡的主要原因[1-2]。肝癌对化疗药物相对不敏感,对MDR发生机制不清楚。HBx具有多种调控功能,可激活肿瘤侵袭相关原癌基因和转录因子,是肝癌发病独立危险因素[3-5]。Notch信号通路是高度保守的细胞间信号转导通路。研究表明,Notch信号通路不仅对胚胎期肾脏发育起至关重要的作用,且参与多种肿瘤的发生和发展[6],其能通过血管内皮生长因子促进肿瘤血管发生,从而促进肿瘤细胞增殖[7]。多药耐药蛋白(MRP)过表达是肝癌产生MDR的重要机制[8-9]。本研究采用基因转染将HBx基因转入肝癌HepG2细胞中,观察HBx对HepG2细胞中Notch信号通路和MRP表达的影响,并探讨转染HBx对肝癌细胞增殖和MDR的影响及其可能的作用机制,为肝癌的防治提供理论基础。
1 材料与方法
1.1细胞株 人肝癌HepG2细胞株购自中科院上海生命科学院细胞库,本所传代保存,置于37℃、CO2体积分数为5%、含10%胎牛血清RPMI-1640培养基(Thermo Fisher Scientific,MA,USA)的恒温培养箱内培养。
1.2试剂 DMEM高糖细胞培养液(美国Gibco公司,批号:12100046),DMEMF12(美国Gibco公司,批号:12400024),HBSS缓冲液(上海研卉生物技术有限公司,批号:BS0101),Trizol裂解液(美国赛默飞世尔科技,批号:15596026),Taqman MicroRNA反转录试剂盒(美国赛默飞世尔科技,批号:4366596),Lipofectamine 2000转染试剂盒(美国赛默飞世尔科技,批号:722255),Annexin-V-FITC/PI细胞凋亡检测试剂盒(上海前尘生物科技有限公司,批号:40302ES20),B27补充剂(美国GIBCO,批号:17504-044),CCK-8试剂盒(上海钰博,批号:YB1198),小牛血清(北京索莱宝公司,批号:01-045),胰蛋白酶(北京瑞达恒辉科技发展有限公司,批号:HB-0103-01),RPMI-1640培养基(美国GIBCO公司,批号:11875-093)。
1.3实验方法
1.3.1重组X质粒转染肝癌HepG2细胞:在10%胎牛血清的DMEN中培养HepG2细胞,胰酶消化后,接种于直径25 cm培养瓶中,此时计数细胞数为1×106个/L,细胞在6 h后贴壁,之后进行细胞转染。在37℃预热的无血清培养基加入5 μg DNA和15 μl Trans Fast Reagent,随机高速涡旋混匀,在室温下静置15 min。培养基被小心移出,之后慢慢向培养瓶中加入混匀的DNA/脂质体的混合物,在37℃孵育24 h后,轻轻加入4 ml含血清的培养基(完全培养基),不必移去DNA/脂质体混合物,37℃继续孵育48 h;以HepG2细胞中转染重组x质粒命名为转染HBx细胞组(HepG2-HBx组)、未转染重组x质粒命名为转染空载体细胞组(HepG2-con组),未进行任何处理的为空白细胞组(HepG2组)。
1.3.2实时定量聚合酶链反应(PCR)检测HBx mRNA的表达:TRIzol试剂提取并收集处于对数生长期的3组肝癌HepG2细胞的HBx mRNA,RNA完整性利用1%的琼脂糖变性凝胶电泳进行检测,纯度和浓度利用紫外可见分光光度计检测;在70℃(10 min)、冰育(2 min)、42℃(60 min)、70℃(10 min)反应条件下,利用逆转录试剂盒逆转录得到cDNA;在95℃(5 s)、60℃(20 s)、72℃(5 s)进行qRT-PCR反应,40个循环,重复试验3次。
1.3.3蛋白免疫印迹法(Western-blot)检测肝癌HepG2细胞中HBx、Notch-1和MRP表达:转染组和未转染组进行细胞总蛋白提取,通过Bradford方法调整相同的蛋白浓度后,行电泳获得根据分子量分离的蛋白条带,根据pierce公司Western-blot试剂盒的指导说明进行,蛋白NC膜电转,进行蛋白封闭和一抗结合,一抗结合后洗脱,再进行二抗孵育标记兔抗大鼠的多克隆抗体。ECL试剂盒显色后,暗室发光拍照,以β-actin为内参进行系统软件分析。
1.3.4CCK-8法检测细胞增殖活性:取3组细胞以1×106个/L接种于96孔板中,每孔100 μl,培养48 h后每孔加入10 μl CCK-8试剂,4 h后在450 nm波长下检测各孔吸光度(OD)值,重复3次取均值。以OD值为纵坐标,时间为横坐标,绘制生长曲线。
1.3.5流式细胞仪检测细胞周期:收集转染48 h后的3组细胞,用冷PBS洗涤细胞后加入体积分数70%冷乙醇固定过夜。采用Cell Quet软件分析细胞周期分布情况。实验重复3次。
1.3.6细胞耐药性检测:将3组处于对数生长期的HepG2细胞制成浓度为1×106个/L的细胞悬液,每孔100 μl,接种于96孔板,每孔设3个复孔。孵育24 h后,换用浓度为0.5、1、2.5、5、10、25、50、100 μmol/L丝裂霉素、阿霉素培养液,0.5、1、2.5、5、10、25、50、100、250、500 μmol/L 5-氟尿嘧啶、顺铂、奥沙利铂培养液。孵育48 h后,去除含药液,每孔加100 μl不含药培养基和10 μl CCK-8,设空白孔。孵育2 h后,酶标仪测光密度值,设a为加药组的OD值,b为不加药细胞组的OD值,c为无细胞的空白组的OD值,药物对细胞的抑制率(%)=[1-(a-c)/(b-c)]×100%。计算5种药物抑制率为50%的浓度(IC50)和耐药指数(RI),RI=耐药细胞IC50/亲本细胞IC50。
2 结果
2.1HBx mRNA的表达 将PCR扩增产物进行凝胶电泳,可见HepG2-HBx组有目的片段出现,而其他2组未见HBx mRNA的表达,见图1。
图13组肝癌细胞HepG2聚合酶链反应扩增产物凝胶电泳结果
A.HepG2组;B.HepG2-con组;C.HepG2-HBx组
2.2HBx、Notch-1和MRP蛋白表达 HepG2-HBx组有HBx蛋白表达,HepG2组和HepG2-con组未见表达。Notch-1和MRP蛋白在HepG2-HBx组条带最大,HepG2-con组次之,HepG2组最小。见图2。
图23组肝癌HepG2细胞中HBx、Notch-1和多药耐药蛋白的表达情况

A.HepG2组;B.HepG2-con组;C.HepG2-HBx组
2.3转染HBx后各组细胞的生长曲线 与HepG2组和HepG2-con组比较,HepG2-HBx组细胞增殖显著加快(P<0.05)。见表1。
表1 3组肝癌HepG2细胞培养不同时间吸光度值比较
注:与HepG2组比较,aP<0.05,bP<0.01;与HepG2-con组比较,cP<0.05
2.4转染HBx后细胞周期变化 与HepG2组和HepG2-con组比较,HepG2-HBx组G0/G1期细胞显著减少,S期细胞增加(P<0.05,P<0.01),G2/M期细胞变化不大(P>0.05)。见表2。
2.5耐药性 与HepG2组和HepG2-con组比较,HepG2-HBx组中肝癌细胞HeG2对5种药物耐药指数增高(P<0.05,P<0.01)。见表3。
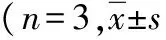
表2 3组肝癌HepG2细胞周期变化情况,%)
注:与HepG2组比较,aP<0.05,bP<0.01;与HepG2-con组比较,cP<0.05,dP<0.01
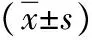
表3 3组肝癌HepG2细胞对药物的敏感性比较
注:IC50为药物抑制率为50%的浓度,RI为耐药指数;与HepG2组比较,aP<0.05,bP<0.01;与HepG2-con组比较,cP<0.05,dP<0.01
3 讨论
HBV慢性感染是世界范围内原发性肝细胞癌(HCC)的主要发病原因之一[10-11],HBx基因致HCC发生的机制是目前研究的热点。HBx基因具有强大的生物学功能,包括反式激活病毒基因组和宿主细胞基因的转录、增强转录因子DNA结合特性、抑制p53蛋白活性、参与细胞信号转导途径和细胞凋亡的调节等。这些功能可能与HCC的发生具有密切的关系[12]。一些体内及体外研究也发现,HBx可诱导细胞的恶性转化,甚至参与癌变发生[13]。
在肿瘤的发生、发展过程中,Notch信号出现紊乱时,能够直接引起肿瘤的发生和发展,且可通过多条信号通路的相互作用,间接诱导肿瘤的形成[14]。本研究qPCR检测结果显示,转染HBx的HepG2细胞内HBx mRNA和蛋白表达明显,提示转染构建过表达HBx的肝癌细胞成功。本研究还发现,转染HBx人肝癌HepG2细胞Notch-1蛋白表达高于HepG2组和HepG2-con组,提示HepG2细胞中HBx过表达诱导了细胞内Notch-1表达水平的增加,造成细胞内Notch信号通路的紊乱。细胞增殖和周期检测结果显示,转染HBx后细胞增殖能力显著提高,S期细胞增加,提示Notch-1的活化诱导了HepG2细胞增殖的发生。
MDR是导致肿瘤治疗失败和复发的主要原因之一[15-16]。有报道指出,检测患者体内MRP的表达可以作为监测恶性肿瘤细胞原发性耐药的主要指标[17]。肿瘤细胞产生MRP与药物外排泵ABC转运蛋白的过度表达与细胞凋亡水平异常改变、细胞DNA修复活性增强、胞内酶异常改变和器官微环境改变有密切关系[18]。此外,Notch-1信号与肿瘤细胞MDR的形成有关,过表达Notch-1能增加与MDR相关的ABBCC1基因的表达,诱导MDR的发生[19]。本研究发现,转染HBx的HepG2细胞耐药指数明显增高,提示转染HBx HepG2细胞,可能通过诱导Notch-1和MRP的过表达,最终导致MDR的发生。此外,在本研究基础上检测Notch通路的活化情况及由此引起凋亡抑制蛋白livin表达,同时研究livin的表达后MDR相关蛋白表达的变化,并观察HBx、Notch通路活化、livin蛋白及MDR蛋白表达之间的相关性是下一步的研究重点,为乙型肝炎相关性HCC临床治疗提供新靶点。
[1] 韩冬,肖亮,占小波,等.多药联合方案建立人肝癌多药耐药细胞株[J].实用医学杂志,2015,31(22):3691-3693.
[2] 徐铖,罗华荣,甘梅富.非小细胞肺癌中EGFR及多药耐药蛋白与化疗疗效的关系[J].中国生化药物杂志,2017,37(5):93-95,97.
[3] Hoare J, Henkler F, Dowling J J,etal. Subcellular localisation of the x protein in hbv infected hepatocytes[J].J Med Virol, 2001,64(4):419-426.
[4] Su Q, Schroder C H, Hofmann W J,etal. Expression of hepatitis B virus X protein in HBV-infected human livers and hepatocellularcarcinomas[J].Hepatology, 1998,27(4):1109-1120.
[5] 李伟,刘传苗,赵守松.原发性肝细胞癌患者肝组织中乙型肝炎病毒x基因的变异[J].实用医学杂志,2009,25(2):180-182.
[6] Dormoy V, Jacqmin D, Lang H,etal. From development to cancer: lessons from the kidney to uncover new therapeutic targets[J].Anficancer Res, 2012,32(9):3609-3617.
[7] MaⅡIard I, Fang T, Pear W S. ReguIation of Iymphoid deveIopment, differentiation, and function bytheNotch pathway[J].Annu ReUImmunol, 2005,23:945-974.
[8] 孙海兵,张开光,李琴,等.TRAIL逆转人胃腺癌SGC7901/ADR细胞多药耐药的机制探讨[J].山东医药,2017,57(13):9-12.
[9] 王海娟,张美芝,刘小菊,等.雷公藤内酯醇逆转肿瘤多药耐药研究进展[J].中国实验方剂学杂志,2016,22(10):229-234.
[10] 余咸辉,鄢业鸿,董春华,等.HBx在乙肝相关型肝细胞癌中的作用机制[J].广东医学,2016,37(23):3614-3618.
[11] 王文耀,张鸿飞,唐淼,等.miR-21 在肝癌中的表达及其与 PTEN 的关系[J].中国普通外科杂志,2017,26(3):395-400.
[12] Huang J, Deng Q, Wang Q,etal. Exome sequencing of hepatitis B virus-associated hepatocellular carcinoma[J].Nat Genet, 2012,44(10):1117-1123.
[13] Chen L, Hu L, Li L,etal. Dysregulation of β-catenin by hepatitis B virus X protein in HBV-infected human hepatocellular carcinomas[J].Front Med China, 2010,4(4):399-411.
[14] Bridges E, Oon C E, Harris A. Notch regulation of tumor angiogenesis[J].Future Oncol, 2011,7(4):569-588.
[15] 严林海,韦尉元,肖强,等.尾型同源盒基因2过表达对人胃癌耐顺铂细胞SGC7901/DDP多药耐药性的影响[J].中华消化外科杂志,2014,13(2):145-148.
[16] 罗文,杨杰,廉超,等.尾型同源盒基因2沉默对人胃癌耐顺铂细胞SGC7901/DDP多药耐药性的逆转[J].中华消化外科杂志,2014,13(1):55-61.
[17] 宋祖丽,李振光,王净净,等.穴位埋药线对难治性癫痫大鼠癫痫样波的发放及大脑海马和颞叶皮质多药耐药相关蛋白MRP-1、P-gp表达的影响[J].湖南中医药大学学报,2016,36(10):76-81.
[18] Yergeri M, Kapse-Mistry S, Srivastava R,etal. Nanodmg delivery in reversing muttidrug resistance in cancer cells[J].Front Pharmacol, 2014,5(159):1-6.
[19] 李艳霞.Notch-1通路在人胰腺癌细胞上皮-间质转化和肿瘤干性中的作用机制研究[D].武汉:武汉大学,2016.

