香菊片对变应性鼻炎大鼠血清相关细胞因子及维持纤毛系统正常功能的研究
李 斐
变应性鼻炎是机体接触过敏原后所发生的由特异性抗体lgE介导,发生在鼻腔或鼻黏膜的,致肥大细胞致敏性增加的慢性变态反应性疾病[1],与哮喘有关[2]。鼻腔黏膜腺体中分泌物和大分子气体对气道内表面液体平衡保持和细菌入侵抵御有重要作用[3-4]。有研究发现,香菊片治疗慢性鼻炎、鼻窦炎等效果较好[5],但对于其调节变应性鼻炎血清细胞因子和维持纤毛系统正常功能的研究较少。本研究探讨香菊片对变应性鼻炎大鼠鼻黏膜及鼻纤毛变化的影响,观察IgE、白介素-4(IL-4)、IL-8水平。
1 材料与方法
1.1实验材料 香菊片购于陕西香菊制药有限公司,卵清蛋白(OVA)购于美国Sigma公司,其他试剂购于国药集团化学试剂有限公司。挑选健康清洁级健康Wistar大鼠30只,雌雄不限,体重200~250 g。
1.2变应性鼻炎模型制备及分组 选取6只大鼠作为空白对照组(未添加任何处理),其余24只大鼠均给予OVA经全身致敏,空白组每日腹腔注射等量生理盐水,模型组以0.5 mg OVA溶于 1 ml 生理盐水中,并于大鼠背部皮下10处注射,OVA经全身强化致敏后第 7 天起每天一次用 1 mg/ml OVA 滴鼻(含有 OVA 溶液均以生理盐水配制),每次 20 μl,每日1次,共10次[6]。模型建立成功标准:根据鼻痒程度评定:轻擦鼻多次为1分;频繁重度的抓搔面、鼻为2分。根据清涕流至位置评定:流至前鼻孔处为1分,流至超过前鼻孔处为2分,流至满面时为3分。根据喷嚏的个数评定:10 min内1~3个为1分,4~10个为2分,>11个为3分。以上3种评定方式叠加量化评分>5分即为造模成功。模型制备成功大鼠随机分为模型组、阳性对照组、香菊片低剂量组(鼻饲香菊片50 mg/kg)和香菊片高剂量组(鼻饲香菊片200 mg/kg),每组6只。
1.3干预方法 空白对照组和模型组均以等体积的蒸馏水代替药物;阳性对照组采用氯雷他定(西安杨森制药有限公司,国药准字H20070030) 85 mg/kg灌胃给药;香菊片低剂量组给予鼻饲香菊片50 mg/kg;香菊片高剂量组给予鼻饲香菊片200 mg/kg。5组均在10% OVA生理盐水滴鼻之前30 min给药,每天1次,共10次。
1.4HE染色观察鼻黏膜病理形态 4周后,用水合氯醛麻醉小鼠,打开鼻腔轻取鼻腔黏膜,去除周围结缔组织和血管分支,用肝素抗凝生理盐水冲洗残留血液,固定于 4%多聚甲醛溶液中24 h,将组织脱水浸蜡,包埋,切片,厚度4~5 μm,42℃纯水中展片,粘附载玻片捞片,烤片机62℃烘片1 h,72℃烤箱烤片2 h后,行HE染色,染色后,乙醇脱水,二甲苯透明处理,切片滴上树胶,盖玻片封固。待树胶干后,在光学电子显微镜下观察大鼠鼻腔鼻黏膜病理形态的改变及嗜酸性粒细胞的浸润情况。
1.5细胞因子水平检测 取5组大鼠血清用酶联免疫吸附法(ELISA)检测血清IgE、IL-4、IL-8水平。
1.6扫描电镜观察鼻黏膜形态 4周后,用水合氯醛麻醉小鼠,打开鼻腔后,轻取鼻腔黏膜,去除周围的结缔组织和血管分支,用肝素抗凝的生理盐水冲洗去残留血液,固定于4%多聚甲醛溶液中24 h,观察鼻黏膜形态,用PBS缓冲液反复冲洗双侧鼻腔黏膜后,固定于2.5%戊二醛溶液中,封口避光保存,固定24 h后,用扫描电镜观察。
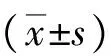
2 结果
2.1鼻黏膜病理形态和嗜酸性粒细胞的浸润情况 正常组鼻黏膜血管数量少,黏膜下致密纤维结缔组织较薄,无血管改变和炎性细胞浸润;模型组鼻黏膜小血管明显增生扩张,且鼻黏膜增厚,上皮下大量炎性细胞浸润,腺体扩张,上皮分泌细胞增多,黏膜下腺体数量明显增加,小血管无明显扩张;香菊片低剂量组与阳性对照组比较炎性细胞浸润程度明显降低;香菊片高剂量组鼻黏膜厚度与阳性对照组比较无明显降低,而炎性细胞浸润程度明显减轻,小血管、腺体数量也减少。见图1。
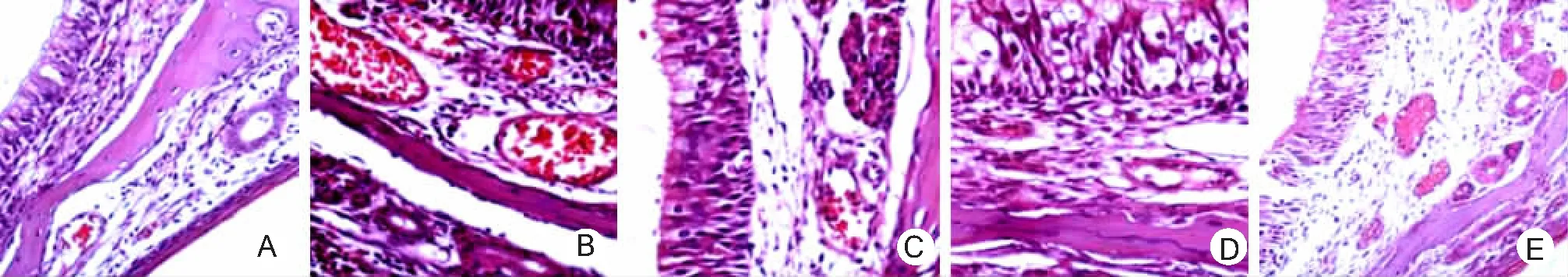

图1 5大鼠鼻黏膜组织病理形态(HE×100) A.空白对照组;B.模型组;C.香菊片低剂量组;D.香菊片高剂量组;E.阳性对照组
2.2血清IgE、IL-4、IL-8水平 模型组血清IgE、IL-4、IL-8水平明显高于空白对照组(P<0.01);阳性对照组、香菊片低和高剂量组血清IgE、IL-4、IL-8水平均较模型组降低,且阳性对照组低于香菊片低和高剂量组(P<0.05)。见表1。
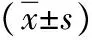
表1 5组治疗前后血清免疫球蛋白E、白介素-4、白介素-8水平比较
注:空白对照组为正常大鼠,模型组、阳性对照组、香菊片低、高剂量组均为变应性鼻炎动物模型,阳性对照组给予氯雷他定鼻饲,香菊片低、高剂量组鼻饲剂量分别为50、200 mg/kg;与空白对照组比较,bP<0.01;与模型组比较,aP<0.05,dP<0.01;与香菊片低剂量组比较,cP<0.05;与香菊片高剂量组比较,eP<0.05
2.3鼻腔纤毛变化 空白对照组鼻黏膜纤毛长度及直径一致,纤毛整齐,密集,摆动规律,微管结构规则;模型组鼻黏膜呈大片状,大量黏附于纤毛顶端,且密度较大,阳性对照组纤毛密集,局部略杂乱,微管结构清晰;香菊片低剂量组纤毛密集,较整齐,偶见局部少量纤毛略杂乱;香菊片高剂量组纤毛之间无粘连,微管结构清晰。见图2。


图2 5组大鼠鼻腔纤毛超微结构电镜观察(×100) A.空白对照组;B.模型组;C.香菊片低剂量组;D.香菊片高剂量组;E.阳性对照组
3 讨论
香菊片由化香树果序、防风、夏枯草、野菊花、辛夷、白芷、黄芪、甘草等中药组成[7-8],其中香树果序具有宣通鼻窍,疏风散邪的功效;防风、夏枯草、野菊花具有清热解毒,祛风消肿功效;黄芪补脾益肾、祛风解表,增强免疫力;辛夷具有抗组胺及收缩鼻黏膜血管的作用,能有效缓解变应性鼻炎鼻痒、喷嚏、流涕症状;甘草调和诸药,且现代药理学研究发现,上述中药配方中,含有大量黄酮及其他活性物质,具有调节免疫、增强机体免疫力的功效[9-14]。
变应性鼻炎是由IgE所介导的过敏性疾病[15]。在变应性鼻炎的发病过程中,会有嗜酸性粒细胞浸润、T细胞的活化和肥大细胞的聚集等作用的发生[16]。有研究发现,肥大细胞在过敏反应的早期阶段发挥着非常重要的作用[17]。当特异性个体与过敏原接触后,肥大细胞表面相关的受体FcεRI将会与IgE介导的过敏原结合,诱导肥大细胞释放组胺、炎性细胞因子、白三烯等,这些炎性介质诱导鼻黏膜病理形态的改变,进而出现鼻痒、流鼻涕、打喷嚏等症状[18-21]。研究发现,IL-8在IgE的生成过程中有着重要的促进作用[22]。本研究结果显示,香菊片低和高剂量组血清IgE、IL-4、IL-8水平均较模型组降低,提示香菊片能够通过调节相关细胞因子的水平来改善变应性鼻炎的症状。
在鼻腔中,鼻黏膜纤毛是其非特异性免疫保护的重要结构,纤毛微管蛋白臂滑动有助于黏膜表面黏液的清除。纤毛受损会严重影响纤毛清除功能[23]。本研究结果显示,香菊片可使纤毛密集整齐,纤毛之间无粘连,微管结构清晰,提示香菊片能有效促进纤毛增生,修复损伤的鼻黏膜,缓解鼻黏膜病理学改变,从而减轻变应性鼻炎流涕及喷嚏等症状。
综上所述,香菊片对变应性鼻炎大鼠鼻黏膜形态及功能的具体作用机制可能是通过调节相关细胞因子的水平、降低特异性IgE水平,从而改善变应性鼻炎的症状。香菊片相关的调控信号途径等仍需进一步研究,以期发挥祖国传统医药之优势,挖掘出不良反应小、效果佳的治疗变应性鼻炎中药制剂。
[1] 何金年,谭建成,姚东方,等.鼻内类固醇激素对变应性鼻炎动物模型鼻腔黏膜的影响[J].临床耳鼻咽喉头颈外科杂志,2012,26(2):74-77.
[2] 刘兴华,黎爱芬,余佳.支气管哮喘合并变应性鼻炎患者联合治疗的临床研究[J].中国医药科学,2016,6(18):197-200.
[3] Song Y, Sujatha J, Yang B,etal. Role of Aquaporin Water Channels in Airway Fluid Transport, Humidification, and Surface Liquid Hydration[J].J Gen Physiol, 2001,117(6):573-582.
[4] 许海波,郑鸣.水通道蛋白1,4,5在实验性变应性鼻炎鼻粘膜中的表达及意义[C]//中国解剖学会全国组织学与胚胎学青年学术研讨会,2007.
[5] 韩毅.联合应用鼻窦康雾化复合剂和香菊片治疗慢性鼻窦炎的临床观察[J].实用药物与临床,2007,10(4):219-220.
[6] 李洪辛,姜洪彬,刘姝男,等.绿原酸对小鼠变应性鼻炎的作用及其机制研究[J].中国生化药物杂志,2015,35(6):1-5.
[7] 石青彦,赵勇.香菊胶囊治疗常年性过敏性鼻炎的疗效观察[J].中国医学创新,2012,9(22):105-106.
[8] 孙敬涛,杨宇.香菊胶囊治疗变应性鼻炎疗效及对血清IgE、IL-4及IL-12的影响[J].辽宁中医药大学学报,2015,17(8):176-178.
[9] 贾晓妮,王军宪,成昱霖,等.化香树果序化学成分研究[J].中药材,2016,39(8):1786-1788.
[10] 姜开运,梁茂新.防风潜在功用的发掘与利用[J].中华中医药杂志,2016,31(2):376-379.
[11] 赵秀梅.中药夏枯草的药理作用研究现状[J].内蒙古中医药,2016,35(12):120-122.
[12] 刘远俊,王双平,温娜,等.野菊花提取物活性及机理研究进展[J].广西中医药,2015,38(6):11-13.
[13] 孙秀玲,姜明霞.黄芪药理作用机制的研究进展[J].中医临床研究,2015,7(17):140-141.
[14] 黄川锋,王海鑫,康爱英,等.辛夷对急性酒精性肝损伤小鼠的肝保护作用及机制研究[J].中国临床药理学杂志,2015,31(7):515-518.
[15] 胡红芳.鼻炎清颗粒治疗变应性鼻炎的免疫机制研究[J].中国现代医生,2015,53(4):17-19.
[16] Diamant Z, Boot J D, Mantzouranis E,etal. Biomarkers in asthma and allergic rhinitis[J].Pulm Pharmacol Ther, 2010,23(6):468-481.
[17] Modena B D, Dazy K, White A. Emerging concepts: mast cee involvemennt in allergic diseases[J].Translational Research, 2016,174:98-121.
[18] Bousquet J, Van Cauwenberge P, Khaltaev N. Aria workshop group; world health organization. Allergic rhinitis and its impact on asthma[J].J Allergy Clin Immunol, 2001,108(Suppl 5):S147-S334.
[19] 刘翔毅.盐酸氮卓斯汀鼻喷剂治疗儿童变应性鼻炎疗效分析[J].中国现代医生,2016,54(29):79-81.
[20] 方照舟,金永芬,沈国方,等.糠酸莫米松对小儿常年变应性鼻炎的临床疗效及血清免疫学指标的影响[J].中国现代医生,2015,53(19):93-95,99.
[21] 何碧云.盐酸氮卓斯汀片结合布地奈德鼻喷雾剂治疗变应性鼻炎的疗效观察[J].中国医药科学,2017,7(14):232-234.
[22] Li J, Lin L H, Wang J,etal. Interleukin-4 and interleukin-13 pathway genetics affect disease susceptibility, serum immunoglobulin E levels, and gene expression in asthma[J].Ann Allergy Asthma Immunol, 2014,113(2):173-179.
[23] Yoshida H, Nakaya M, Miyazaki Y. Interleukin 27: a double-edged sword for offense and defense[J].J Leukoc Biol, 2009,86(6):1295-1303.

