铅暴露对体外血脑脊液屏障功能及ZO-1和闭合蛋白表达的影响
刘新秦,郑刚,苏鹏,曹宇鹏,刘杨,刘明朝
(中国人民解放军第四军医大学军事预防医学系军队劳动与环境卫生学教研室,陕西西安710032)
铅暴露对体外血脑脊液屏障功能及ZO-1和闭合蛋白表达的影响
刘新秦,郑刚,苏鹏,曹宇鹏,刘杨,刘明朝
(中国人民解放军第四军医大学军事预防医学系军队劳动与环境卫生学教研室,陕西西安710032)
目的 通过建立体外血脑脊液屏障(BCB)模型,研究铅诱导BCB损伤的可能机制。方法使用Z310细胞建立BCB体外细胞模型,分别加入Pb(AC)22.5,5.0和10.0 mmol·L-1,暴露24,48和72 h。采用跨内皮电阻(TEER)检测法及葡聚糖法检测BCB模型通透性;Western蛋白印迹法和免疫荧光法检测BCB中紧密连接蛋白ZO-1和闭合蛋白表达及分布。结果 与细胞对照组相比,Pb(AC)22.5,5.0和10.0 mmol·L-1暴露48 h对Z310细胞存活率和密度均无明显影响。暴露后第12天,与细胞对照组比较,Pb(AC)25.0和10.0 mmol·L-1组TEER值明显降低(P<0.05),葡聚糖通过率显著增高(P<0.05)。Western蛋白印迹法和免疫荧光法检测结果 显示,与细胞对照组相比,Pb(AC)2各浓度暴露48 h后,ZO-1和闭合蛋白表达水平明显降低(P<0.05)。结论铅暴露能够破坏BCB模型的通透性,其机制可能与抑制紧密连接蛋白的表达有关。
血脑脊液屏障;铅中毒;ZO-1;闭合蛋白
DOl:10.3867/j.issn.1000-3002.2017.06.017
铅是一种在自然界中广泛存在的重金属,其在人体的蓄积可以引起铅中毒,引起包括中枢神经系统在内的全身性毒性[1]。近期危害评估尚未确定铅暴露的“安全级别”[2]。目前的调查结果 显示,在发展中国家,铅暴露相关疾病的发病率显著增高,由铅暴露引起的疾病在全球疾病谱中占近1%[3]。
众所周知,铅具有较强的神经毒性。目前对于铅神经毒性机制的研究主要集中在兴奋性毒性、谷氨酸和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)受体、氧化应激、基因表达和神经递质释放等[4]。脑屏障由血脑屏障、血脑脊液屏障(blood-cerebral spinal fluid barrier,BCB)及脑脊液-脑屏障3部分组成。BCB位于脑室中脉络丛血液与脑脊液之间,由脉络丛上皮细胞组成,具有一定的通透性。BCB在维持大脑稳态中起着很重要的作用,具备高效的屏障作用。
紧密连接是维持脑屏障的基本结构和功能完整性的物质基础[5],是细胞间的特异性结构,其特点主要包括于相邻的细胞之间形成一个半透膜结构,能调节细胞顶端和基底膜之间的细胞旁运输[6-7]。紧密连接包括跨膜蛋白、闭合蛋白、密封蛋白、交界性黏附分子和tricellulin以及胞内蛋白ZO-1等[8-9]。
Z310细胞是经过永生化处理的大鼠脉络丛上皮细胞系,在形态、生理功能和生化功能上能模拟体内脉络丛细胞的特征,常用做研究脉络丛细胞的体外细胞模型[4]。本研究用Z310细胞建立BCB模型,研究铅暴露对BCB通透性的影响及其可能的机制。
1 材料与方法
1.1 试剂和主要仪器
胎牛血清(青岛灏洋生物公司),注射用青霉素钠(黑龙江哈药集团),注射用硫酸链霉素(深圳南方制药有限公司),DMEM高糖型培养基干粉(美国Gibco公司),MTT(美国Sigma公司),BCA蛋白定量试剂盒(美国Pierce公司),RIPA裂解液(强)和PMSF(江苏碧云天公司),兔抗ZO-1单抗、小鼠抗闭合蛋白单抗和Hoechst(美国Invitrogen公司),小鼠抗β肌动蛋白单抗(美国Sigma公司),FITC标记山羊抗兔IgG抗体(北京中衫金桥公司),其余试剂为国产分析纯。BX51FL荧光显微镜和CKX41倒置相差显微镜(日本Olympus公司),微型蛋白质电泳和转移系统(美国Bio-rad公司),Alpha凝胶成像仪(美国Alpha公司),Allegra 64R低温高速离心机(美国Beckman公司),UV-2550紫外可见分光光度计(日本岛津公司),Infinite 200多功能酶标仪(奥地利Tecan公司),NU-2500E型CO2细胞培养箱(英国Forma Scientif公司)。
1.2 细胞传代和培养
Z310细胞用含10%胎牛血清、青霉素100 kU·L-1、链霉素100 g·L-1和表皮生长因子1 nmol·L-1的DMEM高糖培养液,于37℃,5%CO2培养约3 d更换培养液1次,待细胞长满约80%时,用0.25%胰酶-EDTA消化后进行细胞传代。
1.3 MTT检测细胞存活率
取对数期生长细胞,消化,计数,按1×108L-1细胞密度接种96孔板,每孔200 μL,每组设6复孔,边缘孔用无菌磷酸盐缓冲液填充。在5%CO2,37℃孵箱内常规培养,贴壁24 h后,更换培养液,分别加入含Pb(AC)22.5,5.0和10.0 μmol·L-1的培养液,继续作用48 h,设细胞对照组。向每孔中加入20 μL MTT溶液,培养4 h后小心吸走孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min。酶联免疫检测仪上选定波长570 nm(参比波长630 nm),测定吸光度值(A)。相对存活率(%)=铅暴露组(A570nm-A630nm)/对照组(A570nm-A630nm)×100%。
1.4 光镜下观察Z310细胞密度
取对数期生长Z310细胞,消化,计数,按1×108L-1的细胞密度接种90 mm培养皿中,分别设置Pb(AC)22.5,5.0和10.0 μmol·L-1组,同时设细胞对照组。在5%CO2,37℃孵箱内常规培养,贴壁24 h后加入含Pb(AC)2培养液,继续作用48 h。倒置显微镜下拍照记录细胞密度。
1.5 跨内皮电阻(transendothelial electrical resistance,TEER)法检测BCB的通透性
采用对数生长期Z310细胞,消化,重悬,计数至2×108L-1,取0.9 mL加入到Transwell上孔内,下孔加入1.3 mL相同培养液,5%CO2,37℃常规培养。贴壁12 h后,更换培养液。将含有Pb(AC)22.5,5.0和10.0 μmol·L-1的培养基加入到上孔,下孔换同样培养液,同时设细胞对照组。48 h换培养液1次,换液后检测TEER值,记录铅暴露后第1~12天电阻值(Ω)。
1.6 FlTC-葡聚糖实验检测BCB的通透性
检测TEER值后,用PBS 0.01 mol·L-1冲洗内外槽3次,于内槽加入0.8 mL无血清DMEM培养液,外槽加入1.3 mL无血清培养液。向内槽中加入FITC-葡聚糖工作液100 mL,于37℃培养15和30 min,从外槽中吸20 μL培养液,加入到180 μL PBS中稀释,每组设3复孔。用酶标仪在492 nm下激发,520 nm波长下记录发射光,测得荧光强度即代表通透性。
1.7 Western蛋白印迹法检测ZO-1和闭合蛋白表达
取对数生长期Z310细胞,按2×105细胞种入60 mm的皿里,每孔5 mL培养液,常规培养,贴壁12 h后,加入Pb(AC)22.5,5.0和10.0 μmol·L-1,分别作用24,48和72 h后收细胞样品。提取细胞样品总蛋白,进行变性聚丙烯酰胺凝胶电泳(SDSPAGE)及Western蛋白印迹实验。将ZO-1(1∶500)、闭合蛋白(1∶500)和β肌动蛋白(1∶5000)一抗用封闭液稀释后,加于PVDF膜上孵育,于4℃过夜;使用相应二抗加于PVDF膜上,37℃孵育1.5 h;滴加发光液,凝胶成像分析仪记录蛋白条带发光图像,并对蛋白条带进行积分吸光度(integrated absorbance,IA)分析。目标蛋白相对表达水平用IA目标蛋白/IAβ肌动蛋白比值表示。
1.8 免疫荧光法检测ZO-1和闭合蛋白的表达及定位
取对数生长期Z310细胞,消化,计数,按每孔1×105细胞接种6孔板中,每孔加2 mL培养液常规培养,贴壁12 h后,加入Pb(AC)210.0 μmol·L-1继续作用48 h收集细胞样品。将细胞爬片进行固定及透化处理,配制闭合蛋白(小鼠)1∶200和ZO-1(兔)1∶200一抗置于湿盒内,4℃过夜。室温避光60 min。30%甘油封片,荧光显微镜下观察,拍照,进行数据分析,荧光强度代表蛋白表达水平。
1.9 统计学分析
2 结果
2.1 铅暴露对Z310细胞存活率的影响
MTT法结果 (图1)可见,Pb(AC)22.5,5.0和10.0 μmol·L-1暴露48 h对细胞存活率无显著影响。

Fig.1 Effect of Pb(AC)2on cell viability of Z310 cells.Cells were treated with Pb(AC)2for 48 h.x±s,n=6.
2.2铅暴露对Z310细胞密度的影响
光镜观察铅暴露后48 h各组细胞密度的改变(图2)。结果 表明,本实验所选择的铅暴露浓度对细胞密度的影响较小,不会因密度不同而导致紧密连接蛋白表达水平的变化。
Fig.2 Effect of Pb(AC)2on cell density of Z310 cells under light microscope.Cells were treated with Pb(AC)2for 48 h.
2.3 铅暴露对体外BCB屏障通透性的影响
2.3.1 TEER法
图3结果 可见,铅暴露第2天,TEER值>20 Ω,表明模型建立成功。铅暴露第12天,Pb(AC)25.0和10.0 μmol·L-1组TEER值显著低于细胞对照组(P<0.05)。
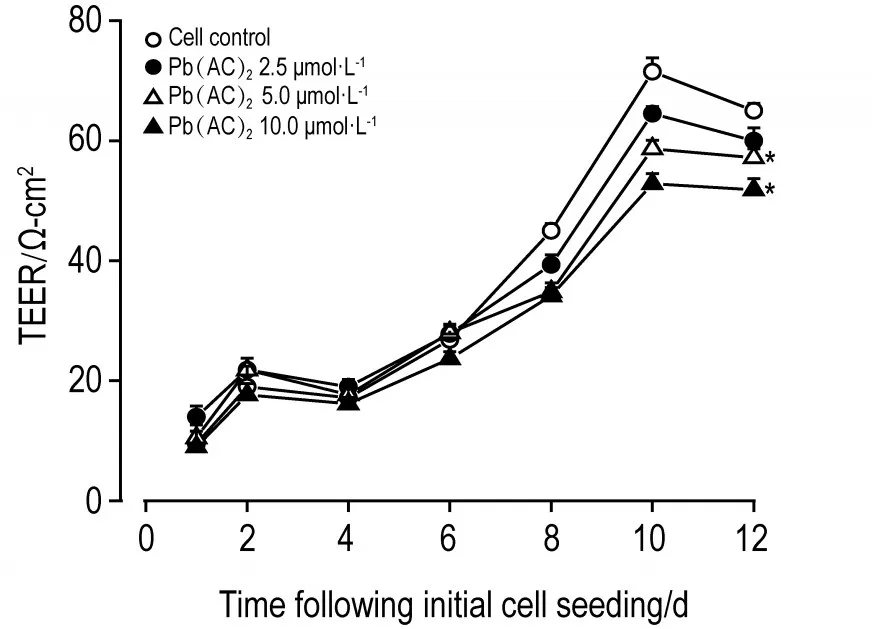
Fig.3 Effect of Pb(AC)2on barrier permeability of bloodcerebral spinal fluid barrier(BCB)in vitroby transendothelial electrical resistance(TEER)assay.Cells were treated with Pb(AC)2for 48 h.x±s,n=3.*P<0.05,compared with cell control group.
2.3.2 FlTC-葡聚糖法
图4结果 可见,在内槽中加入FITC-葡聚糖后,在外槽中葡聚糖含量也逐渐增高。加入葡聚糖30 min后,与细胞对照组相比,Pb(AC)25.0和10.0 μmol·L-1组葡聚糖通过率显著增高(P<0.05)。表明低浓度铅暴露可以造成BCB体外模型屏障通透性增加,引起葡聚糖大分子的通过率增高。
2.4 铅暴露对BCB中ZO-1和闭合蛋白表达的影响
2.4.1 Western蛋白印迹法
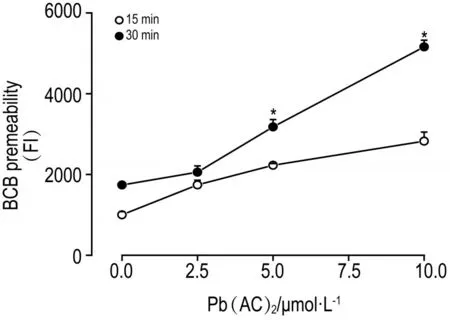
Fig.4 Effect of Pb(AC)2exposure on BCB permeabilityin vitroby FTlC-dextran assay.x±s,n=3.*P<0.05,compared with cell control(0.0)group.
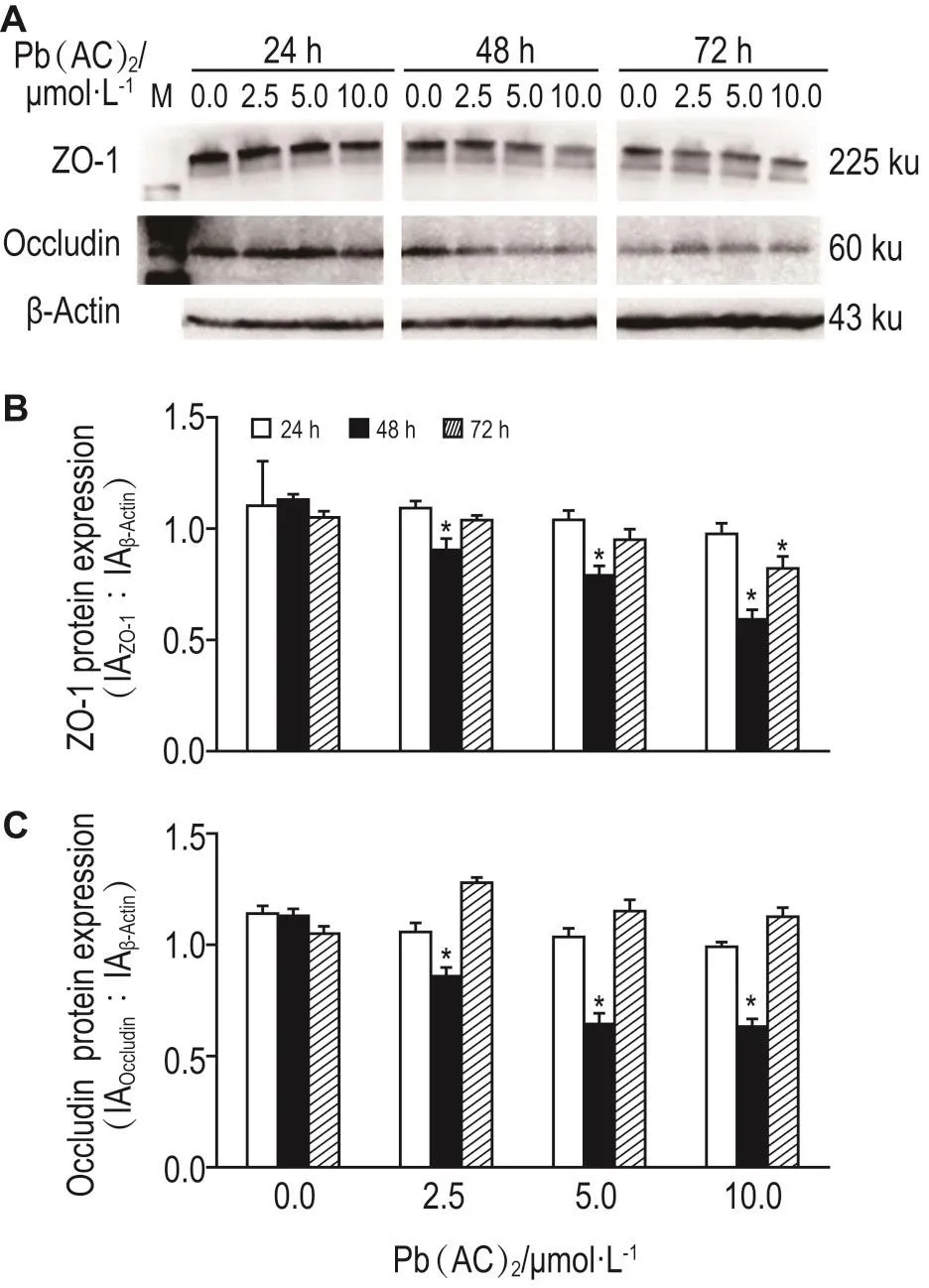
Fig.5 Effect of Pb(AC)2exposure on ZO-1 and occludin protein expression in Z310 cells by Western blotting.B and C were the semi-quantitative results of A.x±s,n=3.*P<0.05,compared with cell control(0.0)group.
铅暴露24 h后,Z310细胞中ZO-1和闭合蛋白蛋白表达均无明显变化;铅暴露48 h后,ZO-1和闭合蛋白水平均明显下降(P<0.05)(图5B);铅暴露72 h后,仅ZO-1蛋白水平下降(P<0.05),闭合蛋白变化不显著(图5C)。
2.4.2 免疫荧光法
免疫荧光法检测结果 (图6)可见,细胞对照组ZO-1在细胞间呈完整的网状结构分布;铅暴露48 h后,铅暴露组细胞间ZO-1分布表现为断续分布;铅暴露组闭合蛋白的分布除呈断续状外,其荧光强度也有一定程度的下降(P<0.05)。表明铅暴露48 h可导致BCB体外模型紧密连接结构破坏,伴有ZO-1和闭合蛋白表达水平下降。
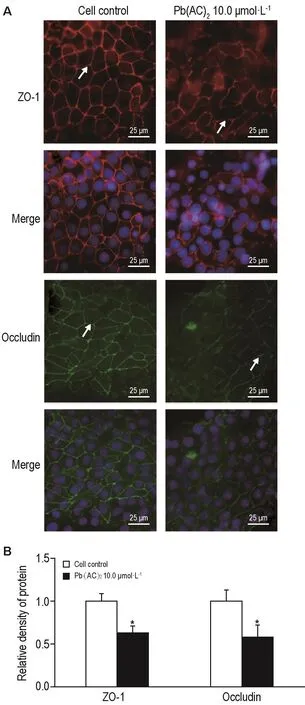
Fig.6 Effect of Pb(AC)2exposure on ZO-1 and occludin protein expression in Z310 cells by immunofluorescence.Immunofluorescence images for ZO-1(red)and Hoechst(blue)or for occludin(green)and Hoechst(blue).The white arrows represent the distribution of protins.B was the semi-quatitative result of A.x±s,n=3.*P<0.05,compared with cell control group.
3 讨论
本研究结果 表明,低浓度的铅暴露可以造成BCB体外模型屏障的完整性破坏,表现为TEER值降低,葡聚糖大分子的通过率增高,紧密连接蛋白ZO-1和闭合蛋白结构破坏且蛋白表达水平下降。BCB位于脑室脉络丛的血液与脑脊液之间,由脉络丛上皮细胞组成,结构基础主要是脉络丛上皮细胞之间有闭锁小带(属紧密连接)相连。脉络丛通过产生和分泌脑脊液来维持中枢神经系统稳态。本研究结果 表明,铅通过破坏体外BCB模型中紧密连接的蛋白结构,从而导致屏障的完整性受到破坏,屏障的通透性增大,导致屏障功能受到影响。紧密连接变化的调控机制有待进一步的研究。
铅作为一种在自然界中广泛存在的重金属,在人体的蓄积可以引起铅中毒,引起包括中枢神经系统在内的全身性毒性,即使是低浓度的铅暴露也会导致神经系统的损伤[10]。尽管我国已经禁止使用含铅汽油,但是铅污染尤其是铅造成的神经损伤,仍值得关注[11]。铅对于中枢神经系统的损伤,主要由于铅对屏障系统中的毛细血管具有较高的亲和力,可以通过损伤大脑毛细血管内皮细胞的膜结构,破坏在内皮细胞间形成的紧密连接,从而通过脑屏障系统进入大脑实质。而屏障系统的结构和功能的损伤可使血液和大脑组织之间的物质交换失去约束,导致大脑微环境平衡的紊乱,在铅神经毒性中可能起到关键作用。BCB中脉络丛通过产生和分泌脑脊液来维持中枢神经系统稳态。铅可以在脉络丛中特异性地聚集,且在动物实验发现,脉络丛中的铅含量具有剂量和时间依赖性。有文献报道,在急性铅暴露后,脉络丛中铅含量比大脑实质中高出57倍;而低剂量慢性铅暴露30 d后,脉络丛中铅的含量是对照的7倍左右,并达到峰值,即使延长染铅时间至60~90 d,也不能增加铅的蓄积量[12]。研究表明,铅染毒可导致BCB通透性增加、分泌和转运功能下降,这可能是铅致中枢神经系统损伤的机制之一[13]。
Zheng等[14]报道,慢性铅暴露可通过降低脑脊液中转甲状腺素蛋白浓度,影响发育期大鼠大脑获取甲状腺素,继而损伤脑发育;相似结果 在体外实验中也得到证实。Zhao等[15]报道,在体外BCB模型中,铅暴露可使铅离子蓄积于脉络丛内皮细胞中,改变了蛋白激酶C活性,加快蛋白激酶C从胞浆到细胞膜的移位,从而破坏BCB屏障功能。而本实验室以往研究表明,铅可以通过激活Src信号通路,从而调控紧密连接蛋白表达水平[16]。今后将进一步探讨转甲状腺素蛋白浓度、细胞信号转导等途径在铅暴露所致BCB通透性改变的具体调控机制,进一步阐明铅神经毒性机制。
[1]Lopes AC,Peixe TS,Mesas AE,Paoliello MM. Lead exposure and oxidative stress:a systematic review[J].Rev Environ Contam Toxicol,2016,236:193-238.
[2]European Food Safety Authority.Scientific opinion on lead in food,EFSA panel on contaminants in the food chain(CONTAM)[J].FSA,2010,8(4):1570.
[3]Fewtrell L,Kaufmann R,Prüss-üstün A,Campbelllendrum D,Corvalán C,Woodward A.Lead:assessing the environmental burden of disease[J]. Environ Burden Dis,2012,2(Suppl):681-683.
[4]Kniesel U,Wolburg H.Tight junctions of the bloodbrain barrier[J].Cell Mol Neurobiol,2000,20(1):57-76.
[5]Schneeberger EE,Lynch RD.The tight junction:a multifunctional complex[J].Am J Physiol Cell Physiol,2004,286(6):C1213-C1228.
[6]Tsukita S,Furuse M,Itoh M.Multifunctional strands in tight junctions[J].Nat Rev Mol Cell Biol,2001,2(4):285-293.
[7]Persidsky Y,Ramirez SH,Haorah J,Kanmogne GD. Blood-brain barrier:structural components and function under physiologic and pathologic conditions[J].J Neuroimmune Pharmacol,2006,1(3):223-236.
[8]Shi LZ,Zheng W.Early lead exposure increases the leakage of the blood-cerebrospinal fluid barrier in vitro[J].Hum Exp Toxicol,2007,26(3):159-167.
[9]Su P,Zhang JB,Wang SW,Aschner M,Cao ZP,Zhao F,et al.Genistein alleviates lead-induced neurotoxicity in vitro and in vivo:Involvement of multiple signaling pathways[J].Neurotoxicology,2016,53:153-164.
[10]Li MM,Cao J,Xu J,Cai SZ,Shen XM,Yan CH. The national trend of blood lead levels among Chinese children aged 0-18 years old,1990-2012[J].Environ Int,2014,71:109-117.
[11]Behl M,Zhang YS,Shi YZ,Cheng JX,Du YS,Zheng W.Lead-induced accumulation of beta-amyloid in the choroid plexus:role of low density lipoprotein receptor protein-1 and protein kinase C[J]. Neurotoxicology,2010,31(5):524-532.
[12]Wang MM,Dong YN,Yan LC,Cao FY,Lyu ZW,Li QZ,et al.Effect of lead exposure on permeability,secretion and transportation function of blood-cerebrospinal fluid barrier of rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(2):188-193.
[13]Zheng W,Shen H,Blaner WS,Zhao Q,Ren X,Graziano JH.Chronic lead exposure alters transthyretin concentration in rat cerebrospinal fluid:the role of the choroid plexus[J].Toxicol Appl Pharmacol,1996,139(2):445-450.
[14]Zheng W,Blaner WS,Zhao Q.Inhibition by lead of production and secretion of transthyretin in the choroid plexus:its relation to thyroxine transport at blood-CSF barrier[J].Toxicol Appl Pharmacol,1999,155(1):24-31.
[15]Zhao Q,Slavkovich V,Zheng W.Lead exposure promotes translocation of protein kinase C activities in rat choroid plexus in vitro,but not in vivo[J]. Toxicol Appl Pharmacol,1998,149(1):99-106.
[16]Shen XF,Huang P,Fox DA,Lin Y,Zhao ZH,Wang W,et al.Adult lead exposure increases blood-retinal permeability:A risk factor for the retinal vascular disease[J].Neurotoxicology,2016,57:145-152.
Effect of lead exposure on function of blood-cerebrospinal fluid barrier and ZO-1 and occludin protein expression in vitro
LIU Xin-qin,ZHENG Gang,SU Peng,CAO Yu-peng,LIU Yang,LIU Ming-chao
(Department of Occupational&Environmental Health,School of Public Health,the Fourth Military Medical University of PLA,Xi′an 710032,China)
OBJECTlVETo establish an in vitro blood-cerebrospinal fluid barrier(BCB)model to investigate the underlying mechanism of lead-induced BCB injuries.METHODSThe in vitro BCB model was established by Z310 cells.Different concentrations of Pb(AC)2(2.5,5.0 and 10.0 mmol·L-1)were used for 24,48 and 72 h.Transendothelial electrical resistance(TEER)and flux of FITC-dextran were performed to determine the permeability of the in vitro BCB model.Western blotting and immunofluorescence methods were used to observe the expression of tight junction protein ZO-1 and occludin.RESULTSCompared with control group,Pb(AC)22.5,5.0 and 10.0 mmol·L-1exposure for 48 h to Z310 cells had no significant effect on survival rate and density.TEER in different groups was gradually increasing.At the 12thday after Pb(AC)2exposure,the values of TEER and flux of FITC-dextran in Pb(AC)25 and 10 mmol·L-1groups were significantly decreased(P<0.05).Western blotting and immunofluorescence images showed that the expression of ZO-1 and occludin were significantly decreased(P<0.05)after Pb(AC)2exposure for 48 h.CONCLUSlONLead exposure can cause the breakdown of BCB barriers, and this effect may be mediated by reducing the expression of ZO-1 and occludin proteins.
blood-cerebral spinal fluid barrier;lead poisoning;ZO-1;occludin
The project supported by National Natural Science Foundation of China(81472942);and the Fourth Military Medical University Youth Talent Cultivation Plan(4139Z3B6BC)
LIU Ming-chao,E-mail:lmclmc@fmmu.edu.cn
R995
A
1000-3002-(2017)06-0615-06
2017-02-17接受日期:2017-05-22)
(本文编辑:乔虹)
国家自然科学基金(81472942);第四军医大学青年英才培育计划(4139Z3B6BC)
刘新秦,硕士,讲师,主要从事重金属毒理学研究。
刘明朝,E-mail:lmclmc@fmmu.edu.cn

