白芍总苷对硬皮病小鼠的治疗作用及机制研究
张丽霞,古 萍,王 倩,赵 蓓,段西凌.四川省医学科学院·四川省人民医院 皮肤性病研究所(成都 6007);.邛崃市人民医院 皮肤科(邛崃,6530)
·论 著·
白芍总苷对硬皮病小鼠的治疗作用及机制研究
张丽霞1,古 萍2,王 倩1,赵 蓓1,段西凌1
1.四川省医学科学院·四川省人民医院 皮肤性病研究所(成都 610072);2.邛崃市人民医院 皮肤科(邛崃,611530)
目的 通过给予硬皮病小鼠白芍总苷干预治疗,观察小鼠皮肤硬化的改善情况,探讨白芍总苷对硬皮病小鼠的治疗作用及可能机制。方法 将BALB/c小鼠随机分为A、B、C3组,分别给予皮下注射磷酸盐缓冲液(A组),博来霉素( B、C组)。4周后,取皮损做病理切片、HE染色,检测羟脯氨酸含量,验证硬皮病模型是否成功。之后,A、B组以生理盐水灌胃,C组白芍总苷灌胃;4周后,检测皮损处羟脯氨酸、TGF-β1和Smad7的表达。结果 1)B、C组注射4周后,注射区皮肤明显硬化、脱毛。组织病理、HE染色及羟脯氨酸含量检测,证实硬皮病模型成功建立。2)实验8周后,组织HE染色提示: B组真皮层明显增厚,胶原纤维明显增多增粗,排列致密;C组较B组,其真皮层变薄,胶原纤维减少,排列疏松;羟脯氨酸含量比较:C组(313.556±40.660)明显低于B组(419.850±52.530),差异有统计学意义(P<0.05);而C组(313.556±40.660)稍高于A组(296.909±31.356),差异无统计学意义(P>0.05);免疫组化法测定TGF-β1和P-Smad7的变化:在A组小鼠皮损组织中,均呈弱阳性表达,在B、C组小鼠均呈强阳性表达;B组(1 198.080±376.234,763.500±287.640)的表达均高于A组(275.333±76.255,157.070±49.282)(P <0.05); C组中TGF-β1(836.571±313.656)明显低于B组(1 198.080±376.234),而C组中P-Smad7(1 337.494±405.052)明显高于B组(763.500±287.640),差异有统计学意义(P<0.05)。结论 1)在BALB/c小鼠背部皮下注射博来霉素建立硬皮病模型的方法切实可行;2)白芍总苷可以有效缓解硬皮病皮肤硬化程度,其机制之一可能是通过上调Samd7的表达、抑制TGF-β1的表达,从而减轻皮肤的纤维化。
硬皮病;博来霉素;白芍总苷;
硬皮病发病机制为多种病理途径激活成纤维细胞,使得以胶原蛋白为主的细胞外基质合成和降解失调,沉积于皮肤和各内脏器官,导致皮肤和内脏器官纤维化[1-2]。在纤维化的进程中,TGF-β1/Smads信号转导通路起着至关重要的作用。白芍总苷主要用于治疗类风湿性免疫疾病,如类风湿性关节炎等,练建红等[3]和路景涛[4]等研究表明,白芍总苷有对抗肝、腹膜纤维化的作用,其机制可能与上调Smad7的表达、抑制TGF-β1的表达相关,然而,白芍总苷对抗皮肤纤维化的作用机制目前并无相关报道和研究。本实验利用博来霉素建立硬皮病模型小鼠[5-6],以白芍总苷干预治疗硬皮病小鼠,观察其对小鼠模型的影响,探讨白芍总苷对硬皮病小鼠的治疗效果及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 36只BALB/c小鼠,雄性,体质量16~20 g,6周龄(购于南京动物模式研究所)。将36只小鼠置于SPF级动物房饲养,温度20~22 ℃,普通自来水、鼠饲料喂养。
1.1.2 主要实验试剂 注射用盐酸博来霉素, 15 mg/支(日本化药株式会社);白芍总苷胶囊(宁波立华制药有限公司);羟脯氨酸试剂盒(江莱生物有限公司);兔抗人TGF-β1抗体、兔抗人Smad7抗体(武汉BOSTER有限公司)。
1.2 方法
1.2.1 实验分组、模型构建及给药 36只BALB/c小鼠随机分为3组,每组各12只,分笼饲养。分别给予不同处理:A组给予皮下注射磷酸盐缓冲液,B、C组均给予盐酸博来霉素,500 μg/mL,0.1 mL/d,背部连续注射4周。实验4周后,每组随机抽取4只小鼠处死,取小鼠注射区皮损做病理切片、HE染色、羟脯氨酸和胶原含量检测,通过观察这些指标的变化,来验证硬皮病模型是否成功。之后,A、B两组以生理盐水灌胃,C组以270 mg/kg白芍总苷灌胃,0.2 mL/d,连续4周。实验8周后,3组余下小鼠均断颈处死,取小鼠注射区皮损行HE染色、羟脯氨酸及胶原含量检测,应用免疫组化法观察小鼠注射区皮损组织TGF-β1、磷酸化Smad7(P- Smad7)的变化。
1.2.2 收集标本和保存 实验4周及8周后,观察小鼠外观变化,包括皮肤外观、皮肤硬度、毛发情况。选小鼠注射区皮损取材,面积为1 cm×1 cm,将皮损组织分成2份,其中1份保存于10%的福尔马林溶液中,用于HE染色和免疫组化;另1份保存在4 ℃冰箱中,用于羟脯氨酸含量检测。
1.2.3 HE染色 将皮损组织常规石蜡包埋切片,HE染色,光镜观察皮损病理改变。
1.2.4 羟脯氨酸和胶原含量检测 羟脯氨酸是胶原蛋白中所含的特有氨基酸,胶原蛋白合成时需要大量的羟脯氨酸,羟脯氨酸含量可以反应胶原含量。胶原含量=每管羟脯氨酸含量×100/13 ×稀释倍数(100/13是从羟脯氨酸换算为胶原时的计算常数)。小鼠皮损组织羟脯氨酸含量的检测严格按照羟脯氨酸试剂盒的说明书要求进行操作,测出其吸光度。以标准品的浓度为横坐标,标准品的吸光值为纵坐标,绘制出标准曲线,再根据所测样品的吸光值,在标准曲线上即可查得相应浓度,乘以样品稀释倍数,即为样品实际浓度。
1.2.5 免疫组化检测TGF-β1及P-Smad7 在显微镜下观察免疫组化染色切片P-Smad7和TGF-β1的表达情况。P-Smad7、 TGF-β1在成纤维细胞中出现黄棕色、淡黄色、黄色颗粒视为阳性细胞,如没有见到黄棕色、淡黄色、黄色颗粒视为阴性细胞。采用Image-Pro Plus图像分析系统,将每张切片放在400倍镜下,随机选10个视野,并选取阳性区域计算积分光密度值(integral optical density,IOD),IOD值反映阳性产物表达的多少。
1.3 统计学方法
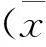
2 结果
2.1 实验4周后结果
2.1.1 小鼠大致外观变化 博来霉素注射4周后,B、C组的小鼠毛发脱落明显,皮肤明显硬化、增厚,皮肤与皮下黏连明显,未见明显皮下血管。A组小鼠皮肤无硬化,与皮下无黏连,皮下血管清晰可见,精神状态好,毛发稍有脱落(图1)。
注:a.A组小鼠未剃毛的注射区;b.A组小鼠剃毛后的注射区;c.B组小鼠未剃毛的注射区;d.B组小鼠剃毛后的注射区;e.C组小鼠未剃毛的注射区;f.C组小鼠剃毛后的注射区
2.1.2 小鼠皮损组织常规HE染色 实验第29天,B、C组小鼠皮损组织HE染色显示,表皮棘层肥厚,真皮增厚,真皮浅部小部分区域见纤维母细胞及纤维细胞增生。真皮深部大部分区域胶原纤维增多、增粗,排列紧密,均质化改变,纤维母细胞稀少,残留成熟纤维细胞核纤细深染,真皮下出现明显炎性细胞浸润。A组小鼠无上述改变(图2)。

图2 3组小鼠第29天皮损HE染色结果
注:a.A组HE染色×100;b.A组HE染色×400;c.B组HE染色×100;d.B组HE染色×400;e.C组HE染色×100;f.C组HE染色×400
2.1.3 小鼠皮损组织羟脯氨酸含量变化 B组及C组的羟脯氨酸含量较A组明显增多(P<0.05);B组及C组的羟脯氨酸含量差异无统计学意义(P>0.05)。建模小鼠的外观、病理变化及羟脯氨酸的含量检测,均提示博来霉素建模成功,且相对比较稳定(表1)。
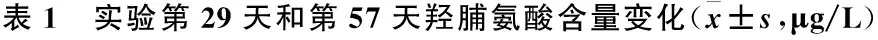

组别第29天羟脯氨酸第57天羟脯氨酸A组287.500±32.912296.909±31.356B组427.455±42.632▲419.850±52.530▲C组421.380±50.511▲313.556±40.660*F13.77417.255P0.002<0.001
注:与A组比较,▲P<0.05;与B组比较,*P<0.05
2.2 实验8周后结果
2.2.1 小鼠外观大致变化 C组在使用白芍总苷干预治疗4周后,小鼠毛发不再脱落,皮肤变软,与皮下黏连有所好转,可见少量毛细血管,而A、B组小鼠较4周前无明显变化(图3)。

图3 3组小鼠第57天情况
注:a.A组小鼠未剃毛的注射区;b.A组小鼠剃毛后的注射区;c.B组小鼠未剃毛的注射区;d.B组小鼠剃毛后的注射区;e.C组小鼠未剃毛的注射区;f.C组小鼠剃毛后的注射区
2.2.2 小鼠皮损组织常规HE染色 实验第57天,B组小鼠皮损组织病理较前无明显变化;C组小鼠皮损组织病理提示真皮变薄,胶原纤维减少,排列较疏松,间质黏液变,病变区域较之前纤维细胞增生,可见间质血管增生,炎性细胞浸润缓解(图4)。

图4 3组小鼠第57天皮损HE染色结果
注:a.A组HE染色×100;b.A组HE染色×400;c.B组HE染色×100;d.B组HE染色×400;e.C组HE染色×100;f.C组HE染色×400
2.2.3 小鼠皮损组织羟脯氨酸含量变化 C组相较于A组,羟脯氨酸的含量稍高,差异无统计学意义(P=0.472);C组相较于B组,羟脯氨酸含量明显减少,差异有统计学意义(P<0.001);B组相较于A组,羟脯氨酸含量明显升高,差异有统计学意义(P<0.001)(表1)。
2.2.4 免疫组化法检测TGF-β1、P-Smad7表达的变化 1)TGF-β1在A、B、C组皮损组织中均呈阳性表达,其阳性染色强度由高到低分别为B、C、A组。以IOD值进行比较:B组明显高于C组及A组,差异有统计学意义(P <0.001);2)P-Smad7在B、C组小鼠背部注射区皮损组织中呈强阳性表达,而在A组皮损组织中呈弱阳性表达。以IOD值进行比较:B组明显高于A组,但低于C组,差异有统计学意义(P<0.001)(图5、表2)。


组别TGF-β1P-Smad7A组275.333±76.255*157.070±49.282*B组1198.080±376.234763.500±287.640C组836.571±313.656*1337.494±405.052*F18.72629.204P<0.001<0.001
注:与B组比较,*P<0.05

图5 TGF-β1及 P-Smad7在小鼠皮损组织中的表达
注:a、g. A组免疫组化染色×200;b、h. A组免疫组化染色×400;c、x. B组免疫组化染色×200;d、y. B组免疫组化染色×400;e、z. C组免疫组化染色×200;f、w. C组免疫组化染色×400;
3 讨论
硬皮病发病机制复杂,尚未被完全阐明,但核心机制是细胞外基质生产过剩,皮肤组织纤维化、硬化。由于医患关系紧张、患者依从性差等原因,导致临床标本收集困难,建立动物模型可以更好地模拟疾病的发生发展,揭示疾病的发病机制,为临床治疗提供新思路和新方法。目前,建立硬皮病动物模型方法比较成熟的是BALB/c小鼠背部注射博来霉素。参照陈艳等[5]、谭利平等[6]和Yamamoto[7]的建模方法,给予B、C组BALB/c小鼠背部注射博来霉素(500 μg/mL),0.1 mL/d,连续注射4周,小鼠精神萎靡,皮肤变硬、增厚,皮损HE染色提示:B、C组较A组小鼠注射区皮损真皮浅部小部分区域见纤维母细胞及纤维细胞增生;真皮深部大部分区域胶原纤维增多增粗,排列紧密,均质化改变,纤维母细胞稀少,残留成熟纤维细胞核纤细深染;羟脯氨酸含量以及胶原含量均明显增多(P<0.05)。该实验结果与诸多国内外学者[5-7]的实验结果相一致,基本判定该硬皮病模型建立成功。
临床上,中药制剂白芍总苷胶囊治疗硬皮病的疗效值得肯定。白芍总苷属于抗炎免疫调节药物[8],对参加细胞免疫的T淋巴细胞、参加体液免疫的B淋巴细胞均有调节作用,其中,T淋巴细胞一般通过其自身分泌的细胞因子参与炎性反应和纤维化发生,B淋巴细胞一般通过产生自身抗体参与疾病的发生,由此推断,白芍总苷对炎性反应和纤维化产生具有调节作用,但其机制尚不明确。因此,本实验拟建立硬皮病模型小鼠后,以白芍总苷干预治疗硬皮病小鼠,观察其对小鼠模型的影响,探讨白芍总苷对硬皮病小鼠的治疗效果及其作用机制。
本实验中,建模成功后,B、C组分别给予生理盐水、白芍总苷灌胃处理4周,同时A组给予生理盐水灌胃处理作对照,结果如下:1)B组与A组相比较,TGF-β1在硬皮病模型小鼠中呈阳性表达,且表达量较A组明显增加;Smad7在硬皮病模型小鼠中呈现阳性表达,表达量较A组稍高。由此表明,TGF-β1/Smad7信号转导在硬皮病模型中可能处于激活状态,与以往的实验结果[5-7]一致。Dong 等[9]对肥大细胞促进成纤维细胞增殖和胶原合成的机制研究中发现,肥大细胞是通过激活TGF- β1/Smad信号传导通路实现的,它不仅可以上调Smad2、Smad3表达,还能上调Smad7表达,形成一个自分泌负反馈循环,只是其所引起的内源性Smad7高表达水平远低于Smad2、Smad3的表达水平,不足以对抗Smad2、Smad3对TGF-β1/Smad信号通路的正反馈调节作用。Tang 等[10]在博来霉素诱导TGF-β1基因敲除小鼠肺纤维化的实验中发现,该小鼠中胶原基质沉积与正常小鼠组比较明显减少,这与Smad7的高表达及TGF-β1/Smad3失活密切相关。TGF-β/Smad信号转导通路在纤维化硬化进程中起到至关重要的作用,涉及到一系列细胞因子调节,其中,最关键的细胞因子为TGF-β1、Smad[11]。TGF-β1与Smad细胞因子参与信号转导的过程:TGF-β1先与TGF-β受体(TRβ)II结合,形成复合物,启动该信号传导,然后该复合物再与TRβI结合,形成TGF-TRβI/TRβII聚合体,使得TRβI磷酸化,从而具有激酶活性,活化的TRβI再将Smad2、Smad3、Smad7磷酸化,磷酸化的Smad2和Smad3分别与Smad4结合形成聚合体转移到细胞核内[12],从而介导I型胶原基因的转录;相反,抑制型Smad7通过与活化的TRβI 结合,阻止R-Smad(Smad2和Smad3)磷酸化,阻碍TGF- β/Smad信号转导[13]。本实验中,TGF-β1、Smad7在B、C组小鼠皮损成纤维细胞的胞浆和胞核中均呈现阳性高表达,但皮肤纤维化同样产生,这说明在硬皮病模型小鼠的TGF-β/Smad信号传导过程中,Smad7对该通路的负反馈作用远低于Smad2、Smad3对该传导通路的正反馈作用,从而促使胶原合成过多,沉积于皮肤形成纤维化。C组与B组相比较,C组小鼠背部皮肤硬化情况明显改善,羟脯氨酸含量明显低于B组;TGF-β1和Smad7均呈现阳性表达,但TGF-β1在C组用白芍总苷干预后的小鼠皮损中呈现明显下调表达,Smad7则呈现上调表达。由此可以看出,白芍总苷治疗硬皮病其机制可能与Smad7的上调表达、TGF-β1的下调表达相关。
[1]Bhattacharyya S, Wei J, Tourtellotte W G,etal. Fibrosis in systemic sclerosis: common and unique pathobiology[J]. Fibrogenesis Tissue Repair,2012, 5(Suppl 1):S18.
[2]张学军. 皮肤性病学(第7版) [M]. 北京:人民卫生出版社, 2008:157.
[3]练建红, 王书浩, 黄家莲, 等. 白芍总苷对大鼠腹膜纤维化转化生长因子-β1/Smad7信号转导通路的影响[J]. 广州中医药大学学报, 2014, 31(1): 109-112.
[4]路景涛, 孙妩弋, 刘浩, 等. 白芍总苷对免疫性肝纤维化大鼠肝组织NF-κB和TGF-β1蛋白表达的影响[J]. 中国药理学通报, 2008, 24(5): 588-592.
[5]陈艳, 雷铁池, 史赢, 等. 环丙沙星对博来霉素诱导小鼠真皮纤维化的抑制作用[J]. 中华皮肤科杂志, 2015, 48(8): 559-563.
[6]谭利平, 尤加锐, 向方华, 等. 温阳活血通络方对SSc小鼠体内TGF-β1与MCP-1水平的影响[J]. 中国免疫学杂志, 2016, 32(11): 1621-1625,1631.
[7]Yamamoto T. Animal model of systemic sclerosis[J]. J Dermatol, 2010, 37(1): 26-41.
[8]王小艳, 陈星宇, 张洪英. 白芍总苷在皮肤科中的应用进展[J]. 中国中西医结合皮肤性病学杂志, 2015, 14(4): 262-264.
[9]Dong X, Zhang C, Ma S,etal. Mast cell chymase in keloid induces profibrotic response via transforming growth factor-β1/Smad activation in keloid fibroblasts[J]. Int J Clin Exp Pathol, 2014, 7(7): 3596-3607.
[10] Tang Y J, Xiao J, Huang X R,etal. Latent transforming growth factor-β1 protects against bleomycin-induced lung injury in mice[J]. Am J Respir Cell Mol Biol, 2014, 51(6): 761-771.
[11] 贾会玉, 李中南, 陈光亮. 糖尿病肾病中转化生长因子β1/Sma和Mad相关蛋白信号通路的作用及其相关药物研究进展[J]. 中国药理学与毒理学杂志, 2016, 30(3): 266-271.
[12] Cocolakis E, Dai M, Drevet L,etal. Smad signaling antagonizes STAT5-mediated gene transcription and mammary epithelial cell differentiation[J]. J Biol Chem, 2008, 283(3): 1293-1307.
[13] Lan H Y. Transforming growth factor-β/Smad signalling in diabetic nephropathy[J]. Clin Exp Pharmacol Physiol, 2012, 39(8): 731-738.
A Study on the Therapeutic Effect of Total Glucosides of Paeony on the Mice with Scleroderma and Its Mechanisms
ZhangLixia1,GuPin2,WangQian1,ZhaoBei1,DuanXilin1.
1.InstituteofDermatologyandVenereology,SichuanAcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,China; 2.DepartmentofDermatology,ThePeople’sHospitalofQionglaiCounty,Qionglai611530,China
Objective To explore the therapeutic effect of total glucosides of paeony (TGP) on the mice with scleroderma by treating them with TGP and observing the changes of their skin and investigate its mechanism. Methods The BALB/c mice were randomly divided into three groups including Group A injected subcutaneously with phosphate buffered saline (PBS), Group B treated with Bleomycin (BLM), and Group C treated with both BLM and TGP. The pathological section was made with skin lesions and the HE staining was performed to detect the hydroxyproline and confirm the establishment of the mouse models with scleroderma after 4 weeks. Then the mice of Group A and Group B were given normal saline by gavage, while the mice of Group C were treated with TGP by means of intragastric administration. The expression levels of hydroxyproline, TGF-β1 and Smad7 in the skin lesions were assayed after 4 weeks. Results Firstly, the mice of Group B and Group C had the symptoms of hardening and unhairing in the injection zone of skin after 4 weeks. The pathological section, HE staining and detection of hydroxyproline content confirmed the successful establishment of the mouse models with scleroderma. Secondly, The results of HE staining after 8 weeks showed that the dermis was thickened obviously, the collagen fiber was increased and thickened, and the arrangement was compact in Group B. Compared with Group B, Group C showed thinner dermis, less collagen fibers, and looser arrangement. The content of hydroxyproline of Group C (313.556±40.660) was significantly lower than that of Group B (419.850±52.530) (P<0.05), while it was a bit higher than that of Group A (296.909±31.356), and the difference was not statistically significant (P>0.05). The level changes of TGF-β1 and Smad7 in the immunohistochemical assay showed weak positive expression in Group A and strong positive expression in Group B and Group C. The expression of group B (1 198.080±376.234,763.500±287.640) was significantly higher than that of group A (275.333±76.255, 157.070±49.282) (P<0.05). The TGF-β1 expression of Group C (836.571±313.656) was significantly lower than that of Group B (1 198.080±376.234)(P<0.05), while the Smad7 expression of Group C (1337.494±405.052) was significantly higher than that of Group B (763.500±287.640) (P<0.05). Conclusion Firstly, The method of establishing the mouse model with scleroderma is feasible by the subcutaneous injection of bleomycin in the dorsal skin of BALB/c mice. Secondly, TGP can effectively alleviate the skin sclerosis of the mice with scleroderma and reduce the skin fibrosis by upregulating the Smad7 expression and inhibiting the TGF-β1 expression, which may be one of the mechanisms.
Scleroderma; Bleomycin; Total glycosides of paeony
http://kns.cnki.net/kcms/detail/51.1705.R.20170331.1041.004.html
10.3969/j.issn.1674-2257.2017.02.007
R593.25
A

