半乳糖凝集素-3在心衰小鼠心室重构发生发展中的变化规律*
何东升,曾小飞,胡 军,贾维坤Δ. 成都医学院第一附属医院 心胸外科 (成都 60500);.成都医学院第一附属医院 心血管内科 (成都 60500)
·论 著·
半乳糖凝集素-3在心衰小鼠心室重构发生发展中的变化规律*
何东升1,曾小飞1,胡 军2,贾维坤1Δ
1. 成都医学院第一附属医院 心胸外科 (成都 610500);2.成都医学院第一附属医院 心血管内科 (成都 610500)
目的 研究压力超负荷心衰小鼠心肌组织中半乳糖凝集素-3(Galectin-3)在心室重构中的作用。方法 选取40只成年雄性昆明小鼠,其中30只采用人工微创主动脉弓缩窄的方法建立压力超负荷心衰小鼠模型(弓缩窄组);10只行假手术作为对照组(假手术组),对两组小鼠心肌重构情况进行评价,同时应用实时荧光定量PCR法检测小鼠心肌组织Galectin-3表达的情况,并探讨Galectin-3在心衰时心室重构发生发展中的作用。结果 术后8周,与假手术组比较,弓缩窄组左心室舒张末期压(LVEDP)明显增加,差异有统计学意义(P=0.001)[1],而左心室收缩压(LVSP)和左心室压力变化最大速率(±dp/dtmax)明显下降,差异有统计学意义(P=0.001),说明模型制备成功;实时荧光定量PCR法结果显示,弓缩窄组小鼠心肌组织Galectin-3的表达较假手术组明显增强,差异有统计学意义(P=0.001)。结论 Galectin-3可能在压力超负荷状态所诱发的心衰中参与心室重构,引起心肌间质胶原沉积和心肌肥厚,进而导致心力衰竭的发生和发展。
半乳糖凝集素-3;充血性心力衰竭;心室重构
半乳糖凝集素-3(Galectin-3)是一种参与多种生理和病理过程的炎性反应介质,其参与细胞的生长、凋亡、肿瘤分化及转移等[1-2]。近年研究[3]表明,在众多心血管疾病中,Galectin-3起着重要的作用,其参与心室重构和充血性心力衰竭(CHF)的病理生理过程,并能预测CHF患者的预后。目前,国内外对Galectin-3与心室重构和CHF的研究较少,且得出的结论也有差异[4]。本研究对小鼠心肌组织 Galectin-3表达水平与心室重构及CHF发生发展进行了初步探讨,现报道如下。
1 材料与方法
1.1 主要药品、试剂及仪器
引物(沈阳海灵兴业商贸有限公司);MMVL一步法RT-CR试剂盒(沈阳海灵兴业商贸有限公司);PCR仪(美国ABI公司);紫外-分光光度计(美国哈希公司);电泳凝胶成像系统(chemilmager5600,上海勤翔公司);BL-420E系统多导生理记录仪(成都金凤有限公司);MF-ChemiBIS3.2图像分析系统(美国UIC公司)。
1.2 方法
1.2.1 主动脉弓缩窄术CHF模型建立 40只成年雄性昆明小鼠(购自沈阳军区总医院实验动物中心),周龄10~12周[2],分为假手术组(10只)和弓缩窄组(30只)[3]。小鼠称重后,戊巴比妥25 mg·kg-1麻醉(腹腔注射);常规消毒后,左侧胸骨旁第一肋间切口入胸腔,切口长约0.5~1.0 cm,游离主动脉弓;于头臂干动脉以及左颈总动脉间套6-0丝线,与一直径约0.5 mm针头结扎一起,后抽离针头,即形成针头直径大小的弓缩窄。对照组为同期假手术组,除主动脉弓处套带后不结扎外,其余过程不变(图1)。
1.2.2 血流动力学检测 小鼠称重后半量麻醉,将其仰卧并固定在手术台,颈部正中切开,游离找出右侧颈总动脉并切开,插入超微型心导管于左心室。采用Nikon4多导生理记录仪监测血液动力学各指标(LVSP、 LVEDP、±dp/dtmax)。监测后处死小鼠,解剖取出心脏,冲洗干净后观察,并对其进行描述,后游离左心室,称左室(LV)质量(包括室间隔)并计算左心室肥厚指数(LVHI)。
1.2.3 组织病理学检测 HE染色步骤:切片脱蜡后使用苏木精染色5 min,洗净后置入1%盐酸中浸泡,放入温水中反蓝后使用浓度为0.5%伊红溶液复染,脱水,用二甲苯溶液透明后封片观察。MASSON染色步骤:切片脱蜡后,滴入三氯化铁和苏木精(1∶1)混合溶液100 μL,5 min后进行分化和冲洗,后滴入酸性品红和苦味酸(1∶9)混合液100 μL进行染色数分钟,分化、脱水、透明、封片,最后置于显微镜下观察,测定心肌胶原容积分数(CVF)。

图1 主动脉弓缩窄法制备小鼠CHF模型示意图
1.2.4 实时荧光定量PCR检测心肌Galectin-3、胶原纤维I、Ⅲ的表达 心肌组织中的mRNA采用异硫氰酸肌-苯酚-氯仿一步法进行提取,按照TR-PCR试剂盒说明书进行操作:加入反应试剂:引物(表1)、Taq酶以及各种RNA样品,加入双蒸馏水至体积30 μL,升温至38 ℃,50 min;PCR所需反应条件:95 ℃ 8 min,90 ℃ 25 s,65 ℃ 40 s,72 ℃ 30 s,以上为1个循环。45个循环后,72 ℃时延伸20 min。将整个反应体系置于SLAN荧光定量PCR仪中,采用相对定量的方法进行监测。
1.3 统计学方法
2 结果
2.1 小鼠各项血流动力学参数
8周后,与假手术组比较,弓缩窄组的LVEDP增加,LVSP和±dp/dtmax明显降低,差异有统计学意义(P<0.05),说明模型制备成功(表2)。

表1 实验引物
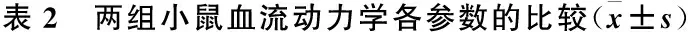

组别 HR/mmHg SBP/mmHgDBP/mmHgLVSP/mmHgLVEDP/mmHg+dp/dtmax/(mmHg/s)-dp/dtmax/(mmHg/s)假手术组术前409.3±12.4112.6±6.484.2±2.1114.1±3.23.9±0.67512.7±203.56594.6±179.6术后420.1±11.1111.9±6.6387.1±2.3112.2±2.34.8±0.97412.5±211.26472.5±212.3弓缩窄组术前411.0±22.8110.3±11.844.9±3.5109.2±4.84.1±0.97409.3±411.26639.2±363.1术后443.0±27.8●▲91.4±5.5●▲72.6±3.4●▲93.2±4.1●▲6.2±1.6●▲5101.2±451.5●5098.1±229.8●▲
注:与同期假手术组比较,●P<0.05;与术前比较,▲P<0.05
2.2 病理组织学检测
2.2.1 LV质量及LVHI 手术后第8周,弓缩窄组小鼠较假手术组LV质量及LVHI 明显增加,差异有统计学意义(表3,图2)。
2.2.2 心室肌组织HE及MASSON染色 弓缩窄组肌纤维排列紊乱,部分区域肌纤维溶解,大量胶原纤维包绕分割心肌细胞,间质增生伴炎性细胞浸润,而假手术组无变化(图3)。
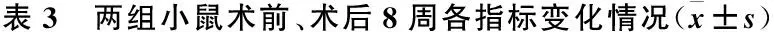

组别LV质量/mgLVHI/(mg/g)假手术组86.1±5.12.9±0.4弓缩窄组109.8±5.94.9±0.2t11.3520.94P 0.001 0.001

图2 两组小鼠术后8周心脏大体标本比较 图3 两组小鼠心室肌组织HE及MASSON染色(×400)
2.2.3 CVF的变化 MASSON染色观察,弓缩窄组较假手术组心室CVF明显增加,差异有统计学意义(t=45.36,P=0.001)。
2.3 实时定量PCR检测心肌Galectin-3、胶原纤维Ⅰ、Ⅲ的表达
与假手术组比较,弓缩窄组的胶原纤维I mRNA、胶原纤维Ⅲ mRNA及Galectin-3 mRNA表达水平明显增高,差异有统计学意义(P<0.05) (表4)。
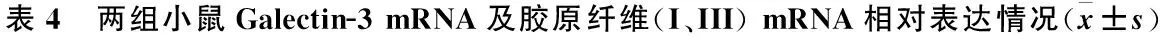
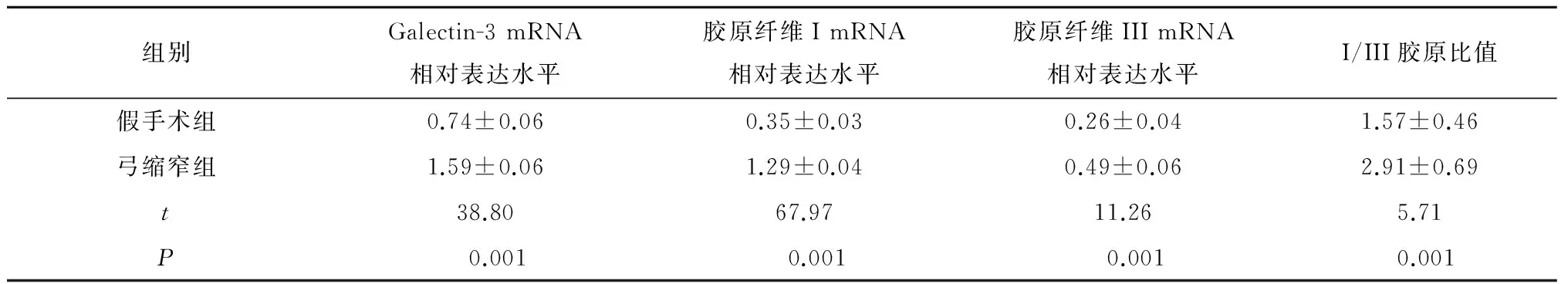
组别Galectin-3mRNA相对表达水平胶原纤维ImRNA相对表达水平胶原纤维IIImRNA相对表达水平I/III胶原比值假手术组0.74±0.060.35±0.030.26±0.041.57±0.46弓缩窄组1.59±0.061.29±0.040.49±0.062.91±0.69t38.8067.9711.265.71P 0.001 0.001 0.0010.001
3 讨论
心室重构是多种因素导致CHF的共同病理进程,其中心肌纤维化(myocardial fibrosis, MF)是引发心室重构的主要病理特征[5]。研究[6]发现,MF是心肌部分区域胶原异常代谢的结果。本研究显示,弓缩窄组小鼠明显具有心肌纤维化及胶原沉积特征,说明心肌纤维化及胶原沉积与心室重构可能存在较直接的关系。心肌胶原中含量最高的为I型和III型胶原,二者均由成纤维细胞(fibroblast,FB)合成并分泌[7]。正常情况下,FB细胞内的胶原mRNA首先合成前α肽链,然后将α肽链羧化成前胶原分子,前胶原分子再经糖化形成前胶原释放至FB细胞外,并最终形成胶原纤维[8]。本研究中弓缩窄组I型、III型胶原mRNA的相对表达水平、I/III胶原比值及CVF均高于假手术组,提示弓缩窄组小鼠心肌胶原合成处于异常状态。
Galectin-3在心肌胶原合成中具有重要作用:Galectin-3为β-半乳糖血凝素,由糖基与非糖基配体结合形成,其C末端结合碳水化合物,N末端结合mRNA,可广泛参与机体细胞生长及凋亡、炎性反应、细胞黏附、免疫等多种生理、病理活动[9]。研究[10]证明,Galectin-3为促有丝分裂原,可通过旁分泌的方式刺激FB增殖。资料[11]显示,Galectin-3可促进LMR-90 FB细胞DNA分子的合成及其细胞增殖,而LMR-90 FB细胞又能够合成Galectin-3,在心肌中,二者相互作用,促进心肌胶原合成。本研究中弓缩窄组小鼠Galectin-3 mRNA的相对表达水平高于假手术组,提示弓缩窄组小鼠Galectin-3合成异常。
Wu等[12]研究证明,Galectin-3可经β/Smad3的路径激活巨噬细胞及FB细胞,使其产生免疫应答,促进巨噬细胞浸润及FB细胞活化,引发心肌纤维化,进而导致心室重构。研究[13]发现,在导致心肌纤维化过程中,Galectin-3并不是直接结合心肌细胞,而是与巨噬细胞、FB细胞特定位点相结合,且其位点多位于纤维化部位。在体外试验中,重组Galectin-3可在导致心肌FB细胞增殖的同时,引发胶原沉积[14]。此外,随着年龄的逐渐增长,人体内聚集的糖基化终末期产物逐渐增多,此时,若出现心衰、氧化应激等生理病理因素,逐渐增加的糖基化终末期产物可提高心肌的纤维化水平[15]。
近年来,随着超声心动图逐渐应用于临床,Galectin-3水平与心室重构之间的关系更加清晰。Shah等[16]研究证明,Galectin-3水平和影像学表现以及心力衰竭患者病死率呈正相关。Lok等[17]证明,Galectin-3水平与LVEDV密切相关,Galectin-3水平越低,LVEDV越小。DirK等[18]研究证明,Galectin-3水平越高,LVEDD增大越明显。Polat等[19]分析不同LVEF主动脉瓣狭窄患者的心肌穿刺结果表明,与正常LVEF患者相比较,LVEF降低的患者心肌Galectin-3明显升高。在本研究中,与假手术组相比较,弓缩窄组小鼠LVSP及±dp/dtmax明显降低,LV质量、LVEDP、VLHI明显增加,且弓缩窄组小鼠Galectin-3 mRNA的相对表达水平高于假手术组,提示Galectin-3水平与小鼠心室重构存在一定的关联。
综上所述, 本研究结果证明,在压力超负荷CHF小鼠心肌组织中,Galectin-3表达明显增加,且Galectin-3的表达水平越高,心肌胶原沉积水平及心肌纤维化程度越高,说明Galectin-3在心肌胶原沉积及心肌纤维化中具有重要作用,其是导致心室重构的重要因素。
[1]Maisel A, Kim P, Stendardi W. Galectin-3 After Heart Transplantation: Does it Get Better[J]. JACC Heart Fail, 2016, 4(11): 857-859.
[2]Grupper A, Nativi-Nicolau J, Maleszewski J J,etal. Circulating Galectin-3 Levels Are Persistently Elevated After Heart Transplantation and Are Associated With Renal Dysfunction[J]. JACC Heart Fail, 2016, 4(11): 847-856.
[3]Bielecka-Dabrowa A, Gluba-Brzózka A, Michalska-Kasiczak M,etal. The multi-biomarker approach for heart failure in patients with hypertension[J]. Int J Mol Sci, 2015, 16(5): 10715-10733.
[4]Lala R I, Puschita M, Darabantiu D,etal. Galectin-3 in heart failure pathology-"another brick in the wall"[J]. Acta Cardiol, 2015, 70(3): 323-331.
[5]李兆欣, 刘江月, 李静静, 等. 不同剂量瑞舒伐他汀治疗对急性心肌梗死患者心肌纤维化及心室重构的影响[J]. 中国循证心血管医学杂志, 2016, 8(1): 46-50.
[6]Zhang Y, Zhang L, Zhang Y,etal. The protective role of liquiritin in high fructose-induced myocardial fibrosis via inhibiting NF-κB and MAPK signaling pathway [J]. Biomed Pharmacother, 2016, 84: 1337-1349.
[7]Yu L, Ruifrok W P, Meissner M,etal. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis [J]. Circ Heart Fail, 2013,6(1): 107-117.
[8]Liu Y H, D'Ambrosio M, Liao T D,etal. N-acetyl-seryl-aspartyl-lysyl-proline prevents cardiac remodeling and dysfunction induced by galectin-3, a mammalian adhesion/growth-regulatory lectin[J]. Am J Physiol Heart Circ Physiol, 2009, 296(2): H404-H412.
[9]Gaze D C, Prante C, Dreier J,etal. Analytical evaluation of the automated galectin-3 assay on the Abbott ARCHITECT immunoassay instruments [J]. Clin Chem Lab Med, 2014, 52(6): 919-926.
[10] Lin Y H, Lin L Y, Wu Y W,etal. The relationship between serum galectin-3 and serum markers of cardiac extracellular matrix turnover in heart failure patients[J]. Clin Chim Acta, 2009, 409(1-2): 96-99.
[11] Felker G M, Fiuzat M, Shaw L K,etal. Galectin-3 in ambulatory patients with heart failure: results from the HF-ACTION study [J]. Circ Heart Fail, 2012, 5(1): 72-78.
[12] Wu A H, Wians F, Jaffe A. Biological variation of galectin-3 and soluble ST2 for chronic heart failure: implication on interpretation of test results[J]. Am Heart J, 2013, 165(6): 995-999.
[13] Christenson R H, Duh S H, Wu A H,etal. Multi-center determination of galectin-3 assay performance characteristics: Anatomy of a novel assay for use in heart failure[J]. Clin Biochem, 2010, 43(7-8): 683-690.
[14] Milting H, Ellinghaus P, Seewald M,etal. Plasma biomarkers of myocardial fibrosis and remodeling in terminal heart failure patients supported by mechanical circulatory support devices[J]. J Heart Lung Transplant, 2008, 27(6): 589-596.
[15] Motiwala S R, Szymonifka J, Belcher A,etal. Serial measurement of galectin-3 in patients with chronic heart failure: results from the ProBNP Outpatient Tailored Chronic Heart Failure Therapy (PROTECT) study [J]. Eur J Heart Fail, 2013, 15(10): 1157-1163.
[16] Shah R V, Chen-Tournoux A A, Picard M H,etal. Galectin-3, cardiac structure and function, and long-term mortality in patients with acutely decompensated heart failure[J]. Eur J Heart Fail, 2010, 12(8): 826-832.
[17] Lok D J, Lok S I, Bruggink-André de la Porte P W,etal. Galectin-3 is an independent marker for ventricular remodeling and mortality in patients with chronic heart failure[J]. Clin Res Cardiol, 2013, 102(2): 103-110.
[18] Dirk Lok, Peter van der Meer, Pieta Bruggink Andre de la Porte,etal. Plasma galectin-3 level predict left ventricular remodeling determined by sequential echocardiography:results from the Eventer-Alkmaar Heart failure study[J].JACC,2010,55(10):E161-E162.
[19] Polat V, Bozcali E, Uygun T,etal. Diagnostic significance of serum galectin-3 levels in heart failure with preserved ejection fraction[J]. Acta Cardiol, 2016, 71(2): 191-197.
The Effect of Galectin-3 on the Ventricular Remodeling in the Mouse with Heart Failure
HeDongsheng1,ZengXiaofei1,HuJun2,JiaWeikun1△.
1.DepartmentofCardiothoracicSurgery,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China; 2.DepartmentofCardiology,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
Objective To investigate the effect of Galectin-3 on the ventricular remodeling in the pressure-overloaded mouse with heart failure. Methods A total of 40 adult male Kun-ming mice were selected.30 of those mice were established for the pressure-overloaded mouse model with heart failure by aortic arch coarctation in a mini-invasive way and divided into the coarctation group, while the other 10 mice underwent the sham operation and divided into the control group. The myocardial remodeling of the two groups was evaluated and Real-Time Fluorescent Quantitative PCR was adopted to assay the expression of galectin-3 in myocardial tissues. Besides, the effect of galectin-3 on the development of ventricular remodeling was investigated in the pressure-overloaded mouse model with heart failure. Results On the 8th week after operation, the left ventricular end-diastolic pressure (LVEDP) increased significantly and the left ventricular systolic pressure (LVSP) and the maximum rise/fall rate of left ventricular pressure (±dp/dt max) decrease significantly in the coarctation group in comparison with the control group. The differences between the two groups were statistically significant (P=0.001), which indicated that the pressure-overloaded mouse model with heart failure was prepared successfully. The PCR results showed that the galectin-3 expression of myocardial tissues in the coarctation group was enhanced more significantly than that in the control group (P=0.001). Conclusion Galectin-3 may play a vital role in the ventricular remodeling after the pressure-overloaded heart failure by leading to collagen deposition and myocardial hypertrophy which would result in the occurrence and development of heart failure.
Galectin-3; Congestive Heart Failure; Ventricular Remodeling
*通信作者:四川省教育厅科研项目(No:16ZB0273)
http://www.cnki.net/kcms/detail/51.1705.R.20170221.2234.002.html
10.3969/j.issn.1674-2257.2017.02.006
R541.6
A
△通信作者:贾维坤,E-mail:hezhuoyang2012@163.com

