硫酸锌诱导金属硫蛋白2表达对脓毒症小鼠脏器损伤的保护作用*
李家丽,杨 汀,刘海荣,樊元春,王晓燕,刘月明Δ.成都医学院 基础医学院(成都 60500);.益阳市中心医院(益阳 4000 );.成都医学院 第一附属医院(成都 60500)
·论 著·
硫酸锌诱导金属硫蛋白2表达对脓毒症小鼠脏器损伤的保护作用*
李家丽1,杨 汀2,刘海荣3,樊元春3,王晓燕3,刘月明3Δ
1.成都医学院 基础医学院(成都 610500);2.益阳市中心医院(益阳 413000 );3.成都医学院 第一附属医院(成都 610500)
目的 研究硫酸锌对金属硫蛋白2(MT2)表达的诱导效应及其对脓毒症小鼠脏器损伤的保护作用。方法 选取健康的6~8周龄雄性C57/6小鼠36只,随机分成假手术组、脓毒症组及硫酸锌干预组,每组12只,观察3组小鼠经不同方法处理后的基本情况。使用ELISA法检测每组小鼠血清中MT2、TNF-α、白介素6(IL-6)、超氧化物歧化酶(SOD)、丙二醛(MDA)浓度,肝组织蛋白质印迹法观察MT2表达量,显微镜下观察肺、肝、小肠组织的病变情况,TUNEL法计算各器官细胞凋亡指数。结果 硫酸锌干预组小鼠死亡率低于脓毒症组;MT2表达量及SOD浓度明显高于脓毒症组及假手术组,差异有统计学意义(P<0.05);脓毒症组小鼠血清炎症因子及MDA水平明显高于其他两组,差异有统计学意义(P<0.05);显微镜下观察显示:硫酸锌干预组各脏器细胞变性坏死及凋亡程度均轻于脓毒症组。结论 锌离子可以诱导C57/6小鼠MT2的表达,降低血清炎症因子的水平,降低血清MDA含量、提高SOD活性,减轻各脏器组织病理性损伤,降低脓毒症小鼠死亡率。
硫酸锌;金属硫蛋白2;脓毒症;抗感染;抗氧化
脓毒症(sepsis)是一种感染因素诱发的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),属烧伤、创伤和大手术等的常见并发症,其是造成临床危重病人死亡的重要原因之一[1- 2]。金属硫蛋白(MT)是普遍存在于各种生物体中的低分子量金属结合蛋白,能增强机体适应能力,在保护机体抵御多种损伤中发挥重要作用[3]。其产生与锌诱导密切相关,在不同病理的作用下,其含量也会发生明显变化[4]。MT是一种可诱导性蛋白,表达调控受各种内外因素的影响,在哺乳动物体内主要有4种亚型[5-6]:MT1、MT2、MT3及MT4,其中MT2在全身组织中表达,且在肝肾中表达水平最高[7]。大量研究[8-9]表明,MT2通过与金属离子结合来调节自由基的水平,具有维持细胞内氧化还原平衡、防辐射、加速炎症修复和延缓衰老等功效。为进一步探讨MT在脓毒症发生发展中的作用,本研究拟探究硫酸锌诱导MT2表达对脓毒症小鼠炎症反应水平和相关脏器损伤的干预效应,现报道如下。
1 材料与方法
1.1 动物与分组
选取6~8周龄健康雄性C57/6小鼠36只,均购自四川达硕实验动物有限公司,饲养于成都医学院科研中心动物房,体质量为 19.9~22.7(21.5±0.8)g,清洁级,自由进食水,饲养环境:12 h 人工白天黑夜循环,室内温度和湿度分别维持在(22±2)℃、50%±2%。
1.2 仪器与试剂
ZnSO4·7H2O(分析纯AR),MTⅠ/ⅡAntibody、GAPDH Antibody(英国Abcam 公司),TNF-α、白介素6(IL-6)、丙二醛(MDA)、超氧化物歧化酶(SOD)ELISA试剂盒(上海酶联生物科技公司),TUNEL 凋亡试剂盒(上海碧云天生物技术有限公司),酶标仪(美国Thermo公司),石蜡切片机(CUT500,德国 ),成像光学显微镜(日本Olympus公司 )
1.3 实验方法
1.3.1 实验动物分组及造模 C57/6小鼠按照随机数字表法分成假手术组、脓毒症组及硫酸锌干预组,每组12只,干预组于实验前连续3 d给予腹腔注射ZnSO4·7H2O 5 mg/(kg·d),假手术组及脓毒症组同时给予同等剂量生理盐水腹腔注射。实验全程自由饮水摄食。结扎穿孔盲肠复制脓毒血症小鼠模型[10-11]。3组均给予4%水合氯醛(0.15 mL/20 g)腹腔注射麻醉[12],常规腹部备皮、消毒、铺无菌纱布洞巾。沿腹中线切开腹壁约 1~1.5 cm,小心分离筋膜肌肉,无菌镊探查夹提盲肠,用3号手术缝线结扎盲肠中段,9号无菌针头于被结扎盲肠盲端横扎穿孔,挤压出少量肠内容物后,将盲肠及肠内容物放回腹腔,操作过程避免损伤肠系膜血管,逐层缝合腹壁。假手术组小鼠只开腹探查,不结扎穿孔。
1.3.2 标本采集及检测 术后48 h持续观察各组小鼠死亡率和生活状态,摘眼球取血后解剖各脏器待检。1)MT2测定:摘眼球取血后,4 ℃冰箱静置30 min后,以 3 500 r/min,离心 15 min 得血清,采取酶联接免疫吸附剂测定(ELISA)法测定血清中的MT含量,设立空白孔,每孔加待测血清,温育,洗涤后所有孔加酶标试剂,温育,洗涤,显色,加终止液,以空白孔调零,450 nm波长依序测量各孔吸光度(OD值),绘制标准曲线,换算各样品MT2含量。取各组小鼠部分肝脏组织,液氮冷冻后反复研磨,经蛋白裂解液裂解后,匀浆冰上静置30 min, 4 ℃离心20 min(12 000 r/min),取上清后测蛋白浓度并计算加样量。制备聚丙烯酰胺(SDS-PAGE)凝胶,电泳,转印,MTⅠ/ⅡAntibody/GAPDH Antibody(1∶1 000,4 ℃过夜)、二抗均室温孵育,洗膜,最后ECL 试剂显色并曝光成像,扫描图像。2)细胞炎性因子及抗氧化指标测定:ELISA法测定血清中的TNF-α、IL-6、SOD、MDA表达水平,所用试剂和方法按照说明书严格操作。3)肺、肝脏、小肠病理组织学观察:每组解剖所得肺、肝脏、小肠组织置10%甲醛固定后,脱水,石蜡包埋,切片,烤片,行HE 染色,光镜下观察各脏器病理改变。
1.3.3 肺、肝脏、小肠组织细胞凋亡检测 末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法(terminal deoxynucleotydyl transferase-mediated dUTP nick end labeling,TUNEL)检测细胞凋亡。各组肺、肝脏、小肠组织石蜡切片常规脱蜡水化;蛋白酶K抗原修复;灭活内源性过氧化物酶;生物素标记;显色;复染;梯度酒精脱水;透明;封片;镜检。成像光学显微镜高倍镜下选取5个不同的高倍视野(×400)观察。凋亡指数=凋亡细胞数/观察细胞总数×100%。
1.4 统计学方法
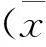
2 结果
2.1 死亡率及生活状态
术后24 h,假手术组、脓毒症组及硫酸锌干预组的死亡率分别为0.0%、41.7%,25.0%;术后48 h,假手术组、脓毒症组及硫酸锌干预组死亡率分别为8.0%,75.0%,50.0%。脓毒症组4只小鼠术后仰卧不起,呼吸急促,余精神萎靡,蜷缩,活动减少,摄食减少,术后6~8 h眼睑部出现分泌物,肛门黏连粪便,随术后时间延长毛发枯燥。硫酸锌干预组小鼠:2只术后仰卧不起,余精神倦怠,行动迟缓,术后12~16 h眼睑出现分泌物。解剖死亡小鼠均可见其腹腔充满浑浊的渗出液,肠道黏连。假手术组小鼠术后苏醒即恢复正常状态。
2.2 MT2含量
硫酸锌干预组、脓毒症组血清及肝组织中的MT2含量明显高于假手术组。ELISA所得数据经方差分析显示,3组间血清MT2含量比较,差异均有统计学意义(F=56.54P<0.001)(图1)。蛋白印记法检测各组肝组织MT表达对比情况表明,炎性刺激可以诱导MT2表达增加,而锌离子刺激小鼠后肝组织上调表达MT2更明显(图2)。
注:与假手术组比较,***P<0.001;与脓毒症组比较,#P<0.05

图2 3组小鼠肝组织中MTⅠ/Ⅱ表达水平
2.3 血清中抗氧化指标结果观察
脓毒症组小鼠血清MDA水平与假手术组比较,明显升高,差异有统计学意义(P< 0.001)(表1);SOD活性明显降低,差异有统计学意义(P<0.001);硫酸锌预处理组能够降低MDA水平(P< 0.05vs.脓毒症组),且MT表达量升高能够有助于提高SOD活性(P<0.05vs.脓毒症组)。上述结果表明,补充硫酸锌提高机体MT表达能够明显降低脓毒症小鼠血清中氧化产物水平,提高抗氧化酶活性,进而提高机体酶类抗氧化系统的防御能力。
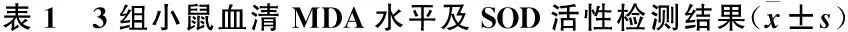

MDA/(nmol/mL)SOD/(U/mL)假手术组11.32±3.11176.14±45.55脓毒症组18.15±5.43***101.39±26.92***干预组14.34±3.21*#148.20±32.20**#F0.2020.212P<0.001<0.001
注:与假手术组比较,*P<0.05,**P<0.01,***P<0.001;与脓毒症组比较,#P<0.05
2.4 细胞炎性因子水平结果
炎性因子水平与脓毒症的病情严重程度呈正相关,脓毒症小鼠血清中TNF-α、IL-6水平明显增加(P<0.001 vs.假手术组),而注射硫酸锌能够明显降低炎性因子的水平(P<0.05vs.脓毒症组),脓毒症组较干预组对炎性刺激更为敏感(表2)。


TNF-α/(ng/L)IL-6/(pg/mL)假手术组187.76±24.5830.14±15.50脓毒症组402.84±43.09***95.62±21.32***干预组352.87±36.90***##77.20±18.78*#F119.339.13P<0.001<0.001
注:与假手术组比较,*P<0.05,***P<0.001;与脓毒症组比较,#P<0.05,##P<0.01
2.5 肺、肝脏、小肠组织结构HE切片病理学观察
2.5.1 显微镜下肺组织病理性损伤表现 假手术组小鼠肺组织结构完整,未见明显病变;脓毒症组小鼠部分肺泡壁破裂融合增厚,局灶肺间隔明显增宽,间质水肿,且见大量炎性细胞弥漫性浸润及炎性蛋白渗出;硫酸锌干预组可见肺泡腔内红细胞渗出,肺间隔略水肿,间质内少量炎性细胞浸润。
2.5.2 显微镜下肝组织的病理性损伤表现 小鼠CLP术后48 h对照假手术组,脓毒症组肝细胞明显浊肿变性,大片细胞核呈碎裂固缩及溶解的典型细胞坏死形态,中央静脉见淤血,肝血窦扩张内见大量炎性细胞浸润;硫酸锌干预组汇管区周围肝组织见水样变性,细胞坏死及肝窦内中性粒细胞及浆细胞浸润程度明显轻于脓毒症组;假手术组肝窦内见个别中性粒细胞,肝细胞未见确切变性坏死,组织形态正常(图3)。
2.5.3 显微镜下小肠组织的病理性损伤表现 脓毒症组肠黏膜腺上皮脱落、坏死严重,固有层水肿、毛细血管充血,间质内可见大量中性细胞及浆细胞聚集;硫酸锌干预组与脓毒症组比较,腺上皮轻度糜烂及水肿,少量炎性细胞浸润,假手术组肠黏膜完整无炎性病变(图3)。

图3 不同组别肺、肝脏、小肠的病理变化
2.6 各组织细胞凋亡指数
与假手术组相比,脓毒症组和硫酸锌干预组肺、肝、小肠凋亡指数均增加(P<0.01);干预组与脓毒症组比较,肺、肝凋亡指数减少(P<0.05),差异均有统计学意义,而小肠凋亡指数比较,差异无统计学意义(图4)。光学显微镜下观察(图5),阳性凋亡细胞表现为细胞核呈棕色或棕褐色着染,部分胞浆也可因胞核DNA碎片溢出而呈阳性着染;正常非凋亡细胞和阴性对照细胞核被苏木素复染成蓝色。

图4 3组细胞凋亡结果对比分析
注:与假手术组比较,P<0.01;与脓毒症组比较,*P<0.05
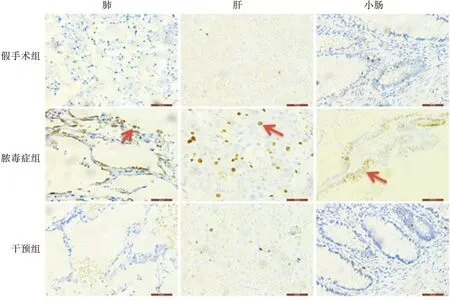
图5 不同组别肺、肝脏及小肠TUNEL染色情况注:←为阳性细胞
3 讨论
脓毒症是感染诱发SIRS造成机体一系列病理生理改变的疾病状态,易并发多脏器功能障碍,迄今发病率、病死率仍居高不下[13-14]。世界范围内对脓毒症的早期防治方法主要以抗炎和对症支持为主,目前尚无相应的治疗手段能阻止多脏器功能障碍的发生,针对脓毒症的有效治疗措施、手段及发病机制探讨一直是危重病医学研究的热点[15]。研究[16-20]表明,多种机制在不同阶段、不同程度参与了脓毒症的病理生理过程。脓毒症的本质是全身炎症反应[21],感染或者非感染因素刺激单核巨噬细胞和内皮细胞产生多种炎症细胞因子,活化不同器官组织细胞,导致机体免疫功能下降。肺、肝脏及肠道均是容易受损的器官,通过炎症介质的释放、缺血缺氧、再灌注损伤及氧化还原失衡等机制,造成多器官屏障系统损害[22]。中性粒细胞激活释放大量的氧代谢产物和蛋白酶导致组织损伤,并且促进炎症的进一步发展[23],大量活性氧化产物病理性集聚得不到及时清除,导致线粒体损伤释放细胞色素酶C促发细胞凋亡[24]。
研究[25]证明,MT能够有效调节金属离子的代谢,参与调节多种炎性疾病,具有强烈清除氧自由基的抗氧化能力,维持机体内环境稳态,从而抵抗细胞凋亡,起到保护机体免受外源致病因素打击的防御性作用。MT2能有效抑制促炎细胞因子和活性氧簇,抵抗缺血性损伤促进细胞再生[26],机体内锌离子水平的增加能够拮抗单核巨噬细胞的凋亡,可能与调节MT基因家族表达有关[27],同时在多种氧化应激状态下,锌离子促使MT表达上调,使机体对外源性不良刺激的抵抗能力有所增强。
本研究采用经典盲肠结扎穿孔方法构建脓毒症模型,由于肠道屏障被破坏,肠内细菌持续性弥漫释放,引发腹膜感染而进展为脓毒症。本实验数据显示:补充外源锌离子一段时间后,可显著提高血清和肝脏的MT2浓度。炎性细胞因子TNF-α,IL-6的测定结果及肺、肝脏、小肠的炎细胞浸润和炎性坏死情况,提示MT2表达增加可降低炎性介质的释放,阻断或减轻全身性炎症反应的进程。
MDA是脂质过氧化的主要产物,其水平可以反映氧自由基对组织的损伤程度;SOD 可催化超氧自由基并发生歧化反应,保护细胞膜免受自由基攻击损伤。本研究对相应组MT2表达量及氧化/抗氧化因子含量进行检测发现:与脓毒症组相比,干预组血清MDA含量较低,SOD 含量较高,差异有统计学意义,印证了MT的抗氧化作用;同时,各脏器病理学损伤和细胞凋亡指数与MDA水平呈正相关,与SOD含量呈负相关,由此推测保护各脏器细胞抵抗凋亡可能与MT2清除氧自由基有关。
综上所述,MT2在脓毒症引起的肺、肝脏及小肠炎性损伤中可起到一定程度保护作用,其机制可能是通过MT2对炎症反应介质的调控,在炎症反应中起到反馈抑制作用及抗氧化清除氧自由基作用等途径共同实现的,但其具体调节机制仍需进一步探讨。
[1]Uhle F, Lichtenstern C, Brenner T,etal. Pathophysiology of sepsis[J]. Anasthesiol Intensivmed Notfallmed Schmerzther, 2015, 50(2): 114-122.
[2]Angus D C, Linde-Zwirble W T, Lidicker J,etal. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care[J]. Crit Care Med, 2001, 29(7): 1303-1310.
[3]Lynes M A, Hidalgo J, Manso Y,etal. Metallothionein and stress combine to affect multiple organ systems[J]. Cell Stress Chaperones, 2014, 19(5): 605-611.
[4]Kotani M, Kim K H, Ishizaki N,etal. Magnesium and calcium deficiencies additively increase zinc concentrations and metallothionein expression in the rat liver[J]. Br J Nutr, 2013, 109(3): 425-432.

[6]Haq F, Mahoney M, Koropatnick J. Signaling events for metallothionein induction[J]. Mutat Res, 2003, 533(1-2): 211-226.
[7]Thirumoorthy N, Shyam Sunder A, Manisenthil Kumar K,etal. A review of metallothionein isoforms and their role in pathophysiology[J]. World J Surg Oncol, 2011, 9: 54.
[8]郑军恒, 李海洋, 茹刚, 等. 金属硫蛋白清除羟自由基功能的研究[J]. 北京大学学报(自然科学版), 1999, 35(4): 573-576.
[9]Vasák M. Advances in metallothionein structure and functions[J]. J Trace Elem Med Biol, 2005, 19(1): 13-17.
[10] 荆喜中, 贾欢欢, 罗挺, 等. 小鼠脓毒症模型的建立和评价[J]. 中国实验动物学报, 2016, 24(2): 158-163.
[11] Cuenca A G, Delano M J, Kelly-Scumpia K M,etal. Cecal ligation and puncture[J]. Curr Protoc Immunol, 2010, Chapter 19: Unit 19.13.
[12] 詹红微, 邱泽文, 李慧玲, 等. 三种麻醉药物对小鼠麻醉效果的比较[J]. 实验动物科学, 2012, 29(4): 19-24.
[14] Vincent J L, Sakr Y, Sprung C L,etal. Sepsis in European intensive care units: results of the SOAP study[J]. Crit Care Med, 2006, 34(2): 344-353.
[15] 孙树印, 刘云海. 脓毒症的治疗进展[J]. 医学综述, 2013, 19(3): 499-501.
[16] 付圆. 脓毒症发病机制的研究进展[J].中国现代医生, 2014, 52(11): 155-157.
[17] Hotchkiss R S, Karl I E. The pathophysiology and treatment of sepsis[J]. N Engl J Med, 2003, 348(2): 138-150.
[18] Wong H R. Genome-wide expression profiling in pediatric septic shock[J]. Pediatr Res, 2013, 73(4 Pt 2): 564-569.
[19] Wiewel M A, van Vught L A, Scicluna B P,etal. Prior Use of Calcium Channel Blockers Is Associated With Decreased Mortality in Critically Ill Patients With Sepsis: A Prospective Observational Study [J]. Crit Care Med, 2017, 45(3): 454-463.
[20] 李益星, 陆二梅, 杨勇, 等. 脓毒症的发病机制研究[J]. 药学研究, 2016, 35(5): 290-294.
[21] Nguyen H B, Smith D. Sepsis in the 21st century: recent definitions and therapeutic advances[J]. Am J Emerg Med, 2007, 25(5): 564-571.
[22] Andrades M E, Ritter C, Dal-Pizzol F. The role of free radicals in sepsis development[J]. Front Biosci (Elite Ed), 2009, 1: 277-287.
[23] Parks D A, Bulkley G B, Granger D N. Role of oxygen-derived free radicals in digestive tract diseases[J]. Surgery, 1983, 94(3): 415-422.
[24] Zeng M, He W, Li L,etal. Ghrelin attenuates sepsis-associated acute lung injury oxidative stress in rats[J]. Inflammation, 2015, 38(2): 683-690.
[25] 赵之伟, 曹冠华, 李涛. 金属硫蛋白的研究进展[J]. 云南大学学报自然科学版, 2013, 35(3):390-398.
[26] Pedersen M, Jensen R, Pedersen D S,etal. Metallothionein-I+II in neuroprotection [J]. Biofactors, 2009, 35(4): 315-325.
[27] Raymond A D, Gekonge B, Giri M S,etal. Increased metallothionein gene expression, zinc, and zinc-dependent resistance to apoptosis in circulating monocytes during HIV viremia[J]. J Leukoc Biol, 2010, 88(3): 589-596.
A Study on the Protective Effect of the Metallothionein-2 Expression Induced by Zinc Sulfate on the Visceral Organs of Mice with Sepsis*
LiJiali1,YangTing2,LiuHairong3,FanYuanchun3,WangXiaoyan3,LiuYueming3Δ.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China;2.YiyangCentralHospital,Yiyang413000,China;3.TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
Objective To investigate the inductive effect of zinc sulfate on the metallothionein-2 (MT2) expression and the protective effect of the MT2 expression on the multiple organ damage in mice with sepsis. Methods Thirty-six healthy male C57/6 mice with the age of 6 to 8 weeks were randomly divided into three groups including the sham surgery group, sepsis group and intervention group, and each group consisted of 12 mice. The basic situations of the mice in the three groups were observed after they were given different treatments. ELISA was used to detect the levels of MT2, TNF-α, IL-6, IL-10, MDA, SOD and MDA in serum. Western blotting was employed to observe the levels of MT2 in liver. HE staining was adopted to examine the morphologic changes of multiple organs. The lesions in lung, liver and intestine were detected and their apoptosis indexes were calculated by TUNEL. Results The mortality rate of the mice in the intervention group was lower than that of the sepsis group, while the expression levels of MT2 and SOD in the intervention group were significantly higher than the those in the sepsis and sham operation groups respectively (P<0.05). The levels of inflammatory cytokines and MDA in the sepsis group were significantly higher than those in the other two groups (P<0.05). Meanwhile, The levels of cell degeneration, necrosis and apoptosis in the intervention group were lower than those in the sepsis group in the microscope. Conclusion Zinc ions could induce the expression of MT2, reduce release of the inflammatory factors and the content of MDA in serum, increase the SOD activity, reduce the pathological damage of organs in mice, and increase the survival rate of mice with sepsis.
Zinc sulfate; Metallothionein-2; Sepsis; Anti-infection; Antioxidant
*通信作者:四川省教育厅科研项目(No:17ZB0128);四川省卫计委科研项目(重点项目)(No: 16ZD039)
http://kns.cnki.net/kcms/detail/51.1705.R.20170327.1001.006.html
10.3969/j.issn.1674-2257.2017.02.004
R459.7
A
△通信作者:刘月明,E-mail:12022889@qq.com

