硫化氢对博来霉素致肺纤维化大鼠TGF-β1介导上皮间充质转化过程影响
涂容芳,曾赛丽,何振华,谭小武,陈 哲,夏叶舟,李雪花
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)起病隐匿、进展迅速、病死率高,严重危害人类健康。多种因素参与了IPF发生发展的过程,其中“损伤修复”机制受到高度关注[1]。近年来研究[2]表明,TGF-β1介导的上皮间充质转化(epithelial-mesenchymal transition,EMT)过程在“损伤修复”过程具有重要作用。H2S是近年来被广泛关注的一种新型气体信号分子,其抗肺纤维化作用已得到包括本实验室在内的国内外多个研究小组的确认,但具体机制尚未阐明[3]。本实验用博来霉素(bleomycin,BLM)气管内给药复制肺纤维化模型,采用外源性NaHS作为H2S供体,通过比较H2S干预前后大鼠肺组织中TGF-β1及EMT过程相关指标E-钙黏素(E-cadherin,E-cad)、波形蛋白(vimentin,VIM)、α-平滑肌蛋白(alpha-smooth muscle actin,α-SMA)的表达变化,从而探讨H2S对肺纤维化EMT过程作用机制,为靶向治疗肺纤维化提供新思路和新方法。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性SD大鼠60只,7~8周龄,体质量280~300 g,购买于长沙市天勤生物技术有限公司(生产许可证号:SCXK[湘]2014-0011),动物饲养于南华大学实验动物部(使用许可证号:SYXK[湘]2020-0002)。实验方案通过南华大学实验动物伦理审查委员会审批(编号:N20190 709003),实验过程中按实验动物使用的“3R”原则给予人道主义关怀。
1.1.2主要试剂与仪器 醋酸泼尼松片剂(浙江新琚医药有限公司生产,5 mg/片,国药准字:H33021207、生产批号:1405172)。注射用盐酸博莱霉素针剂(日本化药株式会社生产,15 mg/支,国药准字:H20090885、生产批号:740422)。NaHS(sodium hydrosulfide)购自美国Sigma公司。兔抗鼠TGF-β1单克隆抗体和兔抗鼠α-SMA体多克隆抗体分别购自美国assaybiotech和美国宜康有限公司;鼠抗人E-cad 单克隆和鼠抗人VIM多克隆抗体均购自美国Epitomics公司。DAB显色剂购自江苏艾佳生物技术有限;RNA提取试剂盒及cDNA合成试剂盒均购自生工生物工程(上海)股份有限公司。主要仪器有:光学显微镜(日本OLYMPUS公司);连续光谱酶标仪(美国Thermo公司);核酸蛋白检测仪、超速冷冻离心机(德国EPPendorf公司);凝胶成像分析系统(美国Bio-Rad公司)。
1.2 方法
1.2.1动物分组 将实验动物随机均分为4组:对照组、博来霉素组、NaHS+博来霉素组、泼尼松+博来霉素组。博来霉素组、NaHS+博来霉素组、泼尼松+博来霉素组气管内灌注 BLM 溶液5 mg/kg建立肺纤维化模型。从造模后第1天开始,NaHS+博来霉素组予NaHS 溶液28 μmol/(kg·d)腹腔注射,泼尼松+博来霉素组予醋酸泼尼松0.56 mg/(kg·d)经胃管灌入,对照组和博来霉素组注射等体积生理盐水。于造模后第7、14、28 d随机处死各组大鼠5只,将大鼠左肺组织4%甲醛固定后行HE 和 Masson染色,HE和Masson染色光学显微镜观察各组肺泡炎和肺纤维化情况,根据Szapiel et al[4]报道的评分方法对各组HE切片行肺泡炎及肺纤维化程度判断 ;免疫组化法测定各组肺组织中TGF-β1、E-Cad、VIM及α-SMA蛋白表达水平。取大鼠右肺组织置于-196 ℃液氮保存,RT-PCR法测定各组肺组织中TGF-β1、E-Cad、VIM及α-SMA的mRNA表达水平。
1.2.2免疫组化方法(SP法)测定各组大鼠肺组织各指标蛋白表达 肺组织石蜡切片,采用SP法按试剂盒要求依次滴加相应浓度抗体,然后对切片依次行显色、脱水、透明、封固、镜检,阴性对照中采用PBS替代一抗行相同操作,测定各组TGF-β1、E-Cad、VIM、α-SMA蛋白表达。
1.2.3RT-PCR法测定肺组织中各指标mRNA的表达 依照试剂盒要求提取总RNA并合成cDNA,按相应条件加入各指标引物并扩增:其中TGF-β1序列F:5′-GAACCAAGGAGACGGAATACAG-3′及R:5′-AACCCAGGTCCTTCCTAAAGTC-3′,退火温度56 ℃,扩增产物长度为299 bp;E-cad序列F:5′-AGGG TCTGAGAAGACAGAAACG-3′及R:5′-GGATAAACT CTGGCCTGTTGTC-3′,退火温度57 ℃,扩增产物长度为351 bp;VIM序列F:5′-AGGCAAAGCAGGAGTCAAAC-3′及R:5′-TCTTCCATTTCACGCATCTG-3′,退火温度57 ℃,增产物长度为115 bp;α-SMA 序列 F:5′-TTCCTTCGTGACTACTGCTGAG-3′及R:5′-CA ATGAAAGATGGCTGGAAGAG-3′,退火温度55 ℃,扩增长度为209 bp;β-actin序列F:5′-TCAGGTCATCACTATCGGCAAT-3′及R:5′-AAAGAAAGGGTGTAAAACGCA-3′,退火温度50 ℃,扩增长度为432 bp。取扩增产物5 μl经1.5%的琼脂凝胶电泳,测定扩增条带的吸光光度值并计算mRNA的含量表达。
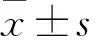
2 结果
2.1 HE和Masson染色光学显微镜观察对照组大鼠肺组织结构正常,HE染色未见明显炎性细胞渗出及出血,Masson染色表现为细支气管壁旁及肺泡间隔内少量胶原纤维沉着。博来霉素组于造模后第7天、14天、28天均出现不同程度肺组织结构破坏、肺泡腔萎陷变窄、塌陷融合甚至消失、肺泡间隔增宽改变、细支气管壁旁及肺泡间隔内炎症细胞浸润、成纤维细胞增生及蓝绿色胶原纤维沉积等改变,以造模后第28天时最明显。与博来霉素组对应时间点相比,NaHS+博来霉素组、泼尼松+博来霉素组大鼠肺组织在肺泡结构改变、炎症细胞浸润及胶原纤维沉积等各方面均有不同程度减轻,且NaHS+博来霉素组减轻程度高于泼尼松+博来霉素组。见图1、2。

图1 各组肺组织第28天HE ×400A:对照组;B:博来霉素组 ;C:NaHS+博来霉素组;D:泼尼松+博来霉素组

图2 各组肺组织第28天Masson染色 ×400A:对照组;B:博来霉素组;C:NaHS+博来霉素组;D:泼尼松+博来霉素组
2.2 肺泡炎及肺纤维化程度判断对各组肺组织HE染色切片进行肺纤维化程度半定量评分,比较造模后第7、14、28天各组肺组织肺泡炎及肺纤维化程度,结果显示各组之间差异有统计学意义(F=286.91、206.160、357.53,P<0.05)。其中博来霉素组、NaHS+博来霉素组、泼尼松+博来霉素组各时间点肺纤维化程度较对照组有不同程度增强(均P<0.05),以博来霉素组造模后第28天降低最多;NaHS+博来霉素组、泼尼松+博来霉素组各时间点肺纤维化程度低于博来霉素组(均P<0.05),以NaHS+博来霉素组造模后第28天降低最多。见表1。

表1 肺泡炎及肺纤维化程度分级积分
2.3 各组肺组织E-cad蛋白及mRNA表达变化比较造模后第7、14、28天各组肺组织E-cad蛋白及mRNA表达水平,结果显示各组之间差异有统计学意义(F=30.833、37.407、100.76,P<0.05;F=214.179、271.22、266.200,P<0.05)。其中博来霉素组、NaHS+博来霉素组、泼尼松+博来霉素组E-cad蛋白和mRNA含量在各时间点较对照组均有下降(均P<0.05),其中 博来霉素组于造模后第28天时下降最多;但NaHS+博来霉素组、泼尼松+博来霉素组E-cad蛋白和mRNA含量在各时间点较博来霉素组有升高(P<0.05),其中以NaHS+博来霉素组造模后第28天升高最多。见图3、4和表2。

图3 各组肺组织第28天E-cad免疫组化 ×400A:对照组;B:博来霉素组;C:NaHS+博来霉素组;D:泼尼松+博来霉素组

图4 各组肺组织 E-cad、TGF-β1、VIM、α-SMA的mRNA表达A:对照组;B:博来霉素组;C:NaHS+博来霉素组;D:泼尼松+博来霉素组;M:DNA Marker

表2 各组大鼠肺组织 E-cad的mRNA和蛋白表达
2.4 各组大鼠肺组织TGF-β1 、VIM、α-SMA蛋白及mRNA的表达变化比较造模后第7、14、28天各组肺组织TGF-β1、VIM、α-SMA蛋白和mRNA表达水平,结果发现各组之间差异有统计学意义(F= 40.278、61.868、71.004,F=60.795、75.407、62.672,P<0.05;F=512.057、864.781、909.960,F=52.301、66.503、48.344,P<0.05;F=387.370、347.623、1 708.940,F=226.534、219.513、778.064,P<0.05)。其中博来霉素组、NaHS+博来霉素组、泼尼松+博来霉素组TGF-β1、VIM、α-SMA蛋白和mRNA含量在各时间点较对照组有升高(均P<0.05),以博来霉素组造模后第28天升高最多;NaHS+博来霉素组、泼尼松+博来霉素组TGF-β1、VIM、α-SMA蛋白和mRNA含量在各时间点较博来霉素组有降低(均P<0.05),以NaHS+博来霉素组造模后第28天降低最多。见图5~7和表3~5。

表3 各组大鼠肺组织 TGF-β1的mRNA和蛋白表达

表4 各组大鼠肺组织VIM的mRNA和蛋白表达

表5 各组大鼠肺组织α-SMA的mRNA和蛋白表达

图5 各组肺组织第28天TGF-β1免疫组化 ×400A:对照组;B:博来霉素组;C:NaHS+博来霉素组;D:泼尼松+博来霉素组

图6 各组肺组织第28天VIM免疫组化 ×400A:对照组;B:博来霉素组;C:NaHS+博来霉素组;D:泼尼松+博来霉素组

图7 各组肺组织第28天α-SMA免疫组化 ×400A:正常组;B:博来霉素组 ;C:NaHS+博来霉素组;D:泼尼松+博来霉素组
3 讨论
H2S是近年来被广泛关注的一种新型气体信号分子,具有抗炎、抗氧化应激、抗增殖、抗凋亡、调节血管张力、修复血管损伤等生物学作用,在肺、肝、肾、心脏等多种疾病中发挥重要作用[5]。哺乳动物体内内源性H2S主要是以体内半胱氨酸为底物,由胱硫醚γ裂解酶(cystathionine-γ-lyase,CSE)和半胱氨酸在磷酸吡多醛-5′-磷酸-依赖性酶胱硫醚β合成酶(cystathionine-β-synthase,CBS)催化形成,而外源性H2S主要可以NaHS为供体,其进入体内后可解释离为Na+和HS-,后者与体内H+结合生成H2S。Tan et al[6]已在多种纤维化动物模型中发现血浆H2S水平有降低,外源性补充H2S可部分逆转纤维化器官的纤维化,因此其被认为是潜在抗纤维化治疗靶点。Hamelet et al[7]发现小鼠缺失 5-磷酸吡多醛依赖性酶后,内源性 H2S 合成减少,小鼠肺纤维化形成,由此可以推测内源性H2S与肺纤维化的病理过程有关。孙 丹 等[8]通过27例IPF患者和28名健康体检者对比发现肺纤维化患者血浆中H2S含量比健康者明显降低,急性加重时H2S含量明显高于症状缓解时,随着肺纤维化病变的进展,H2S含量无明显下降,提示H2S 与肺纤维化严重程度密切相关。本实验结果显示,博来霉素组肺泡炎及肺纤维化程度积分明显高于正常对照组,提示博来霉素致肺纤维化模型造模成功;NaHS+博来霉素组大鼠的肺泡炎及肺纤维化程度较正常对照组有升高,但较博来霉素组及泼尼松+博来霉素组有减轻,提示H2S可有效降低肺泡炎及肺纤维化程度,进一步完善其机制研究可为肺纤维化的治疗提供新策略。
Fang et al[9]研究发现外源性H2S 通过下调TGF-β1表达抑制人类成纤维细胞(MRC5)迁移、增殖和转型为肌成纤维细胞,抑制损伤后异常修复过程,减轻肺纤维化。Gao et al[10]在外源性H2S对肺纤维化大鼠肺组织TGF-β1及结缔组织生长因子的干预作用实验中发现,BLM造模后第7、14、28天大鼠肺组织TGF-β1及CTGF蛋白的表达有明显升高。给予NaHS处理后各期肺组织TGF-β1及CTGF 蛋白表达均有显著下降,进一步证实H2S抗肺纤维化机制可能与抑制TGF-β1有关。TGF-β1是促进纤维细胞激活并向肌成纤维细胞转型的关键作用因子,其功能的发挥依赖于TGF-β1/Smads信号转导通路调控。TGF-β1/Smads信号通路作为目前公认的主要致纤维化通路,除作用于成纤维细胞外,还是诱导EMT过程的关键途径[11]。EMT是指上皮细胞在细胞因子如TGF-β1等介导下失去其特定的内皮细胞标记物如E-Cad,转变为拥有间质标记(如α-SMA、N-cadherin)的肌成纤维细胞并在受损肺泡基底膜处聚集,转变成“成纤维细胞灶”并促进细胞外基质过量分泌(如Ⅰ型胶原蛋白)和肺纤维化发生的过程[12]。郭春玉 等[13]已表明EMT与肺纤维化、心包纤维化、肾脏纤维化及类癌纤维相关等疾病密切相关,是成纤维化细胞灶的重要来源之一。Bai et al[14]研究表明外源性H2S可通过调节TGF-β1/Smad2/3信号通路抑制百草枯诱导的A549细胞上皮间充质转化过程减轻肺纤维化。于是课题组推测H2S可通过TGF-β1介导抑制EMT过程,减轻肺纤维化。本实验通过SP及PCR法测定BLM致大鼠肺纤维化模型中E-cad、TGF-β1、VIM和α-SMA的表达水平,结果显示:与对照组相比,博来霉素组从第7天开始TGF-β1及间质标志物VIM、α-SMA的蛋白和mRNA水平不断增强,而上皮细胞标志物E-cad的蛋白和mRNA水平均出现持续降低,肺纤维化程度逐渐发生,提示模型组大鼠肺组织造模成功并出现了EMT改变,由此推测EMT为肺纤维化发生重要过程,且与TGF-β1密切相关,阻断该过程有可能会减轻肺纤维化。糖皮质激素如泼尼松片是一种传统抗纤维化药物,但临床因副作用大及总体获益有限等原因已不被临床推荐,但仍被认为对照实验疗效分析常规药物。本实验加入NaHS及泼尼松进行干预后发现各时间点NaHS+博来霉素组和泼尼松+博来霉素组TGF-β1、VIM和α-SMA蛋白和mRNA水平较博来霉素组有不同程度降低,而E-cad的蛋白和mRNA水平较博来霉素组有不同程度升高,且均以NaHS+博来霉素组第28天时明显,提示H2S可能通过降低TGF-β1水平抑制EMT过程减轻肺纤维化。
IPF病死率高且预后极差,严重危害人类健康,依据2018年特发性肺纤维化诊断临床实践指南[15],目前尚无特效治疗药物。近年来吡啡尼酮、尼达尼布等新型抗纤维化药物相继问世,但因其价格昂贵且副作用大、疗效不完全确切,临床尚未广泛使用。深究H2S/TGF-β1/EMT信号通路,不仅可进一步揭示肺纤维化发生机制,还可为靶向治疗肺纤维化提供新方向。

