环氧合酶2抑制剂NS-398对人肝癌细胞SMMC-7721增殖与凋亡的影响
方艳秋,齐亚灵,芦小单,马寅芙,谭 岩
(1.吉林省人民医院肿瘤生物治疗中心,吉林 长春 130021;2.佳木斯大学基础医学院组织胚胎学教研室,黑龙江 佳木斯 154007)
环氧合酶2(cyclooxygenase-2,COX-2)是花生四烯酸AA合成前列腺素过程的重要限速酶,COX-2将AA代谢成各种前列腺素产物,参与维持机体的各种生理和病理过程[1]。COX-2抑制剂通过多种机制发挥抗肿瘤作用,其可能机制包括:抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、影响细胞周期进程和抗新生血管形成等[2]。目前COX-2抑制剂也被应用于肝细胞癌的治疗,但其抑制肝癌细胞的具体机制尚不清楚。本研究在以往研究的基础上,以肝癌细胞SMMC-7721为研究对象,分析COX-2抑制剂NS-398对肿瘤细胞形态、细胞周期、增殖和凋亡等的影响,进一步探讨COX-2抑制剂的抗肿瘤作用机制和应用前景。
1 材料与方法
1.1 细胞、主要试剂和仪器 SMMC-7721肝癌细胞由本室传代培养;IMDM培养基、NS-398、噻唑蓝(MTT)、二甲基亚枫(DMSO)和胰蛋白酶购自美国Sigma公司,胎牛血清购自美国Gibco公司,Annexin V-FITC凋亡检测试剂盒购自美国Biovision公司;FACSCalibur型流式细胞仪购自美国BD公司。
1.2 细胞培养及主要试剂配制 人肝癌SMMC-7721细胞在37℃、5%CO2和95%空气饱和湿度培养箱中,用含10%胎牛血清的IMDM培养液常规培养。NS-398(用DMSO配制,使用时培养液中DMSO百分浓度不超过0.1%)终浓度为10g·L-1,4℃保存。MTT终浓度为5g·L-1。4℃避光保存,可用2周。
1.3 细胞分组及给药 将对数生长期的SMMC-7721细胞常规消化,制成单细胞悬液并计数,分别接种于96孔培养板和35mm培养瓶中,孵育24h,待细胞贴壁后将NS-398加入培养液中。细胞分 为 正 常 对 照 组 和 25、50、75、100、150μmol·L-1NS-398 组,每 组 选 取 作 用 24、48和72h3个时间点进行检测。
1.4 细胞悬液制备 在NS-398作用的不同时间点(24、48、72h),应用胰蛋白酶消化并收取培养的SMMC-7721细胞(由于受药物的影响,一些细胞脱落至培养液中,所以要同时收集贴壁生长的细胞和培养液中的细胞),1 000r·min-1离心5min,洗涤2次,70%冷乙醇固定,4℃保存。
1.5 流式细胞术检测细胞周期和细胞凋亡率 采用流式细胞术和Annexin V-FITC/PI双染色法进行检测,按照说明书操作。收集1×106个细胞,500~1 000r·min-1离心5min,加入500μL 1×Binding Bufer,1 000r·min-1离心5min,加入5μL V-FITC和5μL PI,室温避光孵育15min。上机检测前以500目筛网过滤。以0.1%Triton X-100作用1h作为细胞坏死的阳性对照,以0.01mmol·L-1地塞米松作用3h作为细胞凋亡的阳性对照。
1.6 细胞坏死和凋亡结果判断 凋亡细胞对所有用于细胞活性鉴定的染料(如PI)有拒染性,坏死细胞则不能。细胞膜有损伤细胞的DNA可被PI着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期PI不会着染而无红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为FITC-/PI-);右上象限显示非活细胞,即坏死细胞,为FITC+/PI+;而右下象限显示凋亡细胞,显现FITC+/PI-。细胞凋亡指数(AI)=(亚二倍峰细胞数/总细胞数)×100%。
1.7 MTT法检测细胞生长抑制率 取对数生长期SMMC-7721细胞,常规胰酶消化,制成单细胞悬液并计数,以每孔1×104个细胞共200μL接种于96孔培养板中,37℃、5%CO2培养12~24h,待细胞完全贴壁生长后,换液并加入不同浓度的NS-398,设无NS-398作用组作为空白对照(加入等量溶剂)。分别孵育24、48和72h后,每孔加入20μL MTT孵育4h后以DMSO每孔150μL终止反应。将96孔板移入平板震荡器,水平震荡10min。用酶联免疫检测仪于490nm波长处测定吸光度(A)值,以空白对照孔A值调零,记录结果。细胞生长抑制率 =(1- 实验组A值/对照组A值)×100%。
1.8 统计学分析 采用SPSS 13.0统计软件进行统计学处理。细胞凋亡率和细胞生长抑制率以(±s)%表示, 组 间 差 异 比 较 采 用 Oneway ANOVA分析。
2 结 果
2.1 各组SMMC-7721细胞形态学 SMMC-7721
细胞生长较快,72h传代1次,倒置显微镜下可见正常生长的细胞呈单层、多边形贴壁生长,细胞轮廓较清晰。NS-398作用24h后,25μmol·L-1NS-398组培养瓶中细胞生长与正常对照组无明显差别;50与75μmol·L-1NS-398组细胞中增殖较慢,细胞数量少;100μmol·L-1NS-398组培养瓶中细胞增殖不明显,少量细胞变圆呈球型、较亮;150μmol·L-1NS-398组培养瓶中细胞生长被抑制,球形细胞增多。NS-398作用48h后,
25μmol·L-1NS-398组培养瓶中少量细胞变圆呈球型、较亮;100μmol·L-1NS-398组培养瓶中较多细胞变圆呈球型、较亮,贴壁生长细胞较少;150μmol·L-1NS-398组培养瓶中可见细胞悬浮,培养液变浑浊。NS-398作用72h后,100和150μmol·L-1NS-398组培养瓶中贴壁生长细胞很少,部分漂浮于培养液中,培养液浑浊。。
2.2 各组细胞周期及凋亡率 NS-398作用后能够引起SMMC-7721细胞周期发生改变,与正常对照组比较,其他各组细胞G0/G1期比例明显降低,G2/M期比例有升高趋势,这种改变具有明显的时间和浓度依赖关系(图1,见插页四)。正常对照组SMMC-7721细胞无凋亡峰,50μmol·L-1NS-398组SMMC-7721细胞作用24h后可见凋亡峰出现,作用48h后可见明显的亚二倍体峰,作用72h后凋亡峰更为明显(图2和3)。根据作用浓度和时间的不同,SMMC-7721细胞的凋亡率为3.53%~25.22%,且 呈 浓 度 和 时 间 依 赖 性。见表1。

图2 流式细胞术检测作用24h后各组SMMC-7721细胞的细胞周期点状图Fig.2 Scatter gram of cell cycle of SMMC-7721cells 24hafter treatment in various groups detected by FCM
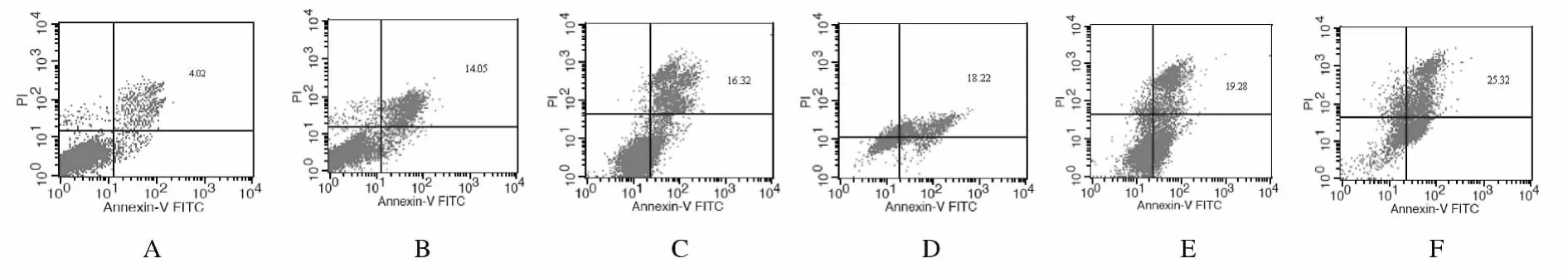
图3 流式细胞术检测作用72h后各组SMMC-7721细胞的细胞周期点状图Fig.3 Scatter gram of cell cycle of SMMC-7721cells 72hafter treatment in various groups detected by FCM
2.3 各组SMMC-7721细胞生长抑制率 采用MTT法测定细胞的生长抑制情况。其抑制剂作用72h 后,25、50、75、100 和 150μmol·L-1NS-398组细胞生长抑制率分别为 10.51% ±2.21%、17.62% ±3.84%、39.81% ±3.48%、45.38%±4.52%和53.38%±4.34%,表明细胞生长活力随药物浓度的增加而降低,呈浓度依赖性。作用24、48和72h后25μmol·L-1NS-398组SMMC-7721细胞的生长抑制率分别为3.59%±1.32%、7.46%±1.05%和10.51%±2.21%,细胞生长抑制率随作用时间的延长而增加,呈时间依赖性。见图4。
表1 各组SMMC-7721细胞凋亡率Tab.1 Apoptotic rates of SMMC-7721cells in various groups [η/(±s)%]
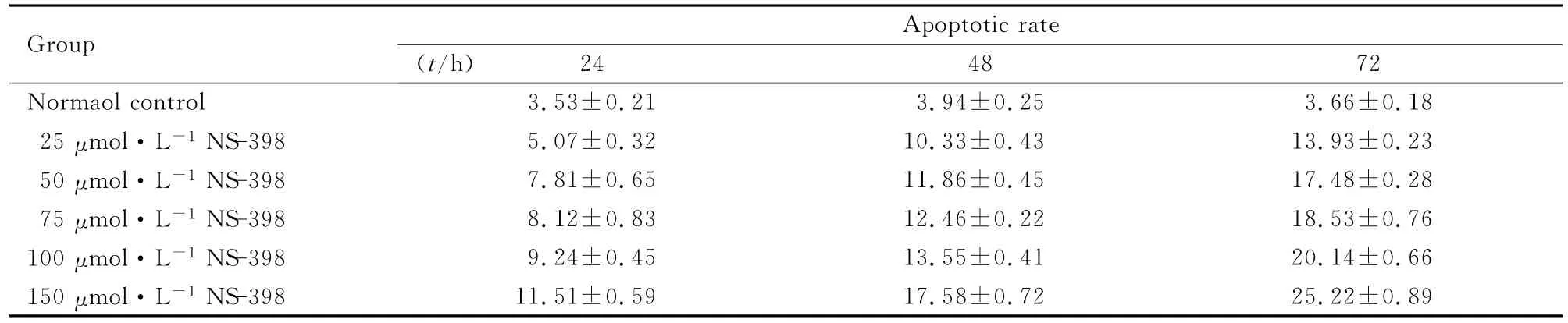
表1 各组SMMC-7721细胞凋亡率Tab.1 Apoptotic rates of SMMC-7721cells in various groups [η/(±s)%]
Group Apop 18 25μmol·L-1 NS-398 5.07±0.32 10.33±0.43 13.93±0.23 50μmol·L-1 NS-398 7.81±0.65 11.86±0.45 17.48±0.28 75μmol·L-1 NS-398 8.12±0.83 12.46±0.22 18.53±0.76 100μmol·L-1 NS-398 9.24±0.45 13.55±0.41 20.14±0.66 150μmol·L-1 NS-398 24 48 72 Normaol control 3.53±0.21 3.94±0.25 3.66±0.totic rate(t/h)11.51±0.59 17.58±0.72 25.22±0.89
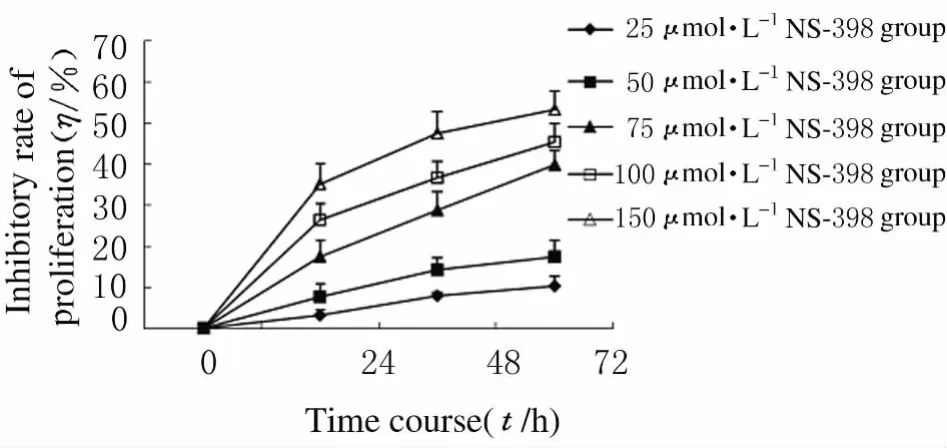
图4 不同时间各组SMMC-7721细胞的生长抑制率Fig.4 Inhibitory rates of proliferation of SMMC-7721cells in various groups at different time
3 讨 论
肝癌是死亡率较高的常见恶性肿瘤之一,严重威胁人类生命健康,全球每年新诊断的肝癌超过60万例,2011年已经达到74.9万例/年;其中,我国每年死于肝癌者约11万人,占全世界肝癌死亡人数的45%。医学在飞速发展,但整体而言对肝癌的关注还是不多,现有的治疗方法有效率也较低。
COX-2抑制剂是非甾体类抗炎药(NSAIDs),可选择性地抑制COX-2,但对COX-1无抑制作用。COX-2抑制剂能够避免长期应用非选择性NSAIDs引起的血小板功能障碍、肾损害和消化道不良反应等副作用[3-4]。除此 之外,COX-2 抑制剂 NS-398能够在大鼠体内逆转高血压[5]。NS-398是选择性COX-2抑制剂,是一种磺胺类制剂的衍生物,可以通过多方面、多途径发挥抗肿瘤作用。有研究[6]证实:NS-398可以抑制人结肠癌细胞株的生长并可诱导癌细胞凋亡,但具体机制目前尚不十分明确。
本研究观察了COX-2抑制剂NS-398作用后人肝癌细胞SMMC-7721的生长状况,通过细胞数量和形态学变化初步判断了NS-398对SMMC-7721细胞的生长抑制作用,在作用24h后,25μmol·L-1NS-398组细胞生长抑制率为3.59%±1.32%,作用72h150μmol·L-1NS-398组细胞生长抑制率 为53.38%±4.34%,这一结果表明NS-398能够明显抑制SMMC-7721细胞的生长,其抑制作用与药物浓度和药物作用时间呈正比。与正常对照组比较,SMMC-7721细胞经不同浓度NS-398作用一定时间后,G0/G1期细胞比例明显下降,G2/M期比例呈上升趋势,说明NS-398的作用使SMMC-7721细胞聚集在G2/M期,因此推测NS-398对SMMC-7721细胞生长的抑制是通过对G2/M期阻滞实现的,并且这种抑制作用表现出良好的时间和浓度依赖性。Toyoshima等[7]在用选择性COX-2抑制剂对鳞状细胞癌细胞系影响(NA)的研究中发现:NS-398诱导COX-2高表达的NA的周期阻滞在G0/G1期,同时伴随周期素依赖性激酶抑制剂p21的上调。可见NS-398可能是通过改变细胞周期进程来抑制肿瘤细胞增生,而细胞周期阻滞也可能引发了细胞凋亡进程,具体机制还有待进一步研究。
肿瘤的发生是多途径、多步骤的,还与细胞凋亡有关,细胞增殖与凋亡之间的平衡失调与肿瘤的发生发展密切相关[8-11]。诱导细胞凋亡的因素很多,内部因素主要受体内某些基因调控,如Bcl-2、caspase和IAP是3个关系比较密切的家族;外界因素有γ射线、缺氧和抗肿瘤药物等。流式细胞术检测细胞凋亡水平具有直观、准确等优势[12-14]。本研究结果显示:NS-398能够引起SMMC-7721细胞发生凋亡,根据作用浓度和时间的不同,SMMC-7721细胞的凋亡范围为3.53%~25.22%,且呈浓度和时间依赖性。而正常生长的SMMC-7721细胞无凋亡峰,50μmol·L-1NS-398组SMMC-7721细胞作用24h后可见凋亡峰出现,作用48h后可见明显的亚二倍体峰,作用72h后凋亡峰更为明显。Kern等[15]对表达COX-2的4种肝癌细胞的研究发现:COX-2抑制剂的凋亡诱导作用与Bcl-2、BAX、AKT/PKB和BAD的磷酸化状态无关联,但与caspase-9、caspase-3及caspase-6的激活有关。还有学者[16-18]研究发现:NS-398能够引起非小细胞肺癌细胞的凋亡。本研究结果显示:选择性COX-2抑制剂NS-398可通过抑制人肝癌SMMC-7721细胞增殖、诱导细胞凋亡而发挥抗肿瘤作用。COX-2抑制剂在抗肿瘤领域具有较好的应用前景。
[1]Yang YH,Yang YH,Cheng CL,et al.The role of chemoprevention by selective cyclooxygenase-2inhibitors in colorectal cancer patients-a population-based study [J].BMC Cancer,2012,12:582-591.
[2]Laube M, Kniess T, Pietzsch J. Radiolabeled COX-2 inhibitors for non-invasive visualization of COX-2expression and activity- a critical update [J]. Molecules,2013,18(6):6311-6355.
[3]Gardiner PS, Gilmer JF. The medicinal chemistry implications of the anticancer effects of aspirin and other NSAIDs[J].Mini Rev Med Chem,2003,3(5):461-470.
[4]Xiao Y,Teng Y,Zhang R,et al.Antitumor effect of the selective COX-2inhibitor celecoxib on endometrial adenocarcinomainvitroandinvivo[J].Oncol Lett,2012,4(6):1219-1224.
[5]Tunctan B,Sari AN,Kacan M,et al.NS-398reverses hypotension in endotoxemic rats:Contribution of eicosanoids,NO,and peroxynitrite [J].Prostaglandins Other Lipid Mediat,2013,104-105:93-108.
[6]Richard HH,Jianyuan C,Andrzej ST.Identifi cation of specific genes and pathways involved in NSAIDs-induced apoptosis of human colon cancer cells [J]. World J Gastroenterol,2006,12(40):6446-6452.
[7]Toyoshima T,Kamijo R,Takizawa K,et al.Inhibitor of cyclooxygenase-2induces cell-cycle arrest in the epithelial cancer cell line via up-regulation of cyclin dependent kinase inhibitor p21[J].Br J Cancer,2002,86(7):1150-1156.
[8]方艳秋,齐亚灵,白 晓,等.Survivin反义寡核苷酸对肝癌细胞株SMMC-7721增殖的影响 [J].吉林大学学报:医学版,2013,39(2):278-281.
[9]Cobbs CS.Cytomegalovirus and brain tumor:epidemiology,biology and therapeutic aspects[J].Curr Opin Oncol,2013,25(6):682-688.
[10]Dubrez L,Berthelet J,Glorian V.IAP proteins as targets for drug development in oncology [J].Onco Targets Ther,2013,9:1285-1304.
[11]Bartuzi P,Hofker MH,van de Sluis B.Tuning NF-κB activity:A touch of COMMD proteins[J].Biochim Biophys Acta,2013,1832(12):2315-2321.
[12]Stuckey DW,Shah K.TRAIL on trial:preclinical advances in cancer therapy [J].Trends Mol Med,2013,26(13):154-158.
[13]Fink MY,Chipuk JE.Survival of HER2-positive breast cancer cells:receptor signaling to apoptotic control center[J].Genes Cancer,2013,4(5/6):187-195.
[14]Dabbagh A,Rajaei S.The role of anesthetic drugs in liver apoptosis[J].Hepat Mon,2013,13(8):e13162.
[15]Kern MA,Schubert D,Sahi D,et al.Proapoptotic and antiproliferative potential of selective cyclooxygenase-2 inhibitors in human liver tumor cells[J].Hepatology,2002,36(4Pt1):885-894.
[16]Qiu R,Chen J,Sima J,et al.NS398induces apoptosis in non-small cell lung cancer cells[J].J Cancer Res Clin Oncol,2012,138(1):119-124.
[17]苟泽鹏,王德盛,周 亮.STAT3蛋白在肝癌组织中的表达及临床意义 [J].临床肝胆病杂志,2013,29(7):520-524.
[18]祝普利,王德盛,周 亮.Notch信号通路在肝癌中的研究进展 [J].临床肝胆病杂志,2012,28(7):556-558.

