顺铂对胶质瘤神经球的凋亡诱导作用及其机制
齐 玲,温 娜,杨淑艳,赵东海,王玮瑶,韩 磊,金 宏
(1.吉林医药学院病理学教研室,吉林 吉林 132013;2.吉林医药学院实验中心,吉林 吉林 132013)
脑肿瘤以恶性胶质瘤最为多见,一经发现即处于晚期,预后极差。近年来研究[1-3]表明:脑肿瘤干细胞(brain tumor stem cells,BTSCs)是恶性胶质瘤发生和耐药的根源,但仍缺乏有效的治疗脑肿瘤的药物。顺铂是最常用的化疗药物之一,顺铂可以诱导多种肿瘤细胞发生凋亡[4]。但关于顺铂对BTSCs的作用及其机制尚未见报道。本课题组培养SHG-44胶质瘤神经球,对顺铂诱导神经球凋亡的作用及其机制进行研究。
1 材料与方法
1.1 细胞、主要试剂和仪器 人脑胶质瘤SHG-44细胞株由吉林大学第一医院神经外科提供;顺铂和MTT购自美国Sigma公司,RPMI-1640购自美国Hyclone公司,神经培养基、小牛血清和B27添加物购自美国Gibco公司,人碱性成纤维生长因子(basic fibroblast growth factor,bFGF)和人表皮生长因子(epidermal growth factor,EGF)购自英国PeproTech公司,Bax、Bcl-2和caspase-3抗体均购自北京中杉公司;CO2培养箱(CB150德国Binder公司),全自动酶标仪(PLUS384美国MDC公司),超低温冰箱(MDFU53V日本三洋公司),倒置显微镜(日本Nikon公司)。
1.2 神经球培养 自液氮罐中取出人脑胶质瘤SHG-44细胞接种于含10%小牛血清的 RPMI-1640培养液中,在37℃、5%CO2和饱和湿度条件下进行培养,隔日换液。待细胞生长至80%~90%,将SHG-44细胞以1×104cm-2的密度接种至75cm2培养瓶,加入干细胞培养液(stem cells media,SCM),包括神经培养基、B27添加物、20μg·L-1EGF和bFGF。继续培养,每3~5d换液1次,传代时机械吹打使神经球成单细胞悬液,按1∶2比例传代,3代以后的神经球用于实验。
1.3 MTT法检测SHG-44神经球生长抑制率取对数生长期的SHG-44神经球,调整细胞浓度为5×105mL-1,以每孔100μL细胞悬液接种于96孔板中,置入37℃、5%CO2培养箱中培养。实验设为对照组和顺铂组,每组5个复孔,对照组只加SCM,顺铂组加入含10mg·L-1顺铂的SCM,分别作用24、48和72h后弃上清,每孔加入MTT 20μL继续孵育4h,弃上清后每孔加DMSO 150μL,震荡15min使结晶充分溶解,在自动酶标仪570nm波长处测定各孔吸光度(A)值,计算细胞生长抑制率:生长抑制率=(对照组A值-实验组A值)/对照组A值×100%。
1.4 ELISA法测定神经球培养上清中Bcl-2、Bax和caspase-3蛋白分泌水平 将SHG-44神经球以1×105mL-1密度接种于24孔培养板中,实验分为对照组(不含药物)和顺铂组(10mg·L-1),作用72h,每组设5个复孔。取细胞培养上清,将上清液与包被液按1∶1比例包被后4℃过液。封闭后加入 Bax、Bcl-2和caspase-3抗体(1∶500稀释)于4℃过夜。加入二抗(1∶1 000稀释)室温下孵育2h,DAB显色液室温避光显色。于自动酶标仪492nm处测定A值,计算Bax/Bcl-2比值。
1.5 统计学分析 采用SPSS 17.0统计软件进行数据分析。各组神经球生长抑制率以(±s)%表示,Bcl-2、Bax 和 caspase-3 蛋 白 分 泌 水 平 以±s表示,组间比较采用t检验。
2 结 果
2.1 各组神经球生长抑制率 10mg·L-1顺铂作用SHG-44神经球24、48和72h,均能明显地抑制神经球细胞的生长。与对照组比较,24、48和72h时顺铂组神经球的生长均受抑制,生长抑制率差异均有统计学意义(P<0.01),以72h时顺铂组神经球的生长受抑制最为明显。见表1。
表1 各组SHG-44神经球的生长抑制率Tab.1 Inhibitory rates of SHG-44neuroshperes in various groups [η/(±s)%]
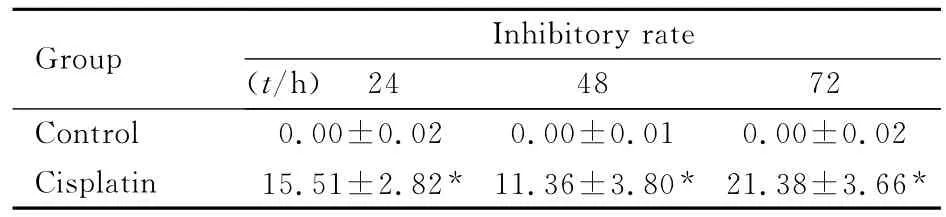
表1 各组SHG-44神经球的生长抑制率Tab.1 Inhibitory rates of SHG-44neuroshperes in various groups [η/(±s)%]
* P<0.01compared with control group.
Group Inhibitoryrate(t/h)24 48 72 Control 0.00±0.02 0.00±0.01 0.00±0.02 Cisplatin 15.51±2.82* 11.36±3.80* 21.38±3.66*
2.2 神经球凋亡形态学 倒置显微镜下观察,在10mg·L-1顺铂作用24、48和72h时神经球数量减少,每个时间段神经球均可见明显的凋亡小体,并随着时间的延长,SHG-44神经球凋亡的细胞越来越多,尤其以72h时最为明显。见图1。
2.3 神经球分泌 Bax、Bcl-2和caspase-3蛋白水平 10mg·L-1顺铂作用SHG-44神经球72h后,神经球分泌Bax和Bcl-2水平均减少,但以Bcl-2减少尤其明显;与对照组比较,差异均有统计学意义(P<0.05)。Bax/Bcl-2比值明显升高,与对照组比较差异有统计学意义(P<0.01)。顺铂组神经球caspase-3分泌量增多,与对照组比较差异有统计学意义(P<0.05)。见表2。
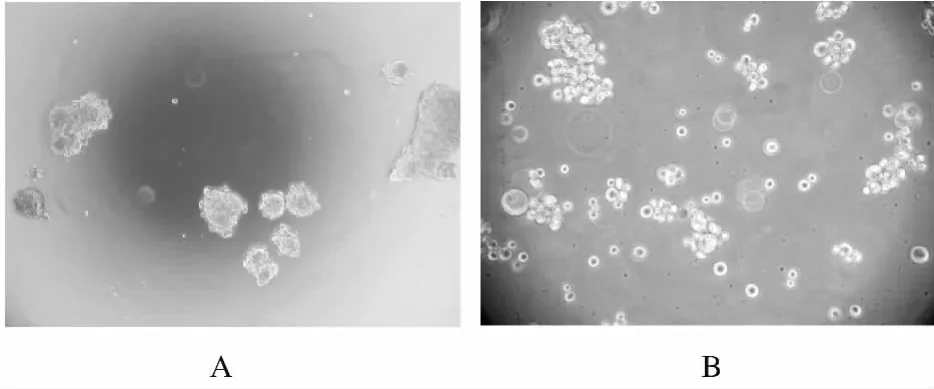
图1 SHG-44神经球凋亡形态学(×200)Fig.1 Morphology of apoptosis of SHG-44neurospheres(×200)
表2 SHG-44神经球分泌 Bax、Bcl-2和caspase-3蛋白水平Tab.2 Levels of Bax,Bcl-2,and caspase-3proteins secreted by SHG-44neuroshperes (±s)

表2 SHG-44神经球分泌 Bax、Bcl-2和caspase-3蛋白水平Tab.2 Levels of Bax,Bcl-2,and caspase-3proteins secreted by SHG-44neuroshperes (±s)
* P<0.05,** P<0.01compared with control group.
ase-3 Control 0.69±0.05 0.53±0.02 1.31±0.24 0.53±Group Bax Bcl-2 Bax/Bcl-2 casp 0.02 Cisplatin 0.58±0.03 0.31±0.04* 1.86±0.21** 0.72±0.04*
3 讨 论
近年来,恶性肿瘤发病率呈现逐年攀升的趋势,在脑肿瘤中以恶性胶质瘤的发病率升高最为明显[5]。这种高恶性的肿瘤给人们的生命健康带来了极大的威胁,给患者及其家庭带来了沉重的负担。研究[6-7]表明:包括胶质瘤在内的恶性脑肿瘤的生长和更新是由脑肿瘤中存在BTSCs所引起,大量的证据[6-7]证实:BTSCs是脑肿瘤发生、复发的根源,也使肿瘤对放化疗抵抗。因此,对脑肿瘤的研究开始集中到对BTSCs的研究方面。
神经球悬浮培养法是1992年由Reynolds和Weiss[9]建立起来的,最初用来分离神经干细胞,在神经球中的细胞仅有10%~50%的细胞具有干细胞特性,其他细胞会继续分化;在SCM中,干细胞、祖细胞和终末分化细胞形成了神经球,分化细胞会在传代时迅速死亡,干细胞则继续增殖再形成神经球,这个过程多次重复后培养体系中就存在大量、稳定的干细胞。之后这一方法也用于BTSCs的研究中[10-11]。本课题组采用该方法培养出具有BTSCs特性的神经球[12],研究常用化疗药物顺铂对神经球凋亡的诱导作用及其机制。
本研究结果显示:10mg·L-1顺铂作用SHG-44神经球24、48和72h时能明显地抑制神经球的生长,各时间段对神经球的生长抑制率均高于对照组;顺铂作用72h时,神经球的生长抑制率升高最为明显。10mg·L-1顺铂作用SHG-44神经球24、48和72h时,倒置显微镜下见到神经球数量明显减少,各组均可见到明显的凋亡小体,并随着时间的延长,凋亡细胞逐渐增多,以72h最为明显。说明10mg·L-1顺铂在不同时间时均可以抑制神经球的生长,镜下观察显示:神经球生长受抑制是由于顺铂诱导神经球发生凋亡,引起神经球数量减少所致。
可以通过多种方式诱导凋亡发生,但线粒体信号转导路径在凋亡的发生中始终起到非常重要的作用。线粒体凋亡路径中的Bcl-2家族成员一直处于凋亡研究的热点[13],研究[14-15]表明:在线粒体上,Bcl-2等抗凋亡蛋白阻断了Bax等的促凋亡作用,当Bcl-2表达水平减少就会降低这种阻遏作用,使Bax等激活进而克服抗凋亡蛋白Bcl-2的作用,改变线粒体膜的生物学特性,促使某些线粒体蛋白的释放[12],引起凋亡发生。在本研究中,10mg·L-1顺铂作用SHG-44神经球72h后,顺铂组Bax/Bcl-2比值明显高于对照组。说明Bax/Bcl-2比值升高使促凋亡因素占据优势,因而促使神经球凋亡发生。但具体凋亡的机制还有待进一步研究。
[1]Wang R,Chadalavada K,Wilshire J,et al.Glioblastoma stem-like cells give rise to tumour endothelium [J].Nature,2010,468(7325):829-833.
[2]Silvestre DC, Pineda-Marti JR, Hoffschir F, et al.Alternative lengthening of telomeres in human glioma stem cells [J].Stem cells,2011,29(3):440-451.
[3]Qi L,Bellail AC,Rossi MR,et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8and the response to TRAIL-induced apoptosis [J].Apoptosis,2011,16(11):1150-1164.
[4]蔡尚霞,侯 军,刘 洋,等.肿瘤坏死因子相关凋亡诱导配体联合顺铂对宫颈癌细胞的杀伤作用 [J].中国实验诊断学,2011,15(7):1172-1173.
[5]徐俊杰,于洪泉,赵 伟,等.西兰花多肽对C6胶质瘤细胞的诱导凋亡作用 [J].吉林大学学报:医学版,2013,39(1):8-11.
[6]Dirks PB.Brain tumor stem cells:the cancer stem cell hypothesis writ large [J].Mol Oncol,2010,4(5):420-430.
[7]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells [J].Nature,2004,432(7015):396-401.
[8]Eramo A,Ricci-Vitiani L,Zeuner A,et al.Chemotherapy resistance of glioblastoma stem cells [J].Cell Death Differ,2006,13(7):1238-1241.
[9]Reynolds BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system [J].Science,1992,255(5052):1707-1710.
[10]Yuan X,Curtin J,Xiong Y,et al.Isolation of cancer stem cells from adult glioblastoma multiforme [J].Oncogene,2004,23(58):9392-9400.
[11]Ricci-Vitiani L,Pedini F,Mollinari C,et al.Absence of caspase 8and high expression of PED protect primitive neural cells from cell death [J].J Exp Med,2004,200(10):1257-1266.
[12]齐 玲,李蕴潜,金 宏,等.胶质母细胞瘤干细胞的分离、培养及其生物学特性 [J].吉林大学学报:医学版,2012,38(6):1058-1062.
[13]齐 玲,杨宁江,杨淑艳,等.Bcl-2家族蛋白和信号传导通路 [J].吉林医药学院学报,2011,32(1):31-33.
[14]Bellail AC,Qi L,Mulligan P,et al.TRAIL agonists on clinical trials for Cancer therapy:The promises and the challenges [J].Rev Recent Clin Trials:Online,2009,23(4):34-41.
[15]李艳凤,唐丽萍,马 超,等.白附子提取物抑制人胃癌SGC-7901细胞增殖及诱导凋亡的机制研究 [J].中国药学杂志,2009,44(16):1237-1240.

