缺氧诱导因子-1α基因沉默逆转卵巢癌细胞SKOV3/DDP耐药性的机制
薛惠荣,王丽萍,耿嘉男,崔满华
(1.中国人民解放军第二二二医院妇产科,吉林 吉林 132011;2.吉林大学药学院实验药理与毒理学教研室,吉林 长春 130021;3.吉林大学第二医院妇产科,吉林 长春 130041)
化疗是治疗卵巢癌的重要手段,有证据[1-2]表明:缺氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)是卵巢癌患者化疗耐药的重要原因。针对其他肿瘤的研究显示:利用各种手段干扰或抑制HIF-1α的表达可明显逆转鼻咽癌细胞[3]、肺癌细胞[4]和结肠癌细胞的耐药性[5],而关于抑制HIF-1α逆转卵巢癌的研究较少。在前期工作中本课题组将自行构建的HIF-1αsiRNA真核表达载体pshRNA-HIF转入卵巢癌顺铂耐药细胞株SKOV3/DDP,结果显示转染后的细胞对顺铂的敏感性明显增高[6]。卵巢癌的耐药机制比较复杂,常常涉及到一系列基因的变化。P-糖蛋白(P-glycoprotein,P-gp)是 由 多 药 耐 药 基 因 1(multidrug resistance 1,MDR1)编码的蛋白产物,P-gp与进入细胞内的脂溶性药物结合后,通过ATP供能将药物排出细胞外。针对6种多向耐药的卵巢癌细胞系研究[7]显示:其耐药性与P-gp的表达水平提高密切相关。B细胞淋巴瘤/白血病-2基因(B cell lymphoma/leukemia-2,Bcl-2)通过调节线粒体细胞色素C的释放从而抑制细胞凋亡,Bcl-2高表达时可阻断大多数抗癌药物和放射线诱导的肿瘤细胞程序性死亡通路而介导MDR。Bcl-2是预示卵巢癌耐药性的独立因素[8],下调Bcl-2的表达水平,则可明显增加卵巢癌细胞对多柔比星的敏感性[9]。通过抑制 HIF-1α表达逆转卵巢癌的研究较少,而从Bcl-2角度探讨其机制的研究尚未见报道。因此本研究以人卵巢癌细胞顺铂耐药株SKOV3/DDP为研究对象观察HIF-1α沉默后MDR1、Bcl-2mRNA和蛋白产物的表达,探讨HIF-1α逆转SKOV3/DDP耐药的可能机制。
1 材料与方法
1.1 细胞和主要试剂 人卵巢癌细胞株SKOV3及其顺铂耐药株SKOV3/DDP由吉林省肿瘤医院提供;Trizol和SuperⅡ 逆转录酶(美国Life technology公司),DNA聚合酶和dNTP琼脂糖(北京鼎国生物技术发展中心),DNA Marker(大连 Takara公司),兔抗人 HIF-1α、P-gp和 Bcl-2多克隆抗体及SABC免疫组织化学试剂盒(武汉博士德生物工程有限公司),兔抗人β-actin多克隆抗体(美国Santa Cruz公司),辣根过氧化物酶标记羊抗兔IgG(北京鼎国生物技术有限责任公司),SuperECL Plus超敏发光液(北京百傲生物科技发展研究所),其他试剂均为国产分析纯。
1.2 细胞分组与处理 使用本实验组前期实验中已成功建立的 HIF-1αsiRNA 真核表达载体pshRNA-HIF及其阴性对照pshRNA-Control稳定表达耐药株[6]。细胞分为敏感组(卵巢癌顺铂敏感株SKOV3)、耐药组(卵巢癌顺铂耐药株SKOV3/DDP)、转染组(稳定转染pshRNA-HIF的耐药株SKOV3/DDP)和对照组(稳定转染pshRNA-Control的耐药株SKOV3/DDP)。
1.3 RT-PCR法检测各组细胞 HIF-1α、MDR1和Bcl-2mRNA的表达 Trizol裂解细胞提取RNA。PCR 引 物 序 列: HIF-1α, sense, 5′-TCAAAGTCGGACAGCCTCA-3′,antisense,5′-CCCTGCAGTAGGTTTCTGCT-3′; MDR1,sense, 5′-CATTGGTGTGGTGAGTCAGG-3′,antisense,5′-CTCTCTCTCCAACCAGGGTG-3′;Bcl-2, sense, 5′-CGACGACTTCTCCCGCCGCTACCGC-3′, antisense, 5′-CCGCATGCTGGGGCCGTACAGTTCC-3′;β-actin,sense,5′-TGAGACCTTCAACACCCCAC-3′, antisense,5′-GCCATCTCTTGCTCGAAGTC-3′。 HIF-1α、MDR1、Bcl-2mRNA 和β-actin的 PCR 产物大小分别为460、174、318和316bp,凝胶图像分析系统测定条带密度,HIF-1α、MDR1和Bcl-2mRNA表达量以其与β-actin灰度值之比来表示。
1.4 Western blotting 法测定各组细胞 HIF-1α、P-gp和Bcl-2蛋白表达量 细胞经细胞裂解液处理后经 SDS-PAGE 电 泳、转 膜、一 抗 4℃ 过 夜(HIF-1α、P-gp、Bcl-2和β-actin抗体作用浓度为1∶500)、二抗室温2h、ECL发光底物显色、X线片曝光后图像分析软件扫描条带光密度(A)值,HIF-1α、P-gp和 Bcl-2蛋白表达量以其与β-actin光密度值之比来表示。
1.5 免疫组织化学法检测 HIF-1α、P-gp和 Bcl-2的蛋白表达量 细胞爬片经95%乙醇固定后,3%H2O2室温孵育5~10min,正常山羊血清封闭液室温孵育10min后分别滴加1∶50稀释的兔抗人HIF-1α、P-gp和Bcl-2多克隆抗体4℃过夜,充分清洗后依次滴加生物素化二抗、滴加辣根过氧化物酶标记链霉素抗生物素蛋白工作液室温孵育30min,充分清洗后DAB显色、苏木精复染、显微拍照。图像分析系统检测阳性表达A值,以A值表示 HIF-1α、P-gp和Bcl-2的蛋白表达量。
1.6 统计学分析 采用SPSS 11.5统计软件进行统计学分析。HIF-1α、P-gp和 Bcl-2mRNA 及蛋白表达量以±s表示,多组间样本均数比较采用方差分析,HIF-1α与 P-gp、Bcl-2的表达量的相关分析采用Pearson相关分析法。
2 结 果
2.1 各 组 肿 瘤 细 胞 HIF-1α、MDR1 和 Bcl-2 mRNA 表达量 敏感组(0.29±0.04、0.26±0.05和 0.29±0.05) 与 转 染 组 0.12±0.04、0.33±0.03 和 0.34±0.03)肿 瘤 细 胞 HIF-1α、MDR1和Bcl-2mRNA表达量明显低于耐药组(0.62±0.03、0.65±0.06和0.64±0.07)(P<0.05),耐药组与对照组(0.63±0.03、0.67±0.02和0.65±0.02)细胞中 HIF-1α、MDR1和Bcl-2mRNA表达量比较差异无统计学意义(P>0.05),HIF-1αmRNA 在转染组细胞中的表达量低于敏感组(P<0.05),MDR1和 Bcl-2mRNA在敏感组与转染组细胞中的表达量差异无统计学意义(P>0.05)。见图1。MDR1和Bcl-2mRNA在转染组细胞中表达的下调与HIF-1α基因沉默有关,HIF-1α与MDR1mRNA表达量呈正相关关系(r=0.908,P=0),HIF-1α与Bcl-2mRNA 表达量亦呈正相关关关系(r=0.916,P=0)。
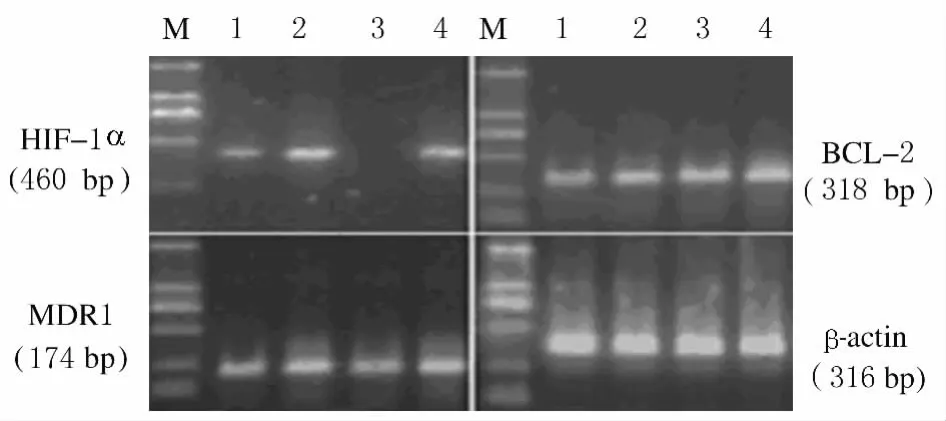
图1 各组肿瘤细胞中HIF-1α、MDR1和Bcl-2mRNA的表达量Fig.1 Expression levels of HIF-1α,MDR1,and Bcl-2 mRNA in tumor cells in various groups
2.2 各组肿瘤细胞 HIF-1α、P-gp和Bcl-2蛋白表达量 HIF-1α、P-gp 和 Bcl-2 蛋 白 在 敏 感 组(0.25±0.08、0.17±0.05和0.25±0.07)与转染组(0.14±0.05、0.29±0.08和0.36±0.09)细胞中表达量明显低于耐药组(0.59±0.13、0.60±0.05和0.59±0.09)(P<0.05),而 HIF-1α、P-gp和 Bcl-2 蛋 白 在 耐 药 组 与 对 照 组(0.61±0.10、0.59±0.14和0.59±0.12)细胞中表达量比较差异无统计学意义(P>0.05),HIF-1α蛋白在转染组的表达量低于敏感组(P<0.05),P-gp和Bcl-2蛋白在敏感组与转染组的表达量比较差异无统计学意义(P>0.05)。见图2。P-gp和Bcl-2蛋白在转染组表达的下调与HIF-1α基因沉默有关,HIF-1α与P-gp蛋白表达量呈正相关关系(r=0.773,P=0.003),HIF-1α与 Bcl-2 蛋白表达量亦呈正相关关系(r=0.862,P=0)。

图2 各组肿瘤细胞中 HIF-1α、P-gp和 Bcl-2蛋白的表达Fig.2 Expressions of HIF-1α,P-gp,and Bcl-2protein in tumor cells in various groups
2.3 各组肿瘤细胞 HIF-1α、P-gp和Bcl-2蛋白表达量 在细胞浆或胞核中出现棕黄色颗粒为阳性表达细胞。HIF-1α在细胞核、胞浆中均有表达,P-gp和Bcl-2主要在细胞浆中表达。见图3(插页一)。光密度分析,HIF-1α、P-gp和 Bcl-2蛋白在敏感组(18 756±6 032、14 652±4 315和20 630±5 324)与转染组(7 563±1 340、21 459±7 625和24 053±8 360)肿瘤细胞中的表达量明显低于耐药组(29 531±8 120、32 471±6 225和31 050±7 259)(P<0.05),HIF-1α、P-gp 和Bcl-2蛋白在耐药组与对照组(28 451±9 321、33 781±6 259和33 219±4 751)的表达量比较差异无统计学意义(P>0.05),HIF-1α蛋白在转染组肿瘤细胞中的表达量明显低于敏感组(P<0.05),P-gp和Bcl-2蛋白在敏感组与转染组肿瘤细胞中的表达量比较差异无统计学意义(P>0.05)。
3 讨 论
本研究结果显示:卵巢癌细胞中MDR1表达量的变化与HIF-1α基因的表达呈正相关关系,在高表达HIF-1α基因的细胞中MDR1表达量亦高,当HIF-1α基因沉默时,MDR1的表达量也随之下调。有研究[10-11]表明:在肝癌细胞株 HepG2和肺癌细胞株中,MDR1等耐药基因的表达量变化与HIF-1α呈同步改变。MDR1基因是HIF-1的靶基因,在其启动子249245上存在HIF-1结合位点,HIF-1可诱导肿瘤表达 MDR1,从而产生耐药[12]。HIF-1介导的肿瘤耐药与其启动其下游靶基因MDR1的表达有密切关联,因此沉默肿瘤细胞中HIF-1α的表达可下调MDR1的表达量,增加肿瘤对化疗药物的敏感性,进而逆转肿瘤的耐药。本研究结果表明:沉默卵巢癌细胞中HIF-1α基因除下调MDR1基因的表达外,也下调卵巢癌细胞中Bcl-2基因的表达,Bcl-2表达的变化与 HIF-1α基因的表达亦呈正相关关系,在高表达HIF-1α基因的细胞系中Bcl-2表达量亦高,干扰HIF-1α基因的表达,Bcl-2的表达也随之下调。有研究[13]认为:HIF-1α可调节多种与肿瘤生存相关的基因,并通过影响凋亡抑制因子Bcl-2基因等来调控细胞的生存与死亡,抑制肿瘤细胞HIF-1α蛋白的表达后,肿瘤细胞的凋亡明显增加,同时凋亡抑制因子Bcl-2mRNA 表达量下降[14-17],卵 巢 癌 中 HIF-1α基因的高表达促进Bcl-2基因的表达,增加肿瘤细胞抗调亡,进而产生耐药,因此抑制HIF-1α基因的表达可下调Bcl-2基因的表达,增加肿瘤细胞对化疗药物的敏感性。
综上所述,沉默HIF-1α基因可同时下调肿瘤细胞中MDR1与Bcl-2的表达,既可以抑制肿瘤细胞将肿瘤细胞内的多种抗肿瘤药物排出细胞外,提高细胞内化疗药物的浓度,又可以抑制肿瘤细胞抗凋亡基因的表达,促进细胞凋亡,通过这两方面的作用增加卵巢癌耐药细胞对顺铂的敏感性,进而达到逆转卵巢癌耐药的目的。因此HIF-1α基因有可能成为卵巢癌耐药治疗的靶点。
[1]Lubin J, Markowska A, Knapp P. Factors affecting response of chemotherapy in women with ovarian cancer[J].Eur J Gynaecol Oncol,2012,33(6):644-647.
[2]Ji F,Wang Y,Qiu L,Li S,et al.Hypoxia inducible factor 1α-mediated LOX expression correlates with migration and invasion in epithelial ovarian cancer [J].Int J Oncol,2013,42(5):1578-1588.
[3]袁太泽,钱朝南,徐理华,等.小分子HIF-1干扰RNA逆转鼻咽癌细胞耐药的实验 [J].肿瘤防治研究,2012,39(8):927-930.
[4]刘胜岗,陈 琼,何白梅,等.RNA干扰沉默缺氧诱导因子-1α逆转肺癌细胞耐药性 [J].现代生物医学进展,2011,11(13):2486-2489.
[5]丁震宇.HIF-1α及MDR1miRNA重组慢病毒干扰体系逆转结肠癌细胞多药耐药的研究 [D].重庆:第三军医大学,2008.
[6]薛惠荣,王丽萍,耿嘉男,等.siRNA沉默HIF-1α基因对人卵巢癌细胞SKOV3/DDP耐药的影响 [J].中国实验诊断学,2013,17(9)[Epub ahead of print].
[7]Januchowski R,Wojtowicz K,Sujka-Kordowska P,et al.MDR gene expression analysis of six drug-resistant ovarian cancer cell lines [J].Biomed Res Int,2013,doi:10.1155/2013/241763.
[8]Williams J,Lucas PC,Griffith KA,et al.Expression of Bcl-xL in ovarian carcinoma is associated with chemoresistance and recurrent disease[J].Gynecol Oncol,2005,96(2):287-295.
[9]Pakunlu RI,Cook TJ, Minko T,et al.Simultaneous modulation of multidrug resistance and antiapoptotic cellular defense by MDR1and Bcl-2targeted antisense oligonucleotides enhances the anticancer efficacy of doxorubicin [J].Pharm Res,2003,20(3):351-359.
[10]Zhu H,Chen XP,Luo SF,et al.Involvement of hypoxiainducible factor-1-alpha in multidrug resistance induced by hypoxia in HepG2cells[J].J Exp Clin Cancer Res,2005,24(4):565-574.
[11]Xia S,Yu S,Yuan X.Effects of hypoxia on expression of P-gp and mutltidrug resistance protein in human lung adenocarcinoma A549cell line [J].J Huazhong Univ Sci Technol Med Sci,2005,25(3):279-281.
[12]Britz-Cunningham SH,Adelstein SJ. Molecular targeting with radionuclides:state of the science [J].J Nucl Med,2003,44(12):1945-1961.
[13]Carmeliet P,Dor Y,Herbert JM,et al.Role of HIF-1αin hypoxia-mediated apoptosis,cell proliferation and tumour angiogenesis [J].Nature,1998,394(6692):485-490.
[14]蒋红元,丰有吉.西罗莫司抑制缺氧诱导因子1α蛋白表达及其对SKOV3裸鼠移植瘤生长的作用 [J].中华妇产科杂志,2004,39(7):474-477.
[15]Sermeus A,Genin M,Maincent A,et al.Hypoxia-induced modulation of apoptosis and BCL-2family proteins in different cancer cell types[J].PLoS One,2012,7(11):e47519.
[16]刘 多,方艳秋,谭 岩.腹腔灌注艾迪注射液治疗癌性腹水临床观察 [J].长春中医药大学学报,2013,28(6):617.
[17]吴 春,徐 力.徐力教授治疗卵巢癌经验 [J].长春中医药大学学报,2013,29(3):420-421.

