自噬在不同分割方案放疗联合化疗中对肺癌细胞的杀伤作用及其机制
李菁菁,刘明博,侯雨菲,徐 珊,孔德娟,梁 冰,贺梦子,梁 楠,马淑梅,刘晓冬
(吉林大学公共卫生学院 卫生部放射生物学重点实验室,吉林 长春 130021)
自噬是通过降解细胞内细胞器和长寿命蛋白来实现氨基酸重复利用和能量循环的一种高度保守的细胞程序[1-2]。目前研究结果显示:自噬可产生两种截然相反的结局,诱导适应性反应从而促细胞生存或诱导细胞发生死亡,即自噬性细胞死亡。有文献[3]报道:黄连素联合单次照射可以通过促进A549细胞株自噬泡的产生,增强射线的杀伤效应,提示自噬可能在肺癌细胞的死亡过程中起关键作用。PI3KⅢ/Beclin1是自噬的主要信号调节通路,在自噬发生[4]和肿瘤抑制[5]过程中起重要作用。Beclin1和MAPLC3是编码自噬相关蛋白的重要基因。Beclin1是构成PI3KⅢ信号通路所必须的蛋白,敲除Beclin1会抑制自噬,从而使细胞在营养缺乏情况下更易死亡。有关不同分割方案及化疗药物协同增敏作用对肺癌细胞的杀伤以及对自噬的影响尚未见报道。本研究结合体内外实验,通过建立小鼠的肺癌异位移植肿瘤模型,探讨自噬在不同照射方案和联合化疗治疗肿瘤中发挥的作用及可能机制,为寻求新的肿瘤治疗方案提供理论依据。
1 材料与方法
1.1 动物和细胞 40只C57BL/6小鼠,雄性,6~7周龄,体质量18~22g,购自中科院北京实验动物中心,动物合格证号:10-1023。饲养于SPF级动物室内。肺癌细胞株A549和Lewis由本实验室保存。使用RPMI 1640培养基(含10%FBS、青霉素和链霉素各100U·mL-1),置于37℃、5%CO2培养箱中培养,0.25%胰酶消化传代。Lewis肺癌细胞长至80%后,消化离心,用于实验动物的肿瘤接种。
1.2 照射条件 国产XSZ-220/20固定式X射线
深
部治疗机,电压180kV,电流18mA,滤板0.25Cu;单次靶皮距60cm,吸收剂量率为0.41Gy·min-1。A549细胞体外照射吸收剂量分别为0、2、4和6Gy。
1.3 动物分组及处理 将C57BL/6小鼠随机分为对照组、常规分割照射组、超分割照射组和联合组,每组10只。取对数生长期Lewis肺癌细胞,调整浓度为1×106mL-1于小鼠右后肢皮下接种0.2mL,待肿瘤长至合适大小,给予以下处理。常规分割照射组(2Gy×5):给予小鼠照射2Gy/次,每天1次,共5d,总剂量为10Gy;超分割照射组(1Gy×2×5):给予小鼠照射1Gy/次,每天2次,间隔4h,共5d,总剂量为10Gy;联合组(2Gy×5+顺铂):给予小鼠照射2Gy/次,每天1次,共5d,总剂量为10Gy,仅第1次照射前给予小鼠腹腔注射顺铂(3mg·kg-1)。对照组小鼠不给予照射和顺铂处理。采用游标卡尺每天测量各组小鼠肿瘤的长径和短径,监测肿瘤体积变化。
1.4 MTT法检测细胞存活率 以4 000个/孔A549细胞接种于96孔板。顺铂药物浓度分别为0(对照组)、1.0、2.5、5.0、10.0、20.0 和40.0μmol·L-1,每个浓度设3个复孔,药物作用48h后检测各组细胞存活率。选择490nm波长,酶标仪测定各孔吸光度(A)值,细胞存活率=实验组A值/对照组A值×100%,设对照组细胞存活率为1。
1.5 Western blotting法检测自噬相关基因MAPLC3和Beclin1蛋白的表达 提取MAPLC3和Beclin1蛋白,收集A549细胞,加入适量裂解液,于4℃、离心半径为5.8cm,12 000r·min-1
离心15min。收集上清,定量,经100℃变性5min分装于-80℃冰箱保存。电泳条件:浓缩胶电压80V,分离胶电压120V;转膜条件(湿转):100V、90min;5%脱脂牛奶封闭1.5h,一抗作用4℃过夜,Tris-HCl缓冲盐溶液(TBS)清洗NC膜3次,每次10min;二抗室温作用1h,1×TBS清洗NC膜3次,每次10min;化学发光检测(ECL)发光压片显色。以GAPDH为内参照。蛋白检测结果采用Quantity One软件进行电泳条带灰度分析。
1.6 免疫组织化学法检测自噬相关基因的表达
取小鼠肿瘤,固定、切片、常规脱蜡水化后,过氧化酶阻断剂、兔抗鼠PI3KⅢ、Beclin1、LC3Ⅱ抗体和DAB显色均按照试剂盒说明书进行。400倍光镜下取切片中阳性细胞较多处的5个视野,计数阳性细胞数,计算各组均值。
1.7 统计学分析 采用SPSS 13.0软件进行统计分析。各组细胞存活率、荷瘤鼠肿瘤体积、肿瘤组织内MPLC3Ⅱ、PI3KⅢ和Beclin1蛋白表达水平以±s表示,多组间均数比较采用单因素方差分析。
2 结 果
2.1 各组细胞存活率 MTT方法检测A549细胞
对顺铂的药物敏感性,以5.0μmol·L-1顺铂为临界,随着顺铂药物浓度的增加,细胞存活率明显下降。见表1。
表1 各组A549细胞存活率Tab.1 Cell viability of A549cells in various groups[n=3,η/(±s)%]
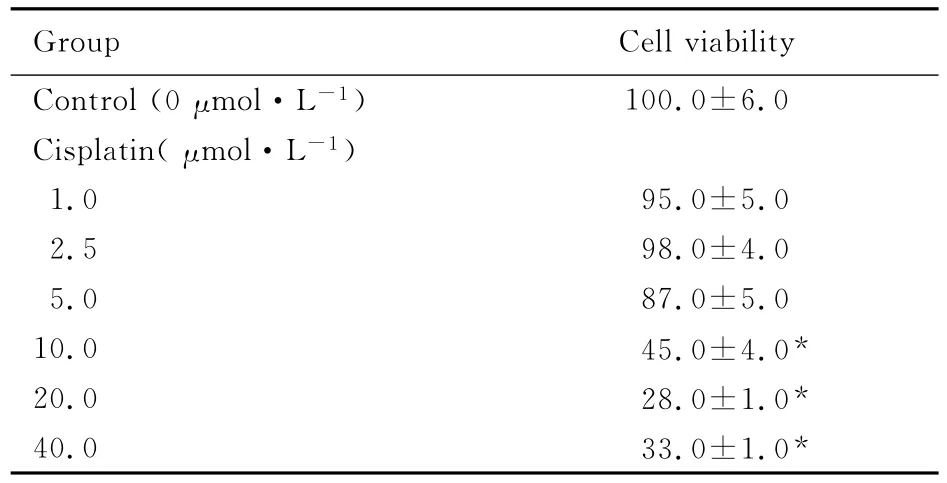
表1 各组A549细胞存活率Tab.1 Cell viability of A549cells in various groups[n=3,η/(±s)%]
* P<0.05 vs control group.
Group Cell viabilit y 100.0±6.0 Cisplatin(μmol·L-1)1.0 95.0±5.0 2.5 98.0±4.0 5.0 87.0±5.0 10.0 45.0±4.0*20.0 28.0±1.0*40.0 33.0±1.0 Control(0μmol·L-1)*
2.2 各组细胞MAPLC3和Beclin1蛋白的表达量Western blotting方法检测不同处理组细胞自噬相关基因MAPLC3和Beclin1蛋白的表达,与对照组比较,超分割照射组、常规分割照射组和联合组小鼠MAPLC3蛋白表达水平明显升高,分别增高1.34、2.76和1.59倍,而Beclin1表达分别增高2.26、1.50和1.60倍。见图1。
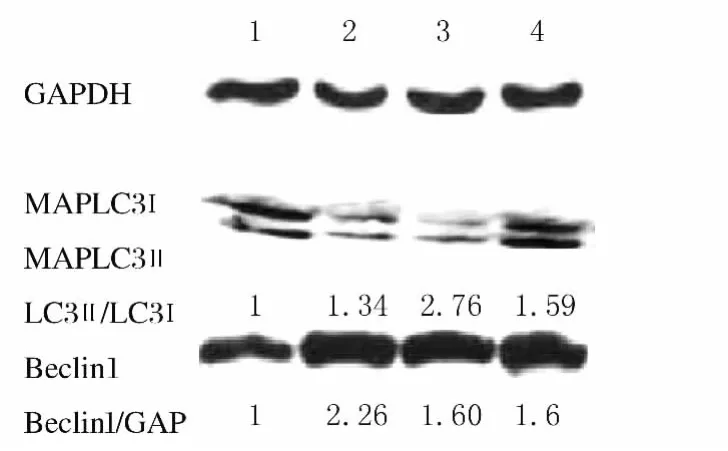
图1 各组细胞MAPLC3和Beclin1蛋白的表达电泳图Fig.1 Electrophogram of expressions of MAPLC3and Beclin1protein of cells in various groups
2.3 各组荷瘤鼠移植瘤体积 第6天杀鼠取出肿瘤,检测瘤体大小:超分割照射组小鼠肿瘤体积<联合组小鼠肿瘤体积<常规分割照射组小鼠肿瘤体积<对照组小鼠肿瘤体积。与对照组比较,其他各组小鼠肿瘤体积均明显减小(P<0.05)。见表2。
表2 各组小鼠肿瘤体积Tab.2 Tumor volumes of mice in various groups(n=10,±s,V/cm3)

表2 各组小鼠肿瘤体积Tab.2 Tumor volumes of mice in various groups(n=10,±s,V/cm3)
* P<0.05 vs control group.
Group Tumor volume Control 2.07±0.43 Hyperfractionated radiation 1.21±0.39*Conventional fractionated radiation 1.34±0.14*Combination 0.74±0.01*
2.4 各组小鼠肺癌移植瘤中MAPLC3Ⅱ、PI3KⅢ和Beclin1蛋白的表达 免疫组织化学染色,联合组小鼠MAPLC3Ⅱ表达水平较对照组明显增加(F=34.04,P<0.001),细胞内可见大量棕褐色颗粒沉积。其他组小鼠MAPLC3Ⅱ表达水平较对照组也有明显增加(P<0.05)。联合组小鼠PI3KⅢ和Beclin1的表达水平与对照组比较差异有统计学意义(F=19.79,P<0.001;F=3.509,P<0.05),而常规分割照射组与超分割照射组间比较差异无统计学意义。见图2(插页一)和表3。
表3 各组小鼠肺癌异位移植瘤组织中MAPLC3Ⅱ、PI3KⅢ和Beclin1蛋白的表达水平Tab.3 Expression levels of MAPLC3Ⅱ,PI3KⅢ,and Beclin1protein in lung exograft tissue of mice in various groups(n=10,±s)

表3 各组小鼠肺癌异位移植瘤组织中MAPLC3Ⅱ、PI3KⅢ和Beclin1蛋白的表达水平Tab.3 Expression levels of MAPLC3Ⅱ,PI3KⅢ,and Beclin1protein in lung exograft tissue of mice in various groups(n=10,±s)
* P<0.05 vs control group.
Group No.of positive cells MAP LC3Ⅱ PI3KⅢBeclin1 Control 84.01±5.57 27.33±2.02 19.67±1.14 Hyperfractionated radiation 271.11±12.77* 196.03±13.01* 33.67±1.81*Conventional fractionated radiation 275.33±14.29* 216.67±12.51* 43.33±2.57*Combination 350.02±18.00* 472.67±10.06* 68.67±5.89*
3 讨 论
目前,自噬已成为肿瘤研究中重要的领域之一。自噬的缺失可以影响细胞的增殖、衰老和癌变等多种病理生理过程。同时在许多抗肿瘤的治疗方法中可见诱导的自噬的发生[6-7]。辐射导致 DNA双链断裂诱导细胞凋亡被认为是杀伤肿瘤细胞的主要方式,但有研究[8]表明:在许多癌细胞中,辐射可以不依赖于凋亡而诱导自噬性细胞死亡的发生。
常规分割放射治疗方案是临床广泛应用的放射治疗模式,超分割放射治疗的原则是在最大化利用辐射杀伤肿瘤的效应的基础上保护病灶周围正常组织。本研究选用肺癌细胞株和小鼠移植瘤模型,分别进行总剂量为10Gy的常规分割和超分割照射方式,并采用较低剂量顺铂联合常规分割照射,旨在观察顺铂是否具有放疗协同增敏作用,即在较低剂量时顺铂是否产生较大的杀伤作用,最大程度保护机体避免放化疗的副作用。本研究结果证实:顺铂在离体和在体实验中均可以增敏常规放疗产生杀伤作用,抑制肿瘤生长。
越来越多的证据[9-10]表明:自噬在肿瘤治疗中发挥很大作用,通过调控自噬的水平可以改变细胞对放化疗的敏感性,如HMGB1通过诱导自噬促进白血病和骨肉瘤细胞的耐药性。因此本研究进一步检测了自噬在顺铂协同放疗敏感性中的作用。本研究同时发现:无论是离体实验还是在体实验中,PI3KⅢ/Beclin1这一信号通路和自噬标志性分子MAPLC3Ⅱ的表达在处理后出现不同程度增加,尤其联合组的蛋白表达水平明显高于其他各组。PI3KⅢ/Beclin1是调控自噬的主要通路之一,对Beclin1的深入研究使自噬对肿瘤具有重要作用的观点被首次承认[11-12]。在 H460肺癌细胞的研究中,沉默Beclin1基因诱导了细胞辐射抗性的产生[13]。免疫共沉淀研究显示:PI3KⅢ是Beclin1主要的结合蛋白,两者形成的复合物参与细胞代谢、生长、恶变和肿瘤的发生发展等多种生物学过程。Wang等[14]研究发现:Akt通过调控Beclin1的磷酸化来调控自噬和肿瘤形成。本研究结果表明:小剂量顺铂联合放疗可能通过促进自噬的发生来达到杀伤肿瘤细胞的作用。
在肺癌的治疗过程中,肿瘤细胞对辐射和药物的抵抗是影响治疗效果的主要因素[15-17]。本研究结果揭示了自噬在放疗和顺铂治疗非小细胞肺癌中的作用,提高自噬的发生可以作为增加细胞的辐射敏感性一个重要目标。
[1]Klionsky DJ. The molecular machinery of autophagy:unanswered questions[J].J Cell Sci,2005,118(Pt 1):7-18.
[2]Bursch W.The autophagosomal-lysosomal compartment in programmed cell death [J].Cell Death Differ,2001,8(6):569-581.
[3]Peng PL,Kuo WH,Tseng HC,et al.Synergistic tumorkilling effect of radiation and berberine combined treatment in lung cancer:the contribution of autophagic cell death[J].Int J Radiat Oncol Biol Phys,2008,70(2):529-542.
[4]Choi AM,Ryter SW,Levine B.Autophagy in human health and disease[J].N Engl J Med,2013,368(19):1845-1846.
[5]Li X,Yan J,Wang L,et al.Beclin1inhibition promotes autophagy and decreases gemcitabine-induced apoptosis in Miapaca2pancreatic cancer cells[J].Cancer Cell Int,2013,13(1):26.
[6]Sheng Y,Sun B,Guo WT,et al.3-Methyladenine induces cell death and its interaction with chemotherapeutic drugs is independent of autophagy [J].Biochem Biophys Res Commun,2013,432(1):5-9.
[7]Shabaik YH,Millard M,Neamati N.Mechanistic evaluation of a novel small molecule targeting mitochondria in pancreatic cancer cells[J].PLoS One,2013,8(1):e54346.
[8]Yi H,Liang B,Jia J,et al.Differential roles of miR-199a-5p in radiation-induced autophagy in breast cancer cells [J].FEBS Lett,2013,587(5):436-443.
[9]Liu L,Yang M,Kang R,et al.HMGB1-induced autophagy promotes chemotherapy resistance in leukemia cells [J].Leukemia,2011,25(1):23-31.
[10]Huang J,Ni JD,Liu K,et al.HMGB1promotes drug resistance in osteosarcoma [J].Cancer Res,2012,72(1):230-238.
[11]Frémont S,Gérard A, Galloux M,et al.Beclin-1is required for chromosome congression and proper outer kinetochore assembly[J].EMBO Rep,2013,14(4):364-372.
[12]Ricci A,Cherubini E,Scozzi D,et al.Decreased expression of autophagic beclin 1protein in idiopathic pulmonary fibrosis fibroblasts [J].J Cell Physiol,2013,228(7):1516-1524.
[13]Kim KW, Hwang M, Moretti L,et al. Autophagy upregulation by inhibitors of caspase-3and mTOR enhances radiotherapy in a mouse model of lung cancer [J].Autophagy,2008,4(5):659-668.
[14]Wang RC,Wei YJ,An ZY,et al.Akt-mediated regulation of autophagy and tumorigenesis through beclin 1 phosphorylation [J].Science,2012,338(6109):956-959.
[15]Willers H, Azzoli CG, Santivasi WL, et al. Basic mechanisms of therapeutic resistance to radiation and chemotherapy in lung cancer [J].Cancer J,2013,19(3):200-207.
[16]陈天君,高 飞,孙忠民,等.依托泊苷联合洛铂或顺铂治疗广泛期小细胞肺癌的对照研究 [J].西安交通大学学报:医学版,2013,34(2):198-201,209.
[17]杨晓利,王 峰,何 炜,等.贝伐单抗联合培美曲塞加顺铂一线治疗Ⅳ期非小细胞肺癌的临床观察 [J].西安交通大学学报:医学版,2013,34(4):554-556.

