维持性血液透析患者并发心脑血管疾病的危险因素分析

作者简介:缪娇,硕士研究生,医师,研究方向:血液净化。
【摘要】目的 探究维持性血液透析患者并发心脑血管疾病(CVD)的危险因素,为临床提供参考。方法 选取2022年7月至2023年6月南通市第四人民医院收治的250例维持性血液透析患者为研究对象进行回顾性分析,根据是否发生CVD将患者分为合并CVD组(150例)和未合并CVD组(100例)。比较两组患者实验室指标,并分析并发CVD的危险因素。结果 合并CVD组患者尿酸(UA)、胱抑素C(CysC)、磷(P)及超敏C反应蛋白(hs-CP)水平均高于未合并CVD组(均P<0.05);两组患者血全段甲状旁腺激素(iPTH)、白蛋白(ALB)、前白蛋白(PAB)、尿素氮(BUN)、肌酐(Cr)、空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脂蛋白(Lp)、同型半胱氨酸(Hcy)、钙(Ca)、镁(Mg)、血红蛋白(Hb)及白细胞介素-6(IL-6)水平比较,差异均无统计学意义(均P>0.05)。多因素Logistic回归分析結果显示,UA、CysC、P及hs-CRP水平升高是维持性血液透析患者并发CVD的独立危险因素(均P<0.05)。结论 维持性血液透析患者有一定概率并发CVD,受UA、CysC、P及hs-CRP水平升高的影响,临床应加以重视。
【关键词】维持性血液透析;心脑血管疾病;危险因素
【中图分类号】R446 【文献标识码】A 【文章编号】2096-2665.2024.01.0097.03
DOI:10.3969/j.issn.2096-2665.2024.01.032
对于终末期肾病患者而言,维持性血液透析是主要的治疗方式。随着透析技术的不断发展和进步,患者的生活质量得到明显的提升,但仍有部分血液透析患者因合并心脑血管疾病(cardiovascular and cerebrovascular diseases,CVD)而死亡[1]。相关报道显示,维持性血液透析患者合并CVD的发生率和死亡率均较高[2]。因此,明确影响维持性血液透析患者合并 CVD的因素并及早给予干预对提高患者生存率具有重要意义。基于此,本研究探究维持性血液透析患者并发CVD的危险因素,为临床预防和诊治提供重要的参考依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2022年7月至2023年6月南通市第四人民医院收治的250例维持性血液透析患者为研究对象进行回顾性分析,根据是否发生CVD将患者分为合并CVD组(150例)和未合并CVD组(100例)。合并CVD组患者中男性82例,女性68例;年龄45~68岁,平均年龄(53.52±2.52)岁;透析时间42~50个月,平均透析时间(46.52±2.41)个月;透析前收缩压(SBP)125~180 mmHg,平均透析前SBP(152.52±3.25)mmHg(1 mmHg=0.133 kPa);透析前舒张压(DBP)81~110 mmHg,平均透析前DBP(89.63±2.14)mmHg;透析后SBP 110~165 mmHg,平均透析后SBP(137.52±2.88)mmHg;透析后DBP 65~98 mmHg,平均透析后DBP(81.25±1.41)mmHg;原发病:糖尿病肾病18例,高血压肾病40例,慢性肾小球肾炎40例,多囊肾12例,狼疮性肾炎5例,梗阻性肾病5例,不明原因肾病30例。未合并CVD组患者中男性68例,女性32例;年龄44~69岁,平均年龄(53.21±2.01)岁;透析时间43~50个月,平均透析时间(47.25±1.85)个月;透析前SBP 125~179 mmHg,平均透析前SBP(152.52±3.22)mmHg;透析前DBP 80~110 mmHg,平均透析前DBP(90.25±2.74)mmHg;透析后SBP 110~164 mmHg,平均透析后SBP(137.82±2.85)mmHg;透析后DBP 65~97 mmHg,平均透析后DBP(81.52±1.77)mmHg;原发病:糖尿病肾病12例,高血压肾病35例,慢性肾小球肾炎29例,多囊肾2例,狼疮性肾炎6例,不明原因肾病16例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经南通市第四人民医院医学伦理委员会批准。纳入标准:①符合血液透析标准[3];②临床资料完整。排除标准:①合并恶性肿瘤疾病者;②存在自身免疫性疾病且处于活动期者;③伴有严重感染、严重肝病者;④血液透析前已经存在CVD者。
1.2 治疗方法 所有患者均选择自体动静脉内瘘或长期导管作为血管通路,采用血液透析机(金宝,型号:AK 96)进行血液透析。选择标准碳酸盐透析液,透析液的流量设置为 500 mL/min,血液流量控制在 200~300 mL/min。透析频率为3次/周,4 h/次。
1.3 观察指标 ①比较两组患者实验室指标水平。抽取患者透析前清晨空腹静脉血5 mL,以3 000 r/min离心处理10 min(离心半径为8 cm),分离血清待检。采用全自动生化分析仪(佳能医疗系统株式会社,型号:TBA-FX8)检测血全段甲状旁腺激素(iPTH)、白蛋白(ALB)、前白蛋白(PAB)、尿素氮(BUN)、肌酐(Cr)、尿酸(UA)、空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脂蛋白(Lp)、同型半胱氨酸(Hcy)、钙(Ca)、镁(Mg)、磷(P)及白细胞介素-6(IL-6);采用乳胶增强免疫比浊法测定胱抑素C(CysC);采用免疫透射比浊法测定超敏C反应蛋白(hs-CRP);以全血为样本采用全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司,型号:BC-5390)测定血红蛋白(Hb)。②分析维持性血液透析患者并发CVD的独立危险因素。
1.4 统计学分析 采用SPSS 25.0统计学软件进行数据分析。计量资料以(x)表示,组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 結果
2.1 两组患者各项实验室血检指标水平比较 合并CVD组患者UA、CysC、hs-CRP及P水平均高于未合并CVD组,差异均有统计学意义(均P<0.05);两组患者iPTH、ALB、PAB、BUN、Cr、FBG、TC、TG、HDL-C、LDL-C、Lp、Hcy、Ca、Mg、Hb及IL-6水平比较,差异均无统计学意义(均P>0.05),见表1。
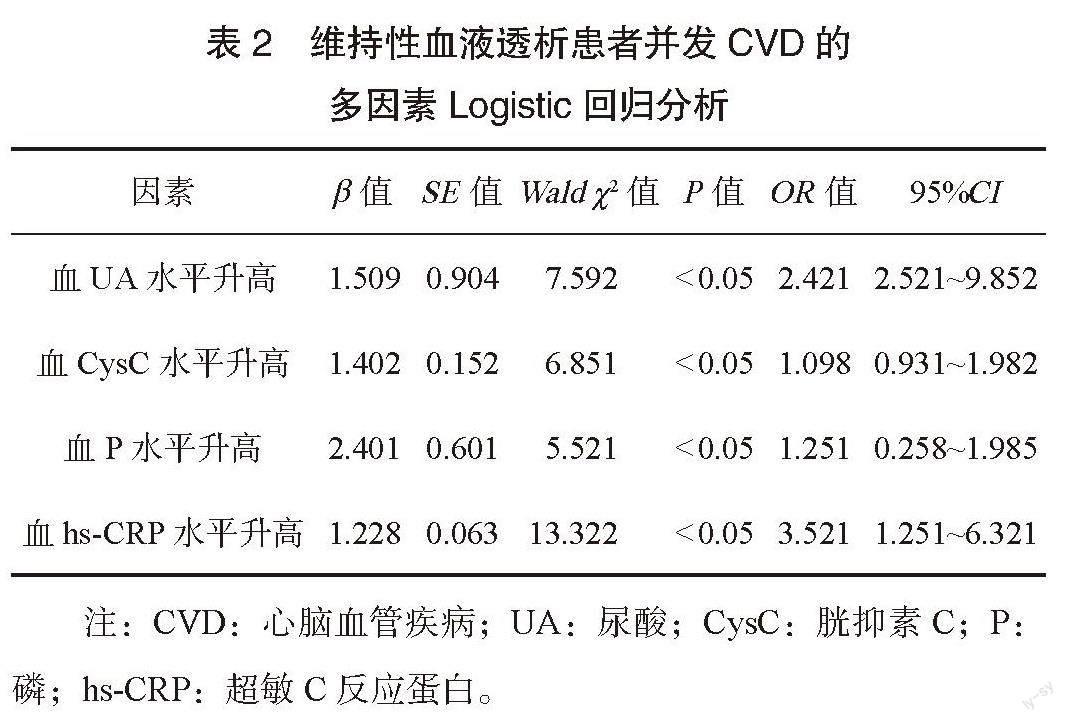
2.2 维持性血液透析患者并发CVD的多因素Logistic回归分析 以是否发生CVD作为因变量(发生=1,未发生=0),将可能影响维持性血液透析患者并发CVD的因素作为自变量(均以原值带入)纳入多因素Logistic回归模型进行分析,结果显示,UA、CysC、P及hs-CRP水平升高是维持性血液透析患者并发CVD的独立危险因素(均P<0.05),见表2。
。
3 讨论
随着我国人口老龄化和社会生活方式的改变,多种代谢性疾病的发生率随之升高,可引起或加重肾损害,使肾脏疾病的发生率也不断升高。如果治疗不及时,病情会不断进展,最终发展成终末期肾脏病[4]。目前,临床对于肾脏疾病一般选择血液透析治疗,但维持性血液透析常出现并发症,其中以CVD最为常见[5]。因此,识别CVD发生的危险因素并及早干预具有重要意义。
本研究结果显示,合并CVD组患者血UA水平高于未合并CVD组,且多因素Logistic分析结果显示,血UA水平升高是维持性血液透析患者并发CVD的独立危险因素,提示血UA水平与CVD的发生关系密切。血UA主要由机体肾脏排泄,是嘌呤代谢的终产物。终末期肾脏病患者往往存在肾小球滤过率下降的问题,导致血UA的排泄明显减少,高尿酸血症的发生风险较高[6]。CVD的发生机制与内皮功能异常相关,血UA可通过减少内皮型一氧化氮合酶(eNOS) 与钙调蛋白(CaM)结合等机制使eNOS的活性下降,继而使一氧化氮(NO)的生成减少,引发内皮功能损伤[7]。另外,血UA不仅具有促炎作用,还能刺激单核细胞趋化蛋白1(MCP-1)的合成,激活机体吞噬细胞,还具有氧化作用,其中高尿酸血症能够导致脂质过氧化、LDL-C氧化,促使氧自由基生成[8]。
本研究结果显示,合并CVD患者血CysC水平高于未合并CVD组,且多因素Logistic分析结果显示,CysC水平升高是维持性血液透析患者并发CVD的独立危险因素。血CysC能够充分反映机体肾小球滤过的功能,还参与了CVD的病理过程,而有研究认为,CysC预测透析患者发生CVD的敏感度高于血Cr,能够作为CVD的预测指标[9]。血CysC可抑制半胱氨酸蛋白酶的活性,不仅参与细胞外基质的重塑过程,还能对中性粒细胞趋化及吞噬功能造成影响[10]。本研究结果显示,合并CVD组患者血hs-CRP水平高于未合并CVD组,且多因素Logistic分析结果显示,血hs-CRP水平升高是影响维持性血液透析患者并发CVD的独立危险因素,提示体内微炎症状态与CVD发生的关系密切。hs-CRP作为反映人体炎症状态的重要指标之一,hs-CRP会激活补体系统,产生炎症介质,从而引起炎症反应,最终引发CVD[11]。hs-CRP可用于评估炎症活动度、预测疾病的风险和指导治疗方案的制订。本研究结果还显示,合并CVD组患者P水平高于未合并CVD组,且多因素Logistic分析结果显示,P水平升高是维持性血液透析患者并发CVD的独立危险因素。相关研究显示,与iPTH、Ca比较,P水平升高与CVD发生的相关性更高[12],因此,高磷血症患者合并CVD的风险更高,主要是由于P水平升高能够对半胱氨酸蛋白酶-3(Caspase-3)的表达进行调节,从而导致心肌细胞受损,增加瓣膜钙化的风险,可引发心动过速、心律失常或急性心肌梗死[13]。
综上所述,UA、CysC、P及hs-CRP水平升高是维持性血液透析患者并发CVD的独立危险因素,值得临床重视并进一步探究。
参考文献
华锦程,梁萌,沈淑琼,等.维持性血液透析患者短期死亡原因及相关因素匹配研究[J].中华危重病急救医学, 2015, 27(5): 354-358.
杨松涛,覃莲香,孙克冰,等.维持性血液透析患者营养不良、炎症、心血管疾病及MIA综合征的发生情况及其对预后的影响研究[J].中国全科医学, 2013, 16(14): 1617-1619, 1622.
中国医师协会肾脏病医师分会血液透析充分性协作组.中国血液透析充分性临床实践指南[J].中华医学杂志, 2015, 95(34): 2748-2753.
乔勤,顾波.我国与全球终末期肾脏病的流行现状[J].中国血液净化, 2014, 13(10): 729-732.
叶锡兰,邱碧辉,宁志芳,等.维持性血液透析患者不同血管通路临床常见并发症分析[J].护理管理杂志, 2012, 12(2): 129-130.
张春秀,李晶,蒋红樱,等.血尿酸对维持性血液透析合并矿物质代谢紊乱患者预后的影响[J].天津医药, 2022, 50(5): 517-522.
王柳雯,李萍华,汤日祥.维持性血液透析患者血尿酸水平与心血管疾病的相关性[J].海南医学, 2017, 28(9): 1413-1415.
张虹,童俊容,罗正茂,等.维持性血液透析患者血清尿酸水平与心血管死亡风险的分析[J].浙江临床医学, 2015, 17(1): 1-2.
张宏,李小伟,孙国明.血清胱抑素C、肌酐和脑钠钛预测慢性肾脏病维持性血液透析心血管事件的价值[J].医学临床研究, 2019, 36(7): 1273-1275.
李俊辰,马逊,朱亚梅,等.维持性血液透析患者透析期血压波动的危险因素及其对生存状况的影响[J].现代生物医学进展, 2023, 23(3): 471-474, 504.
祁艾红,曹文操.维持性血液透析患者同型半胱氨酸及超敏C反应蛋白分析[J].临床肾脏病杂志, 2011, 11(2): 58.
简汝堃,刘春花,张焯坚. 血液透析联合血液灌流在维持性血液透析患者钙磷代谢紊乱治疗中的疗效及血钙含量的影响[J]. 罕少疾病杂志, 2021, 28(3): 101-103.
尹飞挺,周婷婷,周岩,等.腹膜透析患者心血管钙化的发生率及影响因素[J].肾脏病与透析肾移植杂志, 2015, 24(5): 435-440, 454.

