氘可来昔替尼治疗中重度斑块状银屑病疗效及安全性Meta分析
胥 杨 詹纬生 赵菊花
1南充市中心医院·川北医学院第二临床医学院皮肤科,四川南充,637000;2川北医学院,四川南充,637000
银屑病是一种慢性、免疫介导的炎症性皮肤病,对患者的生活质量产生显著的负面影响,全球患病率约为2%~3%,银屑病患者超过1.25亿[1,2]。其中斑块状银屑病是最常见的类型,约占90%[3]。对于传统治疗疗效不佳或不耐受的中重度银屑病患者,生物制剂通常能明显改善病情,但仍存在有些患者没有反应或仅部分反应,或者随着治疗时间的推移而失去有效性,必须通过静脉或注射给药等诸多局限性[4,5]。氘可来昔替尼是全球首个口服选择性酪氨酸激酶 2(tyrosine kinase 2,TYK2)抑制剂,于2022年9月9日获 FDA批准用于治疗适合系统治疗或光疗的中重度斑块状银屑病成人患者,剂量为6 mg口服,每日1次[6]。2022年9月26日获日本批准用于治疗对常规疗法反应不足的斑块状银屑病、全身脓疱型银屑病和红皮病型银屑病患者[7]。多项临床试验报道氘可来昔替尼治疗斑块状银屑病疗效显著,但尚缺乏关于氘可来昔替尼治疗斑块状银屑病全面的系统评价,本研究采用Meta分析方法系统评价氘可来昔替尼治疗斑块状银屑病的疗效和安全性,以期为其临床应用提供参考。
1 资料与方法
1.1 文献检索 检索PubMed、Cochrane Library、Embase、中国知网、维普、万方数据库及临床试验网站clinicaltrials.gov。检索时间为建库至 2023年7月。中文检索词为:“银屑病”、“斑块状银屑病”、“deucravacitinib”、“氘可来昔替尼”;英文检索词为:“psoriasis”、“plaque psoriasis”、“deucravacitinib”、“BS-986165”。采用主题词结合自由词的检索策略,以PubMed为例,检索式如下:[(Psoriases) OR (Pustulosis of Palms and Soles) OR(Pustulosis Palmaris et Plantaris)] OR (Palmoplantaris Pustulosis) OR (Pustular Psoriasis of Palms and Soles) OR [Psoriasis (MeSH Terms)] AND [(Deucravacitinib) OR (BS-986165)]。
1.2 文献筛选标准 纳入标准:(1)研究对象:中重度斑块状银屑病患者病程≥6个月,银屑病皮损面积和严重程度指数(PASI)评分≥12,银屑病累及体表面积(BSA)≥10%,静态医师整体评估(sPGA)评分≥3,并且是系统治疗或光疗的候选对象,年龄≥18岁,不限种族和性别。(2)研究类型:均为随机对照试验(RCT)。(3)干预措施:试验组口服氘可来昔替尼6 mg,1天1次(qd)或3 mg,1天2次(bid);对照组口服安慰剂或其他阳性对照药物。(4)结局指标:①主要疗效指标:第12周或第16周时,PASI评分较基线下降≥75%的患者例数(PASI 75),sPGA评分为0或1(清除或几乎清除)的患者例数(sPGA 0/1)。②次要疗效指标:PASI评分较基线下降≥90%的患者例数(PASI 90),PASI评分较基线下降≥100%的患者例数(PASI 100),皮肤病生活质量指数评分为0或1的患者例数(DLQI 0/1)。③安全性指标:总的不良事件发生率,严重不良事件发生率,因不良事件中途退出率。
排除标准:(1)研究对象为非斑块状银屑病(脓疱型、关节病型、红皮病型),近期有感染病史,近期使用过生物制剂或其他系统药物治疗。(2)文献类型为非RCT试验、综述、病例报告、动物实验等。
1.3 文献数据提取 两名研究人员对根据纳入和排除标准筛选出合格的文献,并独立提取数据,提取内容包括:纳入研究、发表年份、试验周期、年龄、样本量、干预措施、银屑病累及体表面积(BSA%)、基线的银屑病皮损面积和严重程度指数(PASI)等。如遇分歧,则通过与第三方研究人员共同协商解决。
1.4 文献质量评价 采用Cochrane 5.0.1提供的偏倚风险评估工具对纳入研究的风险偏倚进行评价,主要包括:①随机序列生成;②分配隐藏;③是否使用盲法;④结局数据是否完整;⑤是否选择性报告研究结果;⑥其他偏倚来源。
1.5 统计学方法 采用RevMan 5.3软件进行统计学分析。对纳入数据进行异质性检验,当P>0.1,I2≤50%时,提示纳入文献无统计学异质性,采用固定效应模型分析;反之则采用随机效应模型分析。计数资料采用相对危险度(RR)及其 95%置信区间(95%CI)进行分析。
2 结果
2.1 文献检索结果 本研究共初检出文献256篇,26项临床研究,根据文献纳入及排除标准,最终筛选出3篇文献[8-10]和1项临床研究[11],共包括4项RCTs,共计1996例患者。详细筛选过程见图1。纳入研究的基本特征见表1。
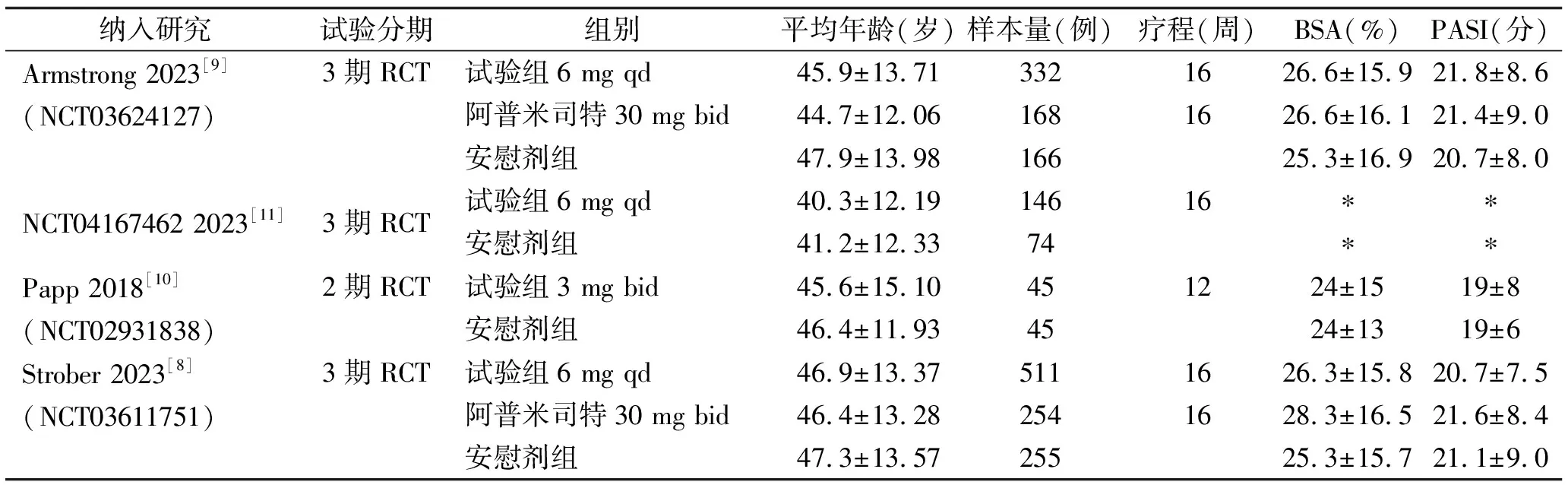
表1 纳入文献基本特征
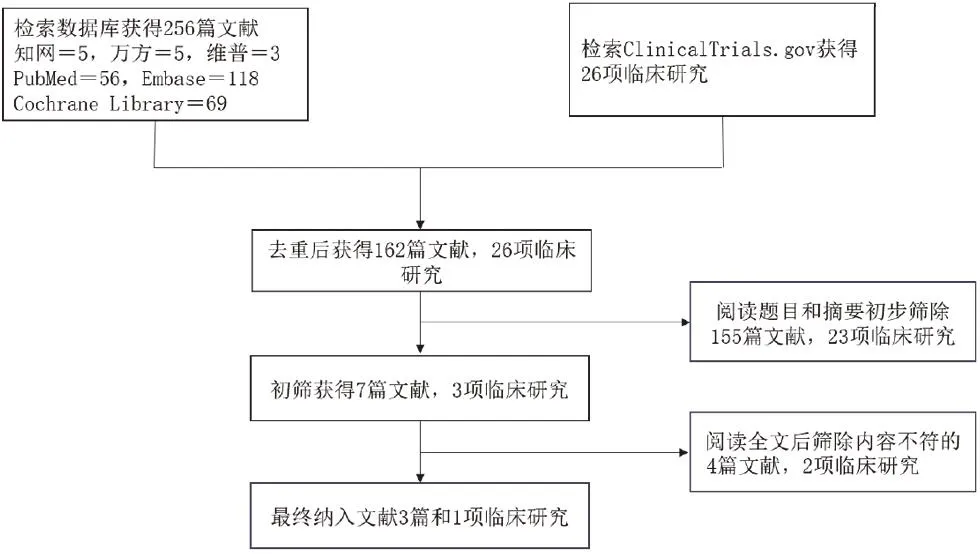
图1 文献筛选流程图
2.2 偏倚风险评估 纳入的4项RCT研究[8-11]总体质量较高,1项研究[11]结局数据不完整,4项研究[8-11]未说明随机序列产生方法,见图2。
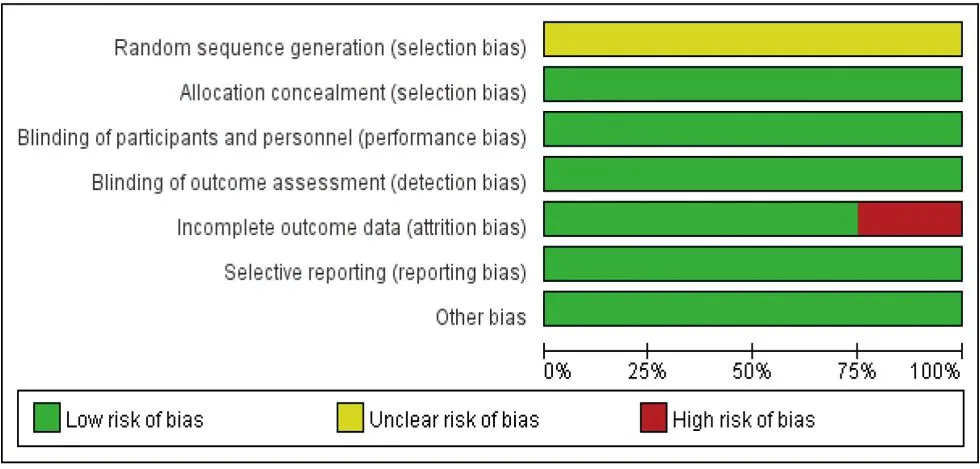
图2 偏倚风险评估图
2.3 Meta分析结果
2.3.1 疗效指标 4项研究[8-11]报道氘可来昔替尼试验组与安慰剂组比较治疗16周或12周后,主要疗效指标PASI 75、sPGA 0/1及次要疗效指标PASI 90、PASI 100、DLQI 0/1。Meta分析结果显示: 试验组达到PASI 75,sPGA 0/1的患者比例明显高于安慰剂组[RR=5.75,95%CI(4.44,7.44),P<0.00001],[RR=6.83,95%CI(5.08,9.18),P<0.00001],其余次要疗效指标的Meta分析结果见表2。
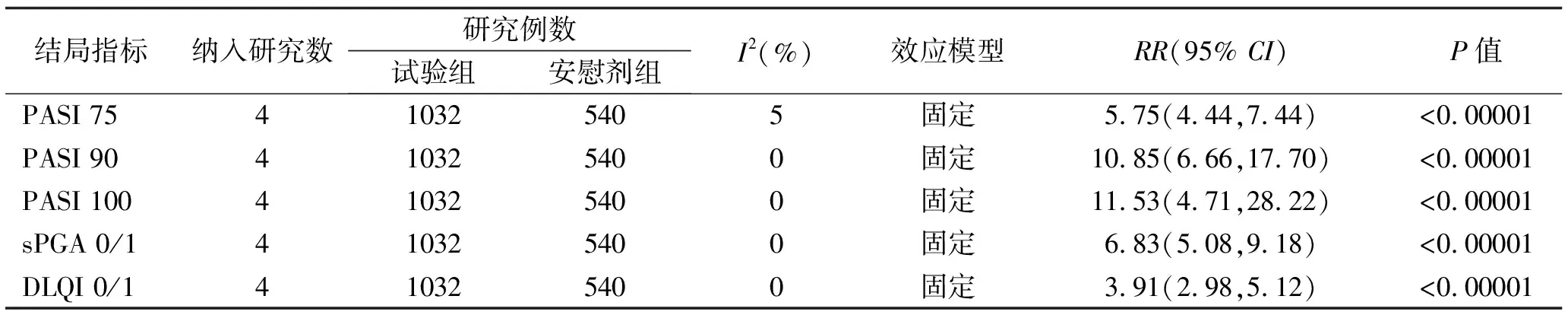
表2 氘可来昔替尼试验组与安慰剂组疗效指标的Meta分析结果
2项研究[8,9]报道氘可来昔替尼试验组与阿普米司特组比较治疗16周及24周后,主要疗效指标PASI 75、sPGA 0/1及次要疗效指标PASI 90、PASI 100、DLQI 0/1。Meta分析结果显示:治疗16周后,试验组达到PASI 75,sPGA 0/1的患者比例明显高于阿普米司特组[RR=1.47,95%CI(1.19,1.83),P<0.001],[RR=1.54,95%CI(1.33,1.79),P<0.00001],其余次要疗效指标的Meta分析结果见表3;治疗24周后,试验组达到PASI 75,sPGA 0/1的患者比例仍明显高于阿普米司特组[RR=1.66,95%CI(1.45,1.90),P<0.00001],[RR=1.77,95%CI(1.51,2.08),P<0.00001],其余次要疗效指标的Meta分析结果见表4。
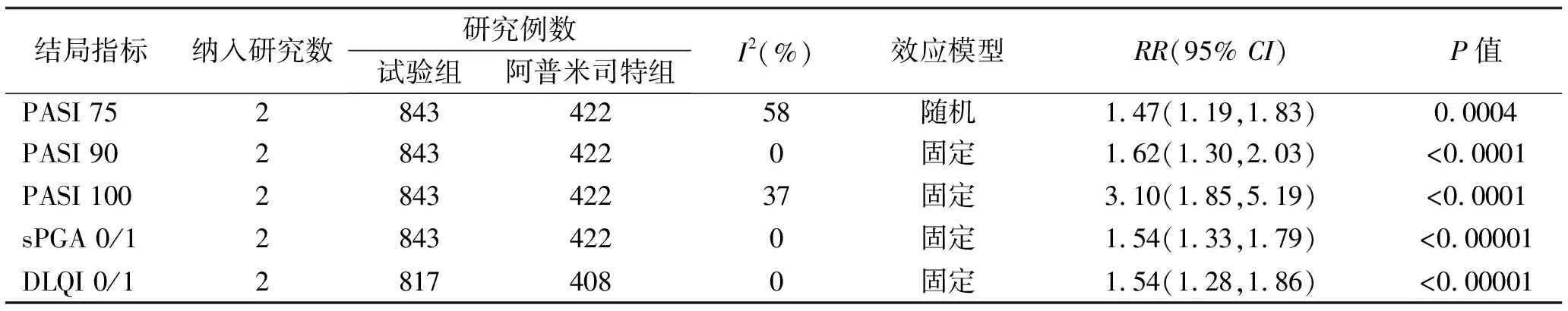
表3 氘可来昔替尼试验组与阿普米司特组第16周疗效指标的Meta分析结果
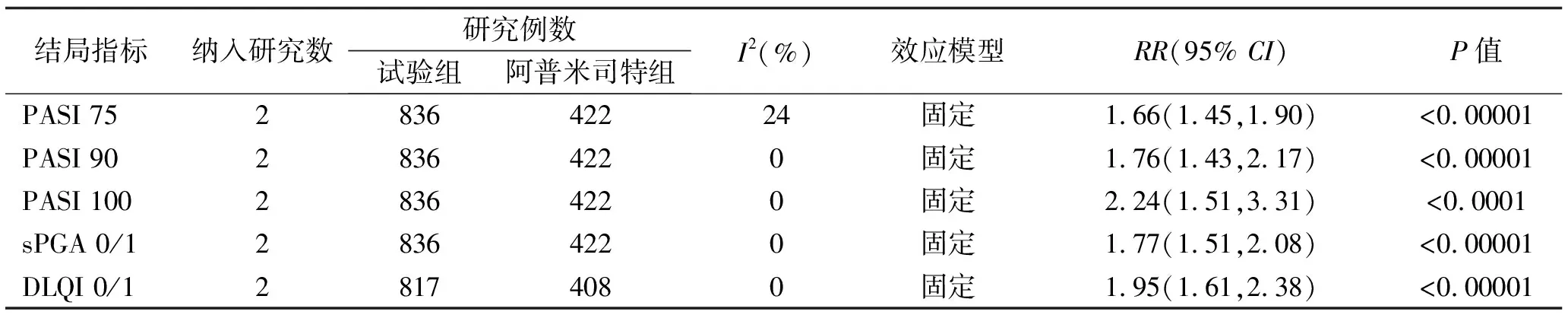
表4 氘可来昔替尼试验组与阿普米司特组第24周疗效指标的Meta分析结果
2.3.2 安全指标 3项研究[8-10]报道治疗12或16周内总的不良事件发生情况,Meta分析结果显示试验组总的不良事件发生率明显高于安慰剂组[RR=1.13,95%CI(1.02,1.26),P<0.05],试验组与安慰剂组对比常见不良事件如鼻咽炎、上呼吸道感染、头痛、腹泻及恶心发生率无统计学差异(P>0.05)。4项研究[8-11]报道治疗12或16周内严重不良事件发生情况,如胃肠炎、胃肠道出血、心肌梗死、室性心动过速、心力衰竭、败血症等。Strober等[8]报道试验组出现1例老年女性患者死亡,患者有肥胖、类风湿性关节炎、高血压、中风、心脏起搏器植入的病史,并在死亡前1天多次心脏骤停导致住院,这起死亡事件被认为与氘可来昔替尼无关。Meta分析结果显示试验组严重不良事件发生率与安慰剂组无统计学差异[RR=0.65,95%CI(0.34,1.24),P=0.19],见表5。
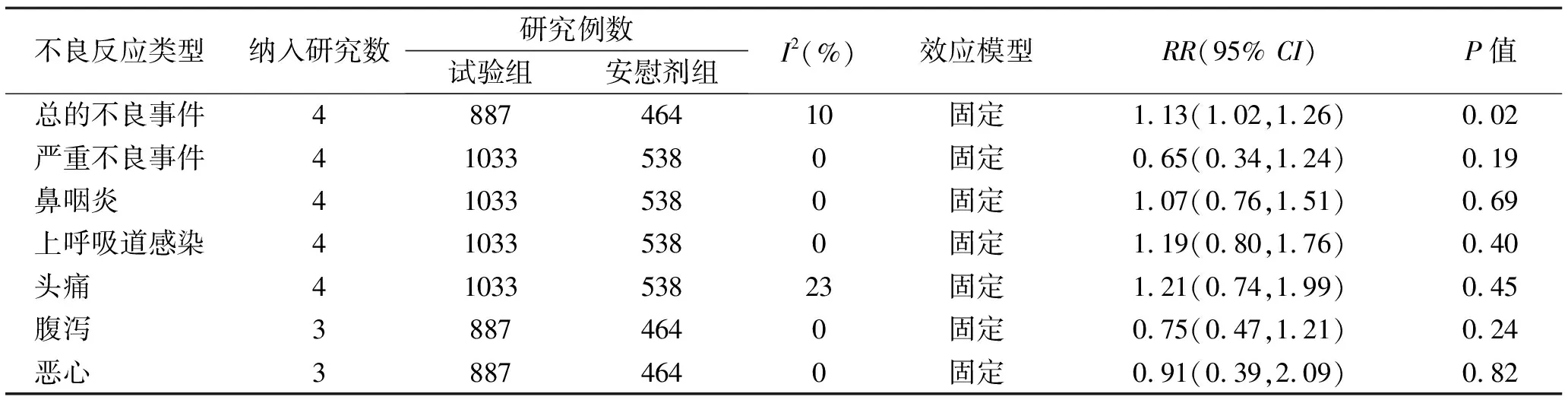
表5 氘可来昔替尼试验组与安慰剂组患者不良事件发生率的Meta分析结果
2项研究[8,9]报道治疗16周内氘可来昔替尼与阿普米司特不良事件发生情况,Meta分析结果显示氘可来昔替尼组总的不良事件,严重不良事件发生率与阿普米司特组无统计学差异[RR=0.97,95%CI(0.87,1.07),P=0.52],[RR=1.51,95%CI(0.55,4.12),P=0.42],见表6。

表6 氘可来昔替尼试验组与阿普米司特组患者不良事件发生率的Meta分析结果
2.3.3 不良事件与停药 4项研究[8-11]均报道因不良事件致患者停药的情况,Meta分析结果显示:试验组患者因不良事件停药发生率与安慰剂组比较无统计学差异[RR=0.72,95%CI(0.40,1.31),P=0.28],见图3。
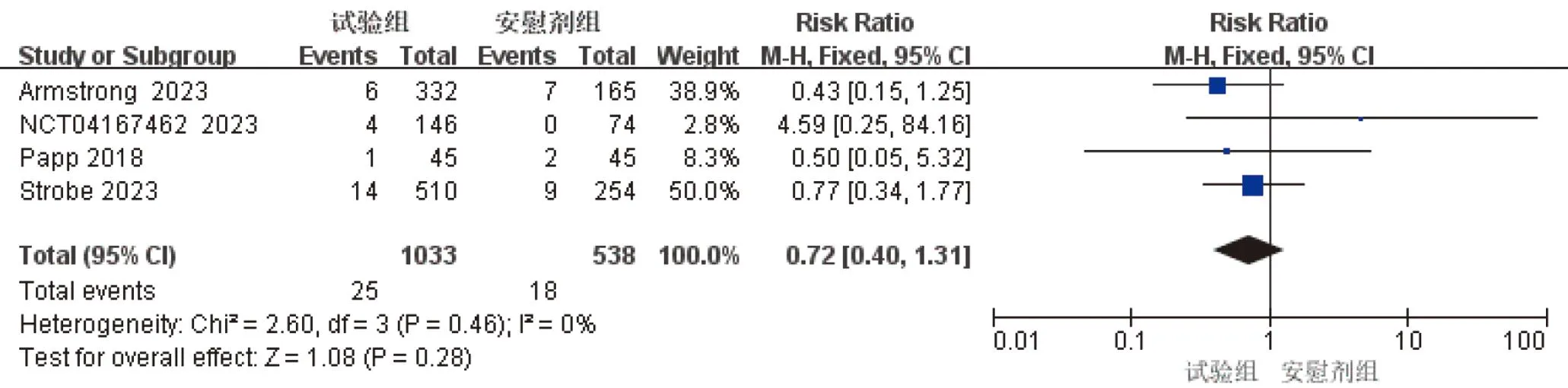
图3 因不良事件停药Meta分析结果森林图
2.4 发表偏倚 由于本次研究纳入的临床试验数量较少,仅有4项,尚不满足用漏斗图进行发表偏倚分析。
3 讨论
银屑病的发病机制极其复杂,至今尚未完全明确,主要与遗传、环境和免疫应答异常等因素的相互作用有关[12]。其中IL-23/IL-17轴在银屑病的发病机制中起主导作用,IL-23促进辅助性T细胞(Th17)的分化和增殖,Th17细胞在激活时会产生多种细胞因子,包括IL-17A、IL-17F、IL-22和TNF-α[13-15]。以IL-17A为主的细胞因子促进角质形成细胞过度增殖,并释放促炎细胞因子、趋化因子和抗菌肽,通过正反馈作用进一步增强银屑病炎症反应[13,16]。JAK-STAT信号通路通过传导IL-12、IL-21、IL-23、干扰素(IFN-γ)等多种细胞因子,参与银屑病的发生发展过程[17,18]。Janus激酶(JAK)是细胞质蛋白酪氨酸激酶(PTK)家族,由四种蛋白质组成:JAK1、JAK2、JAK3和酪氨酸激酶2(TYK2),细胞因子与其受体结合后受体构象发生改变,促使细胞内JAK自身磷酸化,从而催化受体酪氨酸残基及STAT磷酸化,磷酸化的STAT二聚体进入到细胞核,调控靶基因的表达[19]。
氘可来昔替尼是一种新型的口服小分子抑制剂,通过与JH2假激酶结构域的变构结合并将其调控结构域与催化结构域锁定在抑制状态,使TYK2失活。相较于与三磷酸腺苷结合位点结合的其他JAK抑制剂,氘可来昔替尼对TYK2的选择性远高于其他JAK抑制剂[20,21]。TYK2的抑制下调了IL-23/TH17通路、IL-12信号通路、I型干扰素(IFNα、IFNβ)通路和角质形成细胞的激活。氘可来昔替尼对TYK2的选择性远高于JAK1、JAK2、JAK3,因此安全性更高[5,22]。
本研究显示治疗16周后氘可来昔替尼试验组PASI 75、PASI 90、PASI 100、sPGA 0/1及DLQI 0/1等疗效指标均显著高于安慰剂组(P<0.05)。治疗16周及24周后氘可来昔替尼试验组PASI 75、PASI 90、PASI 100、sPGA 0/1及DLQI 0/1等疗效指标均显著高于阿普米司特组(P<0.05),但仅纳入2项RCT研究进行Meta分析,仍需要更大规模的临床试验进一步比较氘可来昔替尼与阿普米司特的疗效差异。Strober[8]及Armstrong[9]等后续研究发现对接受氘可来昔替尼的银屑病患者的疗效可以持续到52周,且不良反应发生率在52周内未见增加。1项最新的研究[23]通过对氘可来昔替尼与阿达木单抗治疗斑块状银屑病长期扩展试验的间接比较两种药物的长期疗效,结果发现与阿达木单抗相比,接受氘可来昔替尼治疗的中重度斑块状银屑病患者在2年内有更高的长期应答率,且氘可来昔替尼组的应答率保持稳定,而阿达木单抗组的应答率在第2年下降。
安全性分析显示氘可来昔替尼试验组治疗12或16周内总的不良事件发生率高于安慰剂组(P<0.05),但其发生率较低,且多为轻度至中度,常见不良事件如鼻咽炎、上呼吸道感染、头痛、腹泻及恶心发生率无统计学差异(P>0.05)。试验组与安慰剂组比较严重不良事件发生率无统计学差异(P>0.05),试验组与阿普米司特组比较,总的不良事件及严重不良事件均无统计学差异(P>0.05),提示氘可来昔替尼治疗斑块状银屑病具有良好的安全性。此外,试验组与安慰剂组中患者因发生不良事件而退出治疗的发生率无统计学差异(P>0.05),提示患者对于氘可来昔替尼的耐受性良好。
本研究所纳入的4项临床研究质量总体较高,均为多中心的2或3期随机对照临床试验,但仍存在以下局限性:(1)随访周期较短,心血管事件,恶性肿瘤等远期严重不良事件发生风险尚不明确;(2)目前纳入与阳性药物对照的研究较少,仅有2项与阿普米司特的对照研究。
综上所述,氘可来昔替尼治疗斑块状银屑病的疗效优于安慰剂和阿普米司特,且安全性良好,不良反应可耐受。当患者对于传统药物疗效不佳时,氘可来昔替尼可能会成为治疗中重度斑块状银屑病的新选择。但还需要更长时间、更大规模的临床试验进一步评估氘可来昔替尼的长期疗效及安全性。

