二例节段型神经纤维瘤病NF1基因突变位点确定及产前诊断
白倩倩 林志淼
1北京大学第一医院皮肤科,北京市皮肤病分子诊断重点实验室,国家皮肤与免疫疾病临床医学研究中心,北京,100034;2南方医科大学皮肤病医院,广东广州,510091
神经纤维瘤病是一类累及多系统的肿瘤易感性单基因遗传病,主要分为1型神经纤维瘤病(neurofibromatosis type 1,NF1;以下斜体NF1代表基因,NF1代表1型神经纤维瘤病)和2型神经纤维瘤病。其中NF1是一种相对常见的遗传病,其患病率高达三千到四千分之一[1]。NF1的诊断标准最初在1987年提出[2],强调临床表现但未将基因检测纳入诊断标准。2021年,NF1诊断标准修订版发布,增加了遗传学检测结果作为主要诊断标准之一[3]。节段型NF1(segmental NF1,sNF1)是NF1在胚胎时期基因发生镶嵌突变所致,是一种相对轻型的NF1,临床表现为受累部位身体或者组织出现NF1疾病改变。sNF1缺乏统一的诊断标准,因表现较轻,往往不符合上述NF1诊断标准,确诊较为困难,因此诊断sNF1非常依赖于基因检测结果。同时,sNF1有一定遗传性,且遗传子代会出现NF1而非sNF1,因此需要进行产前诊断来避免疾病遗传。而产前诊断同样依赖于sNF1患者前期的基因检测结果。我们报道两例sNF1基因检测过程和产前诊断结果,为临床医生诊断sNF1并进行遗传咨询提供参考。
1 资料与方法
1.1 临床资料 患者1,女,32岁,出生后左侧躯干及左上臂出现2处牛奶咖啡斑,之后咖啡斑及雀斑逐渐增多但主要局限于左躯干及左上肢(图1a)。患者自13岁左右开始于左侧背部出现粉红色质软瘤体。因近期计划备孕就诊于我院。

患者1背部出现多发色斑,主要局限于左侧(1a),方框内标记的神经纤维瘤用于后续突变筛查;患者2分别在左胸部(1b)和颈部(1c)出现两个孤立的神经纤维瘤;患者2仅在右侧腋窝出现多个牛奶咖啡斑(1d),左侧未发现(1e)
患者2,女,28岁,患者出生后全身出现多处牛奶咖啡斑,随年龄增长增多,5岁左右开始出现腋窝雀斑,但仅累及右侧腋窝。15岁开始躯干、四肢逐渐出现散在肤色至粉红色皮肤肿物(图1b~1e),质软。患者因生育要求,就诊于我院并进行遗传咨询。
患者1和2均否认疾病家族史或其他疾病史。患者1曾于外院抽血进行基因检测,未发现NF1或者其他咖啡斑相关基因致病性突变。
1.2 方法
1.2.1 外周静脉血DNA提取 征得患者同意后,分别采集两例患者外周静脉血4 mL(2%乙二胺四乙酸抗凝),采用常规方法提取基因组DNA。
1.2.2 皮肤组织DNA提取 分别取两例患者皮肤瘤体,每人取两处皮肤神经纤维瘤瘤体,置于0.25% Dispase 2中4℃消化过夜,分离其表真皮,分别提取表皮及真皮组织DNA,检测提取DNA纯度和浓度。
1.2.3 高通量基因测序 分别取两例患者一处皮损的真皮侧基因组DNA 3 μg为模板,采用覆盖NF1、NF2、SPRED1基因全长的芯片进行二代测序,平均测序深度超过2000X。检测在北京迈基诺基因测序公司完成,使用IlluminaHiseq2000高通量测序平台进行突变检测。针对测序结果数据,我们仅挑选NF1基因中非同义突变或者剪切位点突变,同时突变基因型测序深度大于10,突变比例超过1%的变异位点。
1.2.4 一代测序验证 根据高通量测序所检测到的可疑致病性变异位点,涉及针对变异位点的NF1基因序列引物(用Primer-BLAST在线设计),扩增患者两处皮损表、真皮及外周血基因组DNA,进行Sanger测序。取5 μL PCR扩增产物,1.5%琼脂凝胶电泳检测扩增结果。PCR产物经纯化后于北京天一辉远生物科技有限公司测序。测序结果采用Bioedit软件分析,比对高通量测序所发现变异位点。
1.2.5 绒毛膜穿刺及检测 两例患者均于孕12周进行胎儿绒毛膜穿刺,取1~2根绒毛膜,常规方法提取胎儿绒毛膜基因组DNA,根据1.2.4确定的NF1基因胚胎期镶嵌突变位点进行PCR扩增及Sanger测序,确定是否遗传患者致病性变异位点。
2 结果
2.1 高通量基因测序结果 我们在两例患者的真皮组织高通量测序结果中各自发现两个NF1基因突变位点,即患者1的皮肤瘤体高通量测序发现NF1基因的c.1007G>A(p.Trp336*,转录本NM_000267,下同,突变比例为30%),以及c.7168_7169del(p.Arg2390Asnfs*10,突变比例为29%)突变;患者2的皮肤瘤体高通量测序发现NF1基因的c.1885G>A(p.Gly629Arg,突变比例为25%),以及c.7205delA(p.His2402Profs*9,突变比例为17%)突变。
2.2 一代测序检测测序结果 根据高通量测序结果,分别对患者1的两处皮损组织和血液系统DNA进行NF1基因的c.1007G>A和c.7168_7169del突变位点一代测序检测,结果发现NF1基因c.1007G>A在皮损的真皮DNA中均能检测到突变峰(图2a),而血液和表皮未检测出该突变峰(图2b),提示NF1基因c.1007G>A为患者1胚胎时期发生的镶嵌突变,也是导致患者1的sNF1的主要致病性突变;患者1的NF1基因c.7168_7169del仅在一处皮损真皮组织DNA中检测到突变峰,其他组织DNA均未查到突变峰,提示该变异位点为神经纤维瘤体随机发生的“二次打击”的体细胞突变,非胚胎时期镶嵌突变。同样方法我们对患者2的两处皮损组织和血液系统DNA进行NF1基因的c.1885G>A及c.7205delA一代测序检测,结果发现NF1基因c.1885G>A在患者2的两处瘤体及血液DNA均检测到突变峰(图2c、2d),提示该变异位点为患者2胚胎时期发生的镶嵌突变,是患者2的sNF1的致病性突变;而NF1基因c.7205delA仅存在于一处瘤体的真皮DNA中,因此为该瘤体随机发生的“二次打击”。至此,确定患者1的NF1基因c.1007G>A和患者2的NF1基因c.1885G>A为两例患者进行产前诊断需要检测的位点。

患者1的两个神经纤维瘤体中均检测到NF1镶嵌突变c.1007G>A(2a),而其血液样本中未检测到该突变(2b);患者2的两个独立神经纤维瘤组织DNA和血液DNA样本中均可检测到NF1镶嵌突变c.1885G>A(2c、2d)
2.3 绒毛膜基因测序结果 分别对患者1胎儿绒毛膜基因组DNA进行NF1基因c.1007G>A位点及患者2胎儿绒毛膜基因组DNA进行NF1基因c.1885G>A位点一代测序,结果发现胎儿绒毛膜均不存在相应致病性位点(图3)。根据检测结果,判断两个胎儿均未遗传到母亲NF1基因致病性突变位点。分娩后随访至1岁,未发现可疑牛奶咖啡斑或者其他神经纤维瘤病临床表现;同时对两位婴儿采集外周血进行母亲相应NF1基因突变位点进行检测,发现两位婴儿均不存在母亲的NF1基因突变。
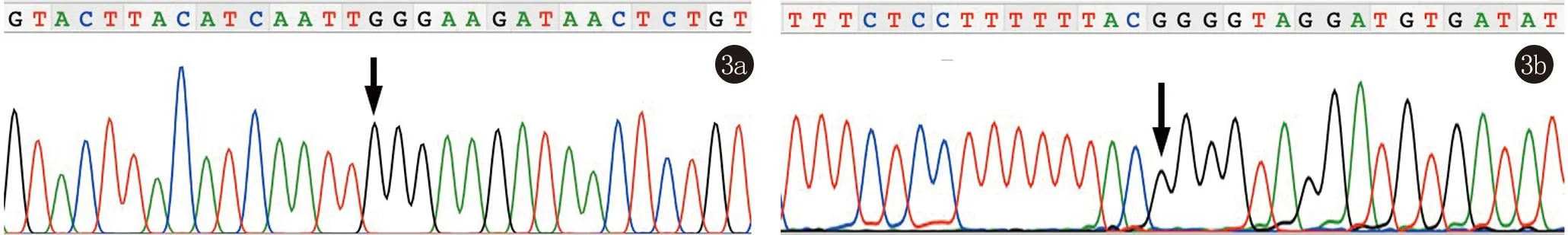
患者1胎儿(3a)和患者2胎儿(3b)绒毛膜组织DNA中均不携带母体镶嵌突变
3 讨论
NF1最早被分为七种类型,而sNF1属于七种的第5型,且被定义为“咖啡斑和/或多发雀斑,以及神经纤维瘤体聚集分布于身体一侧,并且不跨越身体中线分布”[4]。既往认为,sNF1的患病率较低,可能只有NF1发生率的十到二十分之一,是一种罕见的NF1亚型[5,6]。然而,这些传统的认识可能存在一定偏颇。根据笔者的门诊经验(笔者长期在遗传性皮肤病门诊),sNF1的发生率可能远高于NF1;不少研究者也认为sNF1的患病率很可能被明显低估[7]。同时,sNF1定义为不跨越中线分布并不准确,正如本文中的患者2,咖啡斑、雀斑以及皮肤瘤体分布于身体两侧,属于跨身体中线分布的大面积sNF1。因此,实际上,sNF1更应该从病因学上进行诊断,将其命名为“镶嵌型1型神经纤维瘤病”可能更为妥当[8],这样可以避免广泛皮损分布的sNF1出现诊断困境。
sNF1的临床表现差异较大,有学者根据临床表现将其分为四种亚型,即:1型,仅有色素改变;2型,色素改变伴神经纤维瘤;3型,仅有神经纤维瘤;4型,仅有丛状神经纤维瘤[5]。尽管该分类方式不能涵盖所有sNF1的类型,但是该分类提示sNF1临床表现差异较大,现有的NF1的诊断标准可能无法用于sNF1的诊断。有学者总结了17例镶嵌型NF1患者的临床表现,发现这些患者普遍被确诊的年龄较晚(平均37岁),并且有不少患者出现NF1的严重临床表现,比如丛状神经纤维瘤、脊柱侧弯、高血压、自闭症等[9]。sNF1的平均诊断年龄较晚,推测可能是由于sNF1的疾病表现通常较轻,晚发,或者不典型,致使许多sNF1患者表现达不到神经纤维瘤病的诊断标准。因此,sNF1的早期诊断十分依赖于基因检测。由于sNF1的发病原因是胚胎时期NF1基因合子后突变(postzygotic mutation)导致的,不同于胚系突变(germline mutation),因此抽血有可能无法查到NF1基因突变。因此,若要进行sNF1基因诊断,首先需要确定患者基因组DNA的标本来源。从皮肤科角度出发,最适合的取样标本应该是神经纤维瘤病两种常见临床表现,即牛奶咖啡斑和皮肤神经纤维瘤体。值得注意的是,根据肿瘤发生的“二次打击”理论[10],皮肤神经纤维瘤作为良性肿瘤,是存在NF1基因的二次打击突变的,即每个皮肤神经纤维瘤体存在一个胚胎时期的合子后的NF1基因突变,以及一个随机发生的“二次打击”的NF1基因突变[11]。有意思的是,有研究证明,神经纤维瘤病的牛奶咖啡斑的黑素细胞同样存在NF1基因的二次打击突变[12]。然而,如果sNF1患者已经出现瘤体,选择皮肤神经纤维瘤体可能比选择咖啡斑更佳,因为皮肤神经纤维瘤体病变组织富集,NF1基因突变检出率很可能远高于只有黑素细胞受累的牛奶咖啡斑。
由于sNF1患者的NF1突变有可能会累及性腺[13]。一旦性腺被NF1基因突变累及,就有可能遗传给子代。这种情况下,sNF1患者的子代将出现NF1基因的胚系突变,导致比亲本更严重的全身型NF1。因此,sNF1患者在孕期需要进行产前诊断避免疾病遗传。由于技术上而言,女性患者无法取生殖细胞进行NF1基因镶嵌突变评估遗传风险,因此建议sNF1女性患者常规对每个子代进行产前诊断。产前诊断需要先确定sNF1患者的胚胎时期NF1基因合子后突变(镶嵌突变)方能进行精确产前诊断。由于二次打击原因,取sNF1患者单一神经纤维瘤体可能检测出两个NF1基因突变位点,因此应该取两处不同瘤体进行检测,确保检测到的NF1基因镶嵌突变是同时存在于两处瘤体的,方能采用该NF1基因突变位点进行产前诊断。本文中所报道的两位sNF1女性患者均采用该方法进行变异检测,确定了患者胚胎时期唯一的NF1基因镶嵌突变后,采用该位点成功进行产前诊断,确保了患者子代未遗传该变异位点。

