多重PCR高分辨熔解分析同时检测骨髓增殖性肿瘤JAK2,MPL及CALR基因突变的初步研究
杨晓慧,许 蕾,晏耀明,李建新
(1.北京大学深圳医院 a.检验科;b.血液科,广东深圳 518036;2.深圳大学总医院检验科,广东深圳 518055)
骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)是一组起源于造血干细胞、骨髓一系或多系克隆性过度增殖为特征的慢性血液肿瘤。费城染色体阴性的经典MPN 的分子基础已基本阐明[1]:由于MPN 限制性驱动基因[包括 Janus 激酶2(janus kinase 2,JAK2)、钙网素(calreticulin,CALR)和骨髓增殖性白血病(myeloproliferative leukemia,MPL)] 病毒突变,导致不正常地激活JAK2/STAT通路和下游通路,引起血细胞过度增殖[1]。根据2016 年WHO 关于髓系肿瘤和急性白血病分类标准,JAK2,CALR 和MPL 突变是经典MPN 的主要诊断标准之一[2]。JAK2,CALR 和MPL 基因突变的检测方法很多,大多基于聚合酶链式反应(polymerase chain reaction,PCR),大多数方法只能检测单一基因突变。PCR-高分辨熔解分析(high resolution melting assay,HRM)是一种在PCR 体系基础上加入双链DNA 结合染料,PCR 结束后直接运行HRM,根据扩增子的解链温度不同,应用检测仪器极高的温度分辨率来区分单个碱基差异的PCR 扩增后检测技术。本研究旨在建立一管法多重PCR-HRM 同时检测JAK2,MPL 和CALR 常见八种突变,为经典MPN 基因诊断提供一种简单、快速、闭管、低成本的检测手段。
1 材料与方法
1.1 研究对象 根据文献[1],JAK2,CALR 和MPL常见突变包括:JAK2 外显子14 V617F,JAK2 外显子12 K539L,N542-E543 del 和E543-D544 del;MPL外显子10 W515K 和W515L;CALR 外显子9 I 型(c1092-1143 del) 和Ⅱ型 (c1154-1155 ins)。以上八种常见突变型等位基因模板,除JAK2 V617F 突变模板从临床MPN 确诊患者标本提取外,其它七种突变由Invitrogen 公司生物合成,-80℃低温冻存于质粒及含相应质粒的甘油菌中。野生型等位基因模板从健康人EDTA 抗凝血提取。
1.2 仪器与试剂 采用Lab-Aid 820 核酸提取仪,以Lab-Aid 核酸(DNA)分离试剂盒(厦门致善生物科技股份有限公司)提取全血DNA;采用2× HRM PCR Master Mix (Type-it HRM PCR Kit,Qiagen)扩增试剂;采用HR-1 高分辨率熔解曲线分析系统(Idaho Technology,USA)进行HRM 分析。
1.3 方法
1.3.1 PCR 及多重PCR:针对JAK2 外显子14 V617F,JAK2 外显子12 三种突变,MPL 外显子10 两种突变及CALR 外显子9 两种突变分别采用Primer 3 软件(http://bioinfo.ut.ee/primer3-0.4.0/)共设计4 对引物,由Invitrogen 公司合成,见表1,并通过uMelt(https://dna.utah.edu/)软件对扩增产物的解链温度进行预测。PCR 反应采用C1000 Touch thermal cycler (Bio-Rad,USA)。

表1 PCR 引物序列
单独扩增各基因的PCR 体系包括:含Eva Green 饱和染料的2×HRM PCR Master Mix (Typeit HRM PCR Kit,Qiagen) 12.5μl,上下游引物终浓度各为0.4μmol/L,DNA 模板浓度为1ng/μl,加双蒸水至25μl。扩增JAK2 V617F,MPL 及CALR基因的反应条件为:95℃预变性5min;95℃变性10s,58℃退火30s,72℃延伸10s,共40 个循环;72℃延伸5min。扩增JAK2 外显子12 的最适退火温度为50℃,其余反应条件同上。扩增产物经2.2g/dl琼脂糖凝胶电泳,采用Gel Doc XR 凝胶成像仪(Bio-Rad,USA)及Image Lab 3.0 成像软件进行成像分析。
多重PCR 反应体系包括:含Eva Green 饱和染料的2×HRM PCR Master Mix 12.5μl,各引物终浓度均为0.3μmol/L,突变型和野生型模板终浓度均为2ng/μl,加双蒸水至25μl。反应条件为:95℃预变性5min;95℃变性10s,55℃退火30s,72℃延伸20s,共45 个循环;72℃延伸5min。
1.3.2 HRM 检测:PCR 扩增完成后,将15μl 扩增产物装载于PCR 毛细管(大菱公司),以10μl石蜡油(Sigma,USA)封闭,采用HR-1 高分辨率熔解曲线分析系统(Idaho Technology,USA)进行HRM 分析。熔解曲线荧光信号收集温度设定为65℃~98℃,0.5℃/s。各熔解曲线使用HR-1 anaysis tool 软件进行分析。
2 结果
2.1 PCR 结果 见图1。在适宜的PCR 反应条件下,设计的四对引物均能特异地扩增出各自相对应的目的条带,扩增的野生型与突变型产物长度均与理论相符,且扩增效率良好。
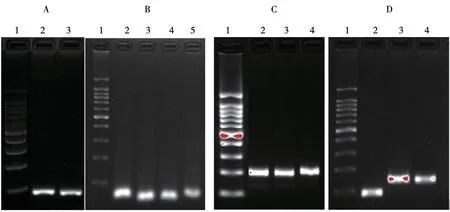
图1 各基因单独PCR 扩增产物电泳图
2.2 HRM 结果
2.2.1 各基因单独扩增HRM 结果:各基因单独扩增时扩增效率佳,荧光信号强。JAK2 外显子14 V617F,JAK2 外显子12,MPL 和CALR 的单独PCR 扩增产物经过HRM 分析,可以得到四组熔解峰,四组熔解峰之间分离良好,相互无重叠;野生型和突变型扩增子熔解温度差均在0.3℃以上。它们的PCR-HRM 曲线见图2。
2.2.2 多重PCR-HRM 体系探索结果:首先采用健康人标本(野生型)作为模板进行多重PCR-HRM实验,探索多重PCR 体系适宜的引物浓度和退火温度。结果显示,采用0.3μmol/L 和0.4μmol/L 引物浓度,55℃复性时,JAK2 外显子12 无扩增产物,0.3μmol/L 引物浓度的体系中其他各基因扩增效率皆优于0.4μmol/L 体系(图3A,黄色曲线各引物浓度均为0.3μmol/L,紫红色曲线各引物浓度均为0.4μmol/L)。在0.3μmol/L 引物浓度的条件下,55℃复性时,JAK2 V617F 及MPL 扩增效率均优于50℃,CALR 扩增效果则和50℃无区别(图3A,灰色退火温度为55℃,天蓝色退火温度为50℃);若将退火温度降至48℃,则除CALR 外,其余基因扩增效果均不佳(图3A,深蓝色退火温度为48℃)。所以,多重PCR-HRM 体系各引物浓度采用0.3μmol/L,退火温度采用55℃较为适宜。

图3 单管多重PCR-HRM 同时检测JAK2、MPL 和CALR 突变
2.2.3 多重PCR-HRM 体系突变检测:该多重PCR-HRM体系最终只实现了三个基因的同时扩增,JAK2 外显子12 在多重体系中扩增失败,71℃左右无熔解峰生成(图3A),其余野生型基因的熔解温度皆与单独扩增时相符。
因JAK2 外显子12 在多重体系中扩增失败,后续改为对包含JAK2 V617F,MPL 及CALR 突变的标本进行多重PCR-HRM 实验。在这一多重PCRHRM 体系中,JAK2 V617F 因扩增效率低,突变型扩增子熔解峰未能与野生型区分开来(图3B,深棕色为JAK2 V617F 野生型单独扩增熔解峰,浅棕色为JAK2 V617F 杂合突变型单独扩增熔解峰,蓝色连续曲线为正常人标本,灰色连续曲线为JAK2 V617F 杂合突变标本)。
MPL 和CALR 突变型在多重PCR-HRM 体系中扩增产物的熔解温度与单独扩增时相符,但多重体系中突变基因与其他野生型基因之间相互竞争,两者的扩增效率不一,突变基因扩增效率高(图3C,蓝色为MPL W515K 单独扩增熔解峰,天蓝色连续曲线为正常人标本,紫色连续曲线为MPL W515K 合成模板+正常人标本;图3D,天蓝色连续曲线为正常人标本,黄色连续曲线为CALR 突变I 型合成模板+正常人标本,紫红色连续曲线为CALR 突变II 型合成模板+正常人标本)。
3 讨论
JAK2,CALR 和MPL 突变检测对经典MPN 的诊断、治疗监测、预后判断具有重要的临床意义[2-3]。多重PCR-HRM 是一种简单、快速、高通量、闭管、低成本的突变检测和基因分型技术,广泛用于遗传病、肿瘤、病原微生物及个体化用药的分子诊断检测[4-5]。国内外已有学者应用PCR-HRM 技术检测这三个基因中的单个或两个基因突变,如早期RAPADO等[6]对JAK2基因外显子14和12的检测,LIM 等[7]对CALR 外显子9 的检测。NUSSENZVEIG等[8]应用单管多重PCR-HRM 技术同时检测JAK 2 外显子14,12 及MPL 基因外显子10 突变;MATSUMOTO 等[9]应用这一技术同时筛选JAK2和CALR 基因突变。尚未见应用多重PCR-HRM 技术同时检测上述三个基因突变的报道。本研究尝试建立一管法多重PCR-HRM 同时检测涵盖经典MPN 90%左右基因诊断信息的上述三个基因8 种常见突变,以便为经典MPN 的基因诊断提供一种简单、快速、闭管、低成本检测手段的可能。
本研究建立的一管法多重PCR-HRM 体系可以同时良好地筛选CALR 及MPL 基因突变,但该体系未达到预期效果,不能同步扩增JAK2 外显子12,且JAK2 V617F 突变型因扩增效率低。后续实验中,这两组引物需要重新设计,设计引物时应考虑加大各组突变峰之间的解链温度差距,如可以在引物5’端加入高含量的GC 或AT 或加入探针以提高扩增产物的熔解温度[10-11]。此外,CALR 及MPL 的引物也可以进一步优化,拉大CALR Ⅱ型突变峰与野生型、MPL基因W515K与W515L突变峰之间熔解温度的差距,以便更清晰、直观地判断具体突变。
- 现代检验医学杂志的其它文章
- 急性肺栓塞患者血清ADAM15和MMP-2表达水平及其与疾病严重程度的相关性研究
- 肺炎支原体感染诱发哮喘患儿血清中miR-424-5p和CX3CL1表达水平及与预后预测价值研究
- ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
- LncRNA NNT-AS1通过调控miR-582-5p/NCKAP1轴激活Hippo-YAP/TAZ信号通路促进膀胱癌细胞增殖、迁移、侵袭和干细胞干性影响
- 血浆外泌体miR-4306表达水平联合CT征象对单发非实性肺结节良恶性鉴别的价值研究
- 白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究

