经典型霍奇金淋巴瘤伴纵隔大肿块患者接受不同强度心脏保护方案化疗序贯放疗的心脏毒性分析*
魏雯,李仁琴,高东,黄瑞君,柳斌
610041 成都, 四川省肿瘤医院·研究所, 四川省癌症防治中心, 电子科技大学医学院 肿瘤内科中心(魏雯、李仁琴、黄瑞君、柳斌);615000 四川 凉山州,凉山彝族自治州第一人民医院 肿瘤科(高东)
经典型霍奇金淋巴瘤(classical Hodgkin lymphomas, cHL)是一种可治愈的恶性肿瘤,其发病年龄呈双峰型,主要以15~35 岁的青少年和大于55 岁的中老年人居多[1]。化疗+放疗等综合治疗可使该类患者5 年生存率达80%以上[2]。然而近年来人们开始越来越关注治疗带来的不良反应对生活质量的影响,如何在保证疗效的前提下尽可能降低患者治疗相关毒副反应成为当下临床研究的热点[3]。
在众多治疗相关毒副反应中较为严重并且突出的是心脏毒性。标准一线方案ABVD(多柔比星+博来霉素+长春新碱+达卡巴嗪)中的蒽环类药物是治疗霍奇金淋巴瘤的基石[4]。然而部分患者在治疗中可能出现蒽环类药物相关的急性、慢性以及迟发性的心脏毒性反应。急性心脏毒性通常在给药后的几小时或几天内发生,常表现为心内传导紊乱和心律失常,极少数病例表现为心包炎和左心衰;慢性心脏毒性通常在化疗后的1 年内发生,表现为左心室功能障碍,最终可导致心衰;迟发性心脏毒性常在化疗后数年发生,可表现心衰、心肌病及心律失常等,严重影响了患者的生活质量[5]。在既往的诊疗工作中发现合并纵隔大肿块的cHL 患者较其他患者更容易发生心脏毒性,然而其临床特征及发病机制并未完全清楚[5-6]。因此,极有必要对该类特殊患者的临床资料进行全面总结并深入分析,以帮助我们更好地认识和处理这种严重的治疗并发症。
1 资料与方法
1.1 一般资料
回顾性收集2011 年1 月至2020 年12 月四川省肿瘤医院淋巴瘤病区收治的初治cHL 伴纵隔大肿块患者,按照治疗方案分为3 组: EBVD 组(表柔比星+博来霉素+长春新碱+达卡巴嗪); EBVD+D 组(表柔比星+博来霉素+长春新碱+达卡巴嗪,配合右丙亚胺减轻心脏毒性); PBVD 组(多柔比星脂质体+博来霉素+长春新碱+达卡巴嗪)。纳入标准:(1)所有入组患者均经病理及影像诊断为cHL 合并纵隔大肿块。纵隔大肿块的定义[7]:纵隔胸廓比,即纵隔肿块最大宽度/T5 ~ 6 水平胸腔内最大直径 > 0.33;(2)患者进行化疗前心电图检查正常,心脏超声检查提示心脏结构、心肌运动及血流未见明显异常,左室收缩功能正常,其中左室射血分数(left ventricular ejection fraction,LVEF)≥60%;(3)完成至少4 周期含蒽环类药物的化疗;(4)化疗结束后序贯纵隔病灶放疗。排除既往有高血压、先心病、冠心病、心律失常、心脏瓣膜病、心肌病及心功能不全者。
1.2 方法
EBVD 组方案:表柔比星37.5 mg/m2+博来霉素10 mg/m2+长春新碱1.4 mg/m2+达卡巴嗪375 mg/m2静脉滴注d1,d15,q28 天; EBVD+D 组方案:EBVD 用法同前,右丙亚胺250 mg/m2,用表柔比星前30 分钟静脉滴注;PBVD 组:将EBVD 中的表柔比星换为多柔比星脂质体20 mg/m2静脉滴注,其余药物用法同前。收集并统计患者的基线数据,包括性别、年龄、分期、红细胞沉降率(erythrocyte sedimentation rate,ESR)、结外受累、B 症状、受累淋巴结区数目、纵隔放疗(mediastinal radiation therapy,MRT)剂量、心电图以及超声心动图(包括LEVF)。重复收集每2 周期治疗后或出现心脏毒性时的症状、以及上述检查指标。统计2011 年1 月至2020年12 月期间我科收治的所有非纵隔大肿块cHL 患者的心脏毒性发生率。
1.3 心脏毒性评价
心脏毒性主要包括以下1 项或多项[5]:(1)心肌电生理异常:包括ST-T 改变(包括心肌缺血的表现)、T 波异常、QT 间期延长及各种心律失常;(2)心肌损伤标志物异常:B 型脑利钠肽(brain natriuretic peptide,BNP)、肌酸激酶同工酶-MB(creatine kinase-MB isoenzyme,CK-MB)及心肌肌钙蛋白T/心肌肌钙蛋白I(cardiac troponin T/I,cTnT/TnI)等心肌酶谱异常;(3)症状异常:胸闷、心悸、呼吸困难甚至是充血性心功能不全的临床表现;(4)心脏结构改变和(或)收缩功能异常,LVEF 绝对值 < 55%(较基线降低至少5%,伴随慢性心力衰竭(chronic heart failure,CHF)的症状或体征;或较基线降低至少10%,未伴有症状或体征);(5)充血性心力衰竭的症状及体征。
1.4 随访
从治疗结束开始一共随访2 年,每3 个月一次,内容包括:临床症状(胸闷、心悸、呼吸困难)、生化指标BNP、CK-MB、cTnT/TnI、心电图、心脏彩超。
1.5 统计学方法
采用统计学软件SPSS 21.0 对所得数据进行统计学分析。正态分布计量资料以均数±标准差表示,计量资料不符合正态分布采用中位数(四分位数间距)表示。组间比较采用单因素方差分析;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患者的临床特征
共入组患者150 例,其中EBVD 组51 例,EBVD+D 组53 例,PBVD 组46 例。患者的基线临床特征详见表1。所有患者共完成765 个周期化疗,平均每位患者完成(5.1±1.1)周期化疗。所有患者均完成既定放疗计划,12%(18/150)的患者接受了≥36 Gy 的高剂量放疗。在所有患者中,64%为男性,平均年龄(37.1±14.7)岁,年龄大于50 岁患者占31.3%,18.7%的患者为Ⅲ~Ⅳ期,其中ESR异常、结外受累、合并B 症状者及受累淋巴结区 > 3 个的患者比例均不超过15%。3 个不同治疗方案组的性别构成、平均年龄差异无统计学意义;大于50 岁、Ⅲ~Ⅳ期、ESR 升高、结外受累、有B 症状、受累淋巴结区超过3 个以及接受高剂量放疗的患者比例差异均无统计学意义(P> 0.05),具有可比性。
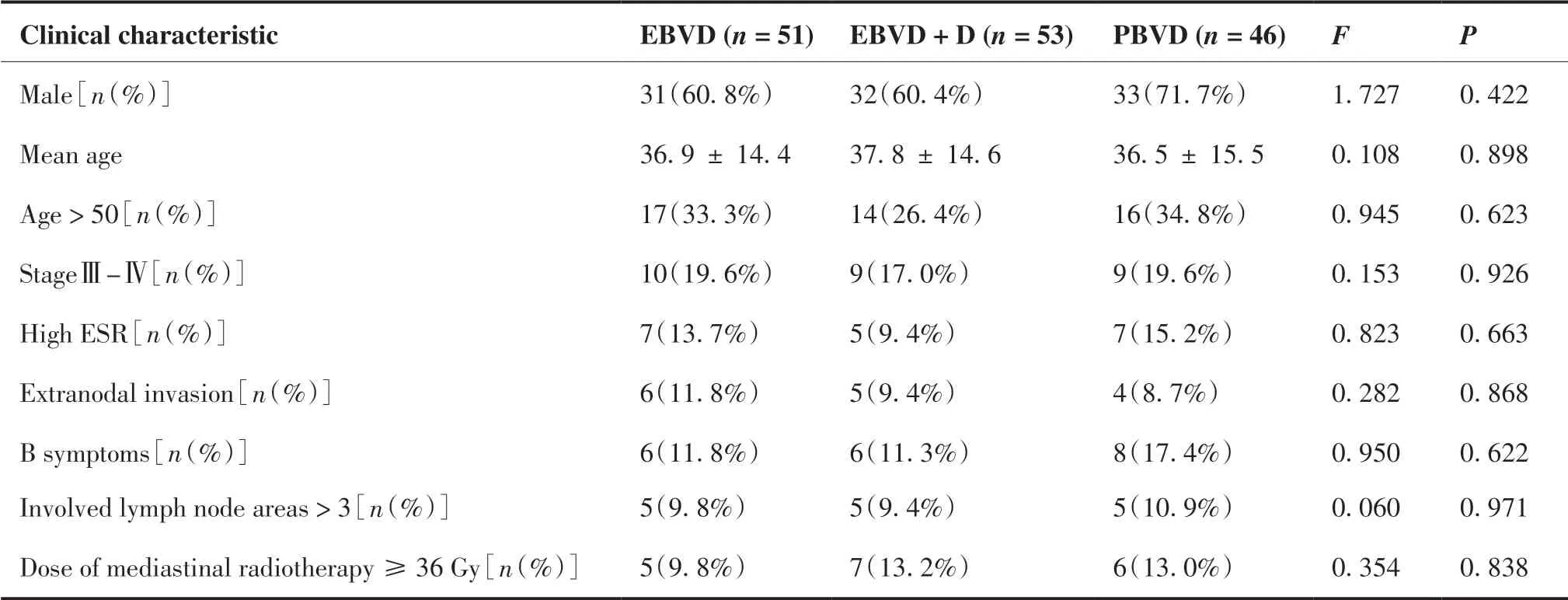
表1 患者的基线临床特征Table 1.Clinical Characteristics of Patients
2.2 患者的心脏毒性特征
患者的所有心脏毒性表现中,发生率较高的为ST-T 改变或T 波异常(42.7%)以及各种类型心律失常(33.3%);其次是胸闷等症状(18.0%)、QT 间期 延 长(16.7%)、BNP 增 高(13.3%)、CK-MB 升 高(10.7%);发生率较低的是cTnT/TnI 升高(6.0%)和LEVF 下降(1.3%)。3 组间的临床症状(胸闷、心悸、呼吸困难等)、ST-T 改变或T 波异常、心律失常、BNP 增高、LEVF 下降的发生率差异无统计学意义(P> 0.05)。QT 间期延长、CK-MB 及cTnT/TnI 异常的发生率差异有统计学意义:PBVD 组 < EBVD+D组 < EBVD 组(P< 0.05,表2)。
2013 版《蒽环类药物心脏毒性防治指南》中详细列出心脏不良事件评定标准,在各种心脏不良反应中,1 到2 级不良反应通常无症状或仅有轻度症状,可以表现为轻度的心肌酶升高、QT 间期延长、LVEF 下降等,而3 级及以上的心脏毒性通常有明显症状,甚至发生心绞痛及心衰,需要介入医学治疗[5]。我们发现患者的心脏毒性表现的出现顺序有一定规律性,一般刚开始出现无症状性的ST-T 改变或T 波异常、QT 间期延长和心律失常,而后出现胸闷、心悸、呼吸困难等症状,在此阶段患者的血流动力学稳定。随着病情逐渐加重,患者可表现为BNP增 高、LEVF 下 降、CK-MB 和cTnT/TnI 增 高,可 表现出心绞痛、冠心病甚至心力衰竭。我们综合该指南中的信息对表2 中的8 种异常表现进行赋值,每一种异常赋予1 分,总分<4 分定义为轻度心脏毒性,这部分患者多表现为心肌电生理异常(心电图异常)或生化指标(BNP、CK-MB 及cTnT/TnI)的异常,而不影响心脏的收缩,对冠脉及重要脏器的供血供氧无明显影响,通常无症状或仅有轻微症状。总分≥4 分定义为严重心脏毒性,这部分患者除了心电图和心肌酶谱的异常,还可能引起心脏收缩功能下降,表现为冠脉及重要脏器的缺血缺氧并出现相应的症状。按照该标准我们将2011 年1 月至2020年12 月我科收治的不伴纵隔大肿块的cHL 患者的数据进行回顾性总结,发现仅有5.6%(64/1147)的患者发生严重心脏毒性,而伴纵隔大肿块的cHL 患者严重心脏毒性的发生率为18.7%(28/150),显著高于前者(P< 0.05)。其中8%(12/150)为急性,75.3%(113/150)为慢性,16.7(25/150)为迟发性。3 组之间的严重心脏毒性发生率从高到低依次为:EBVD 组(29.4%) > EBVD+D 组(18.9%) > PBVD组(6.5%),差异有统计学意义(P= 0.015)。
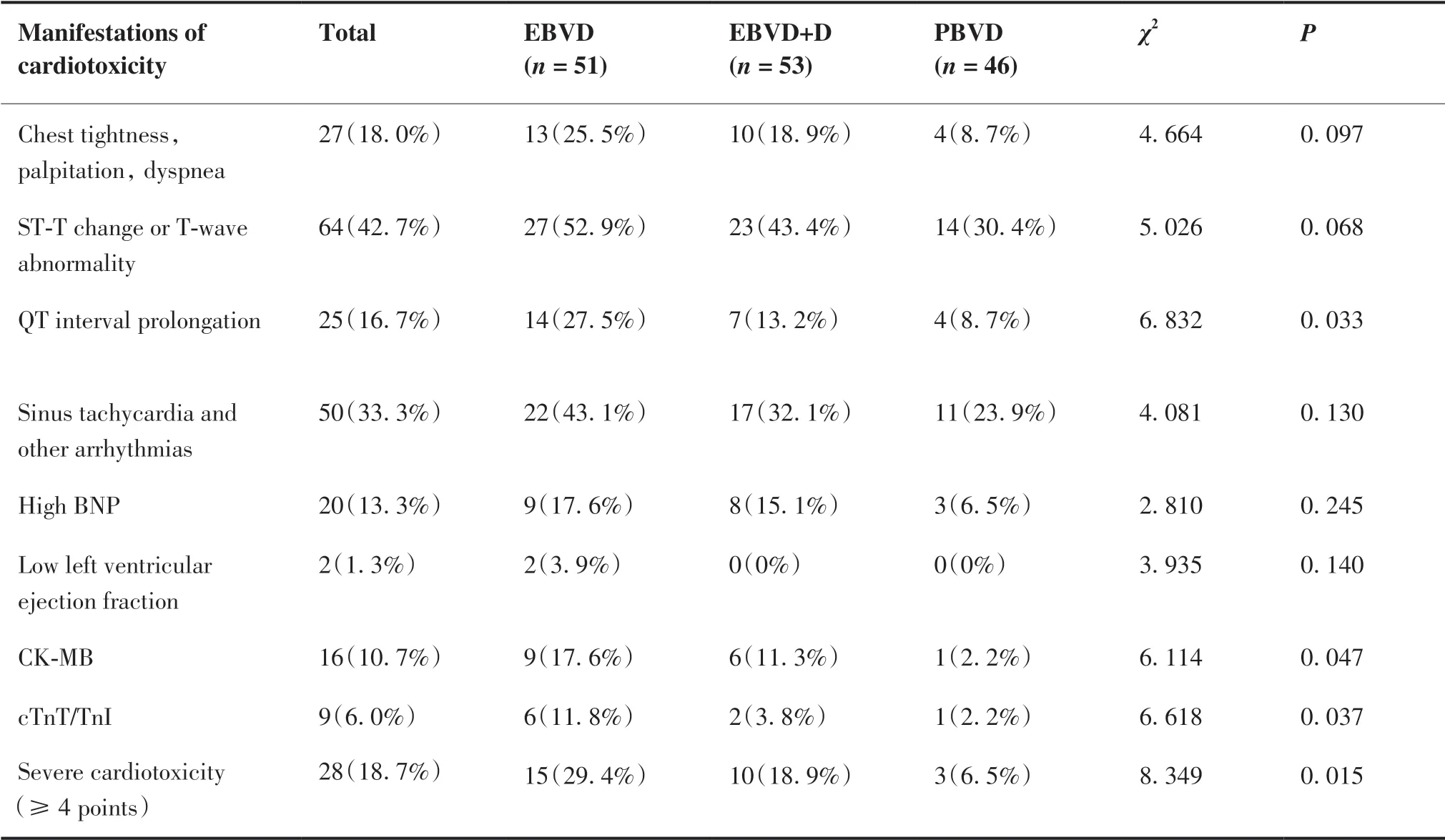
表2 患者的心脏毒性特征Table 2.Manifestations of Cardiotoxicity
2.3 非严重心脏毒性组和严重心脏毒性组患者特征比较
将150 例伴纵隔大肿块的cHL 患者中未发生严重心脏毒性和发生严重心脏毒性的病例进行比较(表3),后一组患者具有以下特点:平均年龄更大[(46.3±15.0)岁vs(35.0±13.9)岁 ,P< 0.001],男性(82.1%vs59.8%,P= 0.027)、吸烟者(75.0%vs29.5%,P< 0.001)、肥胖者(21.4%vs7.4%,P= 0.025)、糖尿病者(21.4%vs2.5%,P< 0.001)及接受纵隔高剂量放疗者的比例更高(32.1%vs7.4%,P< 0.001,表3)。
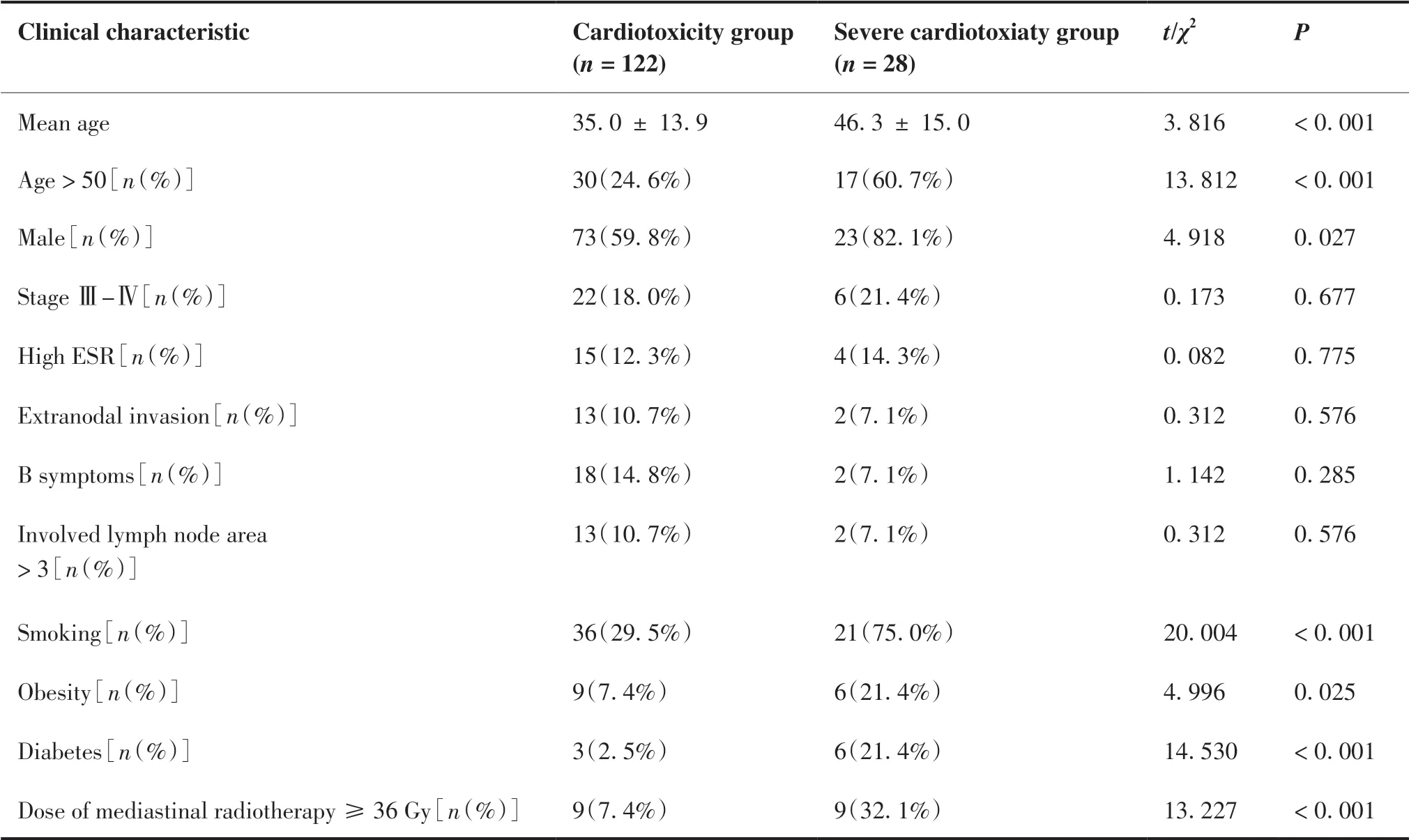
表3 非严重心脏毒性组和严重心脏毒性组的临床特点比较Table 3.Clinical Characteristics in Cardiotoxicity and Severe Cardiotoxicity Groups
3 讨 论
cHL 是一种潜在可治愈的肿瘤,通过化放疗等综合治疗方式能使其治愈率达80%以上[2-3]。随着患者生存率的显著提高,心血管毒性所致疾病成为长期生存者的第2 大死亡原因。cHL 治疗相关的心脏毒性包括:心功能不全和心力衰竭、冠状动脉疾病、心律失常等。在既往的临床工作中观察到cHL合并纵隔大肿块患者较非纵隔大肿块患者更容易合并心脏毒性。一旦心脏毒性发展为充血性心力衰竭,将影响患者淋巴瘤的后续治疗,严重降低患者的生活质量,明显缩短生存期[4]。因此,深入研究此类患者发生心脏毒性的临床特征具有重要意义。
治疗cHL 的一线标准方案为ABVD(多柔比星+博来霉素+长春新碱+达卡巴嗪)[8-9],其中多柔比星(ADM,简称A)是一种蒽环类药物,在cHL 的治疗中发挥了无可替代的重要作用,是ABVD 方案中最核心的药物。临床上常用心脏毒性更小的表柔比星(EPI,简称E)或多柔比星脂质体(PLD,简称P)等蒽环类药物进行等效替换[4-5,10]。蒽环类药物主要通过以下机制发挥其广谱强效的抗肿瘤作用:(1)嵌入DNA 双链的碱基之间,形成稳定复合物,抑制DNA 复制与RNA 合成;(2)抑制拓扑异构酶II,影响DNA 超螺旋转化成为松弛状态,从而阻碍DNA 复制与转录,并阻碍连接酶对DNA 的修复;(3)螯合铁离子后产生自由基从而破坏DNA、蛋白质,造成细胞膜及其他细胞器的损伤[10-14]。然而,蒽环类药物在具有广谱高效抗肿瘤作用的同时也普遍存在不同程度的心脏毒性,在一定程度上限制了其临床使用[15]。蒽环类药物相关的心脏毒性可以是隐匿性的(仅在做心电图、查生化或做心脏彩超检查时被发现,文献报道其发病率约9%~35%),也可以表现为有临床症状的心脏毒性(如胸闷、心悸和呼吸困难等,文献报道其发病率约2%~4%)[4]。蒽环类心脏毒性的定义是指由于药物对心肌和/或心电传导系统毒性作用引起的心脏病变。蒽环类药物引起的心肌损伤刚开始可表现为单个心肌细胞溶解,进一步演变为斑片状心肌坏死及间质纤维化,继而引起多灶性心肌纤维化伴心肌结构紊乱,最终表现为临床可观察到的充血性心力衰竭[4]。蒽环类药物导致心脏毒性的分子机制尚未完全明确,可能与自由基引起的脂质过氧化反应有关。蒽环类药物螯合铁离子后触发氧自由基,导致心肌细胞膜脂质过氧化和心肌线粒体DNA 的损伤,破坏心肌支架结构,引起心律失常,导致心肌收缩和舒张功能受损[6,16]。蒽环类药物引发的心脏毒性大部分与药物累积剂量有关,通常表现为慢性(发生在数周期化疗后),也可表现为迟发性(发生在治疗结束数年后)[12]。极少数患者的心脏器质性损害可表现为急性即在第一次使用蒽环类药物时发生。近年来,一系列新的研究表明一些接受低剂量多柔比星治疗的患者在长期随访时也发现有心功能的异常。在使用蒽环类药物尚未达到最大累积剂量时,已可观察到相当比例的心脏损害,因此蒽环类药物没有绝对的“安全剂量”。这可能与患者体内代谢蒽环类药物相关基因的多态性导致其易感性不同有关[6,8-9]。PLD 是蒽环类药物的新型制剂,在脂质体外经高度亲水性的聚乙二醇修饰,较普通阿霉素的清除率降低,半衰期延长。PLD 改变了普通阿霉素在体内的代谢分布:增加阿霉素对肿瘤的靶向作用;减少阿霉素对正常组织的毒性,特别是对骨髓和心肌的毒性,可以减少脱发的发生[17]。本研究中PBVD 组患者的严重心脏毒性发生率明显低于另外两组且差异有统计学意义,因此我们建议对该类特殊患者如果经费允许可考虑使用PLD 减低发生心脏毒性的风险。
右丙亚胺是FDA 批准的唯一一种用于蒽环类药物诱导心脏毒性的心脏保护药物,右丙亚胺是乙二胺四乙酸的衍生物,水溶性极强,能阻断蒽环类药物的离子鳌合物,升高血清超氧化物歧化酶活性,降低丙二醛水平,增强机体清除自由基的能力,抑制脂质过氧化损伤从而达到保护心脏的作用[18-19]。除此之外,右丙亚胺还能提升低氧诱导因子(hypoxia-inducible factor, HIF)的活性,调节人体内HIF 的释放,而HIF 能较好地保持人体内氧稳态平衡,还参与细胞正常生长和适应应激反应等生理和病理的过程,从而减轻蒽环类药物所致的心脏毒性[20-21]。但同时有研究报道,右丙亚胺作为拓扑异构酶Ⅱ抑制剂,与蒽环类等化疗药物同时使用可能降低蒽环类化疗药物的抗肿瘤效果。但包括2016年JCO 发布的POG9404 研究、《中国抗癌协会乳腺癌诊治指南与规范(2017 年版)》在内以及越来越多的Meta 分析研究证实了右丙亚胺具有心脏保护作用,该药物不会影响蒽环类药物抗肿瘤效果且不会增加其他毒性作用,并建议使用右丙亚胺作为心脏保护剂用于使用蒽环类药物治疗的多种恶性肿瘤人群。本研究中加入右丙亚胺的EBVD+D 组的严重心脏毒性发生率明显低于EBVD 组,因此,我们认为在该特殊患者群体的治疗中加入右丙亚胺可以降低心脏毒性的风险。
MRT 导致的心血管疾病主要与心脏剂量和受照体积有关,MRT 剂量与心脏并发症风险存在线性关系,心脏平均剂量每增加1Gy,主要冠脉事件的风险增加7.4%,但无明显致病剂量阈值[22]。放疗对心脏的损伤主要包括冠状动脉、瓣膜、心包、心脏传导系统和心肌,放射治疗可产生过多的花生四烯酸样物质,如前列腺素、前列环素、血栓烷素和白三烯等炎症介质,最终导致心脏各级血管炎症和血栓形成[23]。放疗导致的大血管炎性反应和氧化损伤合并高胆固醇,增强了低密度脂蛋白的氧化,使它们被巨噬细胞吞食,触发了动脉硬化过程。放疗引起毛细血管网的损伤、毛细血管扩张继而引起微血栓和缺血最终导致心肌变性及纤维化。心肌纤维化甚至形成疤痕后影响心脏自主收缩功能及传导异常。随着放疗技术的发展、高效化疗方案的出现,MRT 剂量和靶区均减小,放疗后心脏并发症风险较过去降低,但其仍是恶性肿瘤患者MRT 后影响其生存的严重并发症之一[24]。本研究根据NCCN 指南推荐及临床实际情况以36 Gy 为界限分为高剂量放疗组和低剂量放疗组,证实了放射剂量的增高可能导致心脏毒性的增加(32.1%vs7.4%,P< 0.001),因此不建议盲目增加局部放疗剂量。除了上述蒽环类药物化疗和放疗的影响,合并纵膈大肿块的cHL 较非纵膈大肿块的cHL 患者发生心脏毒性的几率更高,纵隔大肿块的占位对心脏直接造成压迫和浸润可能也是引起心脏毒性的机械物理性原因之一[9]。
早期心脏毒性反应发生于用药期间或用药后不久,症状隐匿:损伤的心肌细胞的电生理发生改变,表现为各种类型的心电图异常。此阶段心电图异常的发生率虽然较高,但持续时间短,停药后即可恢复。随着病情加重,损伤的心肌可能释放出大量的特有活性酶与蛋白。心脏彩超可提示LEVF 下降等异常,最终表现为充血性心力衰竭的症状和体征[23]。另有研究表明,心脏核磁共振成像可能有助于较心脏超声更早地发现心肌的结构改变和功能异常[5]。但由于价格昂贵临床上未常规开展。
综上,我们的研究提示cHL 合并纵隔大肿块的患者的心脏毒性大多数症状隐匿,仅有心电图异常,也可表现为心肌酶谱的升高或者LEVF 轻度下降,这类患者虽然有心脏功能受损,但重要脏器供血供氧相对稳定,并未造成严重心脏事件。少数患者可能发展为严重心脏毒性甚至最终发展为心力衰竭,与纵隔高剂量放疗(≥36Gy),年龄 > 50 岁、男性、肥胖、吸烟史、糖尿病等因素有关。
对于有高危因素的患者可采取的预防措施有:(1)适当的运动及饮食指导,控制体重使BMI 维持在正常范围;(2)戒烟;(3)严格控制血糖及血压;(4)制定合理的剂量范围,避免过度放疗;(5)对同时具备多项危险因素的患者可以做NGS 二代测序了解心脏毒性相关易感基因的情况;如携带此类易感基因或经济允许的情况下强烈建议使用右丙亚胺等心脏保护剂,或将普通蒽环类药物替换为心脏毒性较小的多柔比星脂质体;(6)其他可以尝试的方式:在高危人群中应用血管紧张素转化酶抑制剂、ARB 或β受体阻滞剂等或许对心脏有保护作用[5]。临床工作中应提高警惕,严密观察患者的临床症状和体征,定期监测心电图、心肌酶谱及心脏彩超甚至可以考虑做心脏核磁,尽可能更早期地发现隐匿的心肌损伤,及时采取干预措施将心脏毒性对患者的影响降到最低。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

