P53 介导miRNA-30e-5p 抑制乳腺癌细胞恶性表型的实验研究*
刘嘉玉,李泽颖,陈玲燕,梅杰,马涛,张岩
214122 江苏 无锡,江南大学无锡医学院无锡市妇幼保健院 乳腺外科(刘嘉玉、马涛、张岩); 214023江苏 无锡,南京医科大学 无锡临床医学院(李泽颖、陈玲燕、梅杰)
2020 年,女性乳腺癌的发病率已超过肺癌,占据全球癌症发病率榜首,估计有230 万例新发病例,占所有癌症新病例的11.7%[1]。随着乳腺癌早期筛查、诊断和治疗方案的进步,患者的存活率已有所提高。微小RNA(microRNA,miRNA)是一类内源性的非编码单链RNA,可结合靶基因mRNA 的3’-UTR 区,在转录水平使mRNA 降解或在翻译水平抑制蛋白表达,其功能取决于与靶序列mRNA 的互补程度[2]。miRNA 表达异常可引起下游基因或信号通路的状态发生改变,从而调控细胞增殖、凋亡、迁移等生物学现象[3]。癌症生物学的最新进展发现,除了表观基因组的修饰,miRNA失调也可作为恶性肿瘤发生和转移的标志。在乳腺癌中,miRNA 可通过调控DNA 和组蛋白修饰从而造成乳腺癌表观遗传学的变化[4],同时miRNA也可作为乳腺癌早期发展的生物标记物,为其靶向治疗提供指导[5]。有研究发现,miR-30 家族,包括miR-30a、miR-30b、miR-30c、miR-30d 和miR-30e等,均可作为乳腺癌骨转移抑制因子[6],且有研究证实miR-30e-5p 可通过调节异黏蛋白来抑制膀胱癌细胞的增殖和迁移[7]。然而,miR-30e-5p 对乳腺癌细胞恶性表型的机制研究还相对较少。P53 是经典的抑癌基因,其失活会促进乳腺肿瘤的进展,尤其是在预后不良的三阴性乳腺癌中更为明显[8]。P53 介导的miRNA 相关通路进而影响肿瘤细胞恶性表型的机制还有待进一步发掘。基于此,本文旨在探讨P53 介导的miR-30e-5p 对乳腺癌细胞生物学行为的影响。
1 材料与方法
1.1 细胞培养与转染
人乳癌腺细胞系MCF-7、MDA-MB-453 购自江苏凯基生物技术股份有限公司。使用含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640 培养基培养MCF-7 和MDA-MB-453 细胞,培养条件:温度为37℃,5%CO2。为进行后续试验,利用Lipofectamine 3000(Invitrogen) 对MCF-7 和MDA-MB-453细胞进行转染操作。转染的基本步骤:先将1.5 μL Lipo3000 转染试剂加入25 μL 的Opti-MEM 培养液中混匀,同时将1.25 pL、2.5 pL、5 μL miRNA-467b的mimics-GFP 分 别 与25 μL 的Opti-MEM 培 养液混合,孵育5 min 后将上述两溶液混匀,室温静置20 min,将50 μL Lipo-miRNA 复合体逐滴均匀地加入细胞培养液中,分别形成含有50 nmol/L、100 nmol/L、200 nmol/L 的miRNA mimics 的转染体系,4 ~ 6 h 后换用新鲜培养液,终止转染。转染24 h后流式检测转染效率。
1.2 染色质免疫共沉淀
向培养液中加入1%终浓度的甲醛(0.275 mL,37%)固定10 min,使DNA 蛋白结合体交联,然后加入终浓度约为0.12 mol 的甘氨酸(0.675 mL,2 M),孵育10 min,终止交联。加5 mL TNT Buffer,离心(2 000 r/min,4℃,5 min)后弃上清,取胞核沉淀保存备用。向胞核沉淀中加1 mL NB buffer,转移至两个EP 管中,一管备用,另一管超声切碎至DNA 片段集中在200 ~ 1 000 bp,超声条件:500 W,超声10 s,冰上放置2 ~ 3 min,共7 ~ 10 次,至液体变澄清。取100 μg DNA 至新EP 管内(另准备10 μg input备用),加入700 μL DB buffer 稀释。然后加入2 μg抗体及2 μg 相对应的兔或鼠IgG,4℃,转盘转动结合1 ~ 2 h,离心(14 000 r/min,4 ℃,离心10 min),取上清,各加40 ~ 50μL 预处理过的蛋白G-Sepharose beads,4 ℃过夜。离心(3 000 r/min,3 min)弃上清,先后用RIPA I、RIPA II、LiCl buffer、TE buffer 洗涤1次。弃去TE buffer 后,beads 用200μL 洗脱buffer洗脱两次,65 ℃下孵育10 min。收集洗脱后的样品,加入2 μL 蛋白酶K,在65 ℃解交联过夜,从而分离结合在一起的DNA 和蛋白。将各样品进行SDS-聚丙烯酰胺凝胶电泳,凝胶取出后拍照观察目的片段表达量。
1.3 荧光定量PCR 检测
根据JASPAR 预测结合位点,使用Primer Blast设计P53 在miR-30e-5p 前体结合片段的荧光定量PCR 引物,进行PCR 反应(94℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸45 s,循环26 次,72℃最终延伸10 min),测定CT 值。引物序列如下:CCAGGCTCTAACCCACAT(正向); GTGGCAGAATCTCACAGG(反向)。
此外,qPCR 也被用于miR-30e-5p 表达水平的检测,U6 作为内参,引物序列如下:miR-30e-5p:GCGCGTGTAAACATCCTTGAC(正向),AGTGCAGGGTCCGAGGTATT(反向);U6:CTCGCTTCGGCAGCACA(正向),AACGCTTCACGAATTTGCGT(反向)。
1.4 CCK-8 法检测细胞增殖
细胞转染后48 h,用0.25%胰蛋白酶消化1 min,然后将其重悬于含有10%FBS 的RPMI 1640 培养基中。将悬浮的细胞接种到96 孔板(Corning Incorporated,美国),细胞密度调整为4×104个细胞/mL(100 μL/孔),并在5%CO2恒温培养箱中37℃孵育24 h、48 h、72 h。每个孔添加10 μL CCK-8,然后将板置于培养箱中2 h。用酶标仪在450 nm 下测量每个孔的光密度值。每个实验重复3 遍。
1.5 划痕法检测细胞迁移
将对数生长期的细胞消化接种到六孔板中,细胞饥饿过夜处理。待细胞集合度达80%左右,在用无菌枪头在六孔板中均匀划线,根据组别按1.1步骤转染。转染24 h、48 h 后,取出细胞,生物倒置显微镜拍照(放大倍数100×),用0 h 时划痕边缘与24 h、48h 时划痕边缘之间的距离来计算迁移距离。
1.6 Transwell 法检测细胞侵袭
用0.25%胰酶消化收集细胞,细胞饥饿过夜处理。使用不完全培养基调整细胞密度至1×105个/mL,取细胞悬液100 μL 加入Transwell 小室上室(Corning Incorporated),上室涂有Matrigel。将24 孔细胞培养板置于37℃,5% CO2培养箱中培养,24 h 后将小室取出,弃去孔中培养基,PBS 漂洗3 次,将小室内PBS吸干净,此过程快速完成,避免让小室的膜过于干燥。用无水甲醇固定细胞15 min,小室翻转晾干10 min。在24 孔板加入500 μL 含0.1%结晶紫,小室置于其中染色30 min。取出后PBS 清洗至无残留,生物倒置显微镜下拍照(放大倍数200×)并计数。
1.7 Western blot
将细胞放置在35 毫米皿中(6×105个细胞/皿)。转染后48 h,所有细胞均用裂解缓冲液处理,以提取总蛋白。SDS-聚丙烯酰胺凝胶电泳和蛋白质印迹分析依据标准方案进行。先使用核蛋白和总蛋白提取试剂盒(凯基生物)提取核蛋白和总蛋白,MMP9(1∶1 000 稀释, Abcam),CyclinD1(1∶1 000 稀释,Abcam),β-catenin(1∶1 000 稀释,Abcam),对于每个样品,将蛋白质的表达水平相对于GAPDH 标准化。
1.8 激光共聚焦检测
将盖玻片浸入细胞培养基,使细胞附着生长。用PBS 洗3 次,每次5 min。然后用多聚甲醛(4%)将细胞固定15 min,将盖玻片用PBS 洗3 次。接着,将盖玻片放在含有0.5%Triton X-100 的PBS 液中孵育5 min,并将细胞用5%脱脂奶封闭1 h,然后加入β-catenin 抗体(1∶200 稀释,Abcam),在4 ℃下孵育过夜。将盖玻片用PBS 洗涤后加二抗(羊抗兔IgG-FITC,1∶100 稀释,凯基生物)避光孵育1 h。在每张片子滴加50 ~ 100 μL DAPI 染液,避光放置5 min,PBS 洗三次。用防淬灭封片胶封片。激光共聚焦显微镜下观察细胞中蛋白的表达情况,取3 个表达区域拍照(放大倍数600×)。
1.9 统计学方法
利用SPSS 26.0 统计学软件,计量数据以均数±标准差表示,miR-30e-5p 的表达量比较采用独立样本t检验,细胞增殖、迁移和侵袭比较采用t检验,P< 0.05 为差异有统计学意义。
2 结 果
2.1 P53 转录激活miR-30e-5p
通过染色质免疫共沉淀与荧光定量PCR 检测发现,在P53 野生型的MCF-7 细胞中,P53 抗体结合的miR-30e-5p 启动子区序列显著高于IgG,而在P53突变的MDA-MB-453 中,P53 抗体仍可与miR-30e-5p 启动子区序列结合,但较MCF-7 细胞弱(图1A)。与对照组相比,转染了P53 野生型质粒的MCF-7 和MDA-MB-453 细胞,miR-30e-5p 的表达水平明显上调(P< 0.05,图1B),提示P53 可以转录激活miR-30e-5p。
2.2 miR-30e-5p 对细胞增殖、迁移、侵袭能力的影响
MDA-MB-453、MCF-7乳腺癌细胞转染miR-30e-5p 后,利用CCK8 法检测其增殖能力变化。与对照组相比,转染miR-30e-5p 的MDA-MB-453 和MCF-7细胞的增殖能力均受不同程度的抑制(P< 0.05,图2),提示转染miR-30e-5p 后乳腺癌细胞的增殖能力下调。

图1 P53 与启动子结合转录激活miR-30e-5pFigure 1. P53 Binds to the Promoter to Transcriptionally Activate MiR-30e-5p
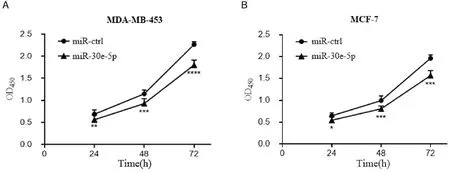
图2 miR-30e-5p 抑制细胞增殖Figure 2.MiR-30e-5p Inhibits Cell Proliferation
利用划痕试验检测转染miR-30e-5p 的MCF-7、MDA-MB-453 乳腺癌细胞的迁移能力。分别在划痕后24 h,48 h 检测迁移的距离,结果表明,转染miR-30e-5p 的MDA-MB-453 和MCF-7 细胞的迁移能力受到抑制(P< 0.05;图3)。利用Transwell 小室检测其侵袭能力变化,发现转染miR-30e-5p 的MDAMB-453 和MCF-7 细胞的侵袭能力受到显著抑制(P< 0.05;图4)。因此,转染miR-30e-5p 后,乳腺癌细胞的迁移、侵袭能力均下调。
2.3 miR-30e-5p 抑制经典Wnt 通路
激光共聚焦显微观察发现,转染miR-30e-5p的细胞,其核内β-catenin 的水平明显下调(图5)。进一步利用Western blot 实验,观察到转染miR-30e-5p 细胞的核内β-catenin 水平显著下调。此外,β-catenin 靶基因MMP9 及Cyclin D1 表达水平明显下调(图6)。
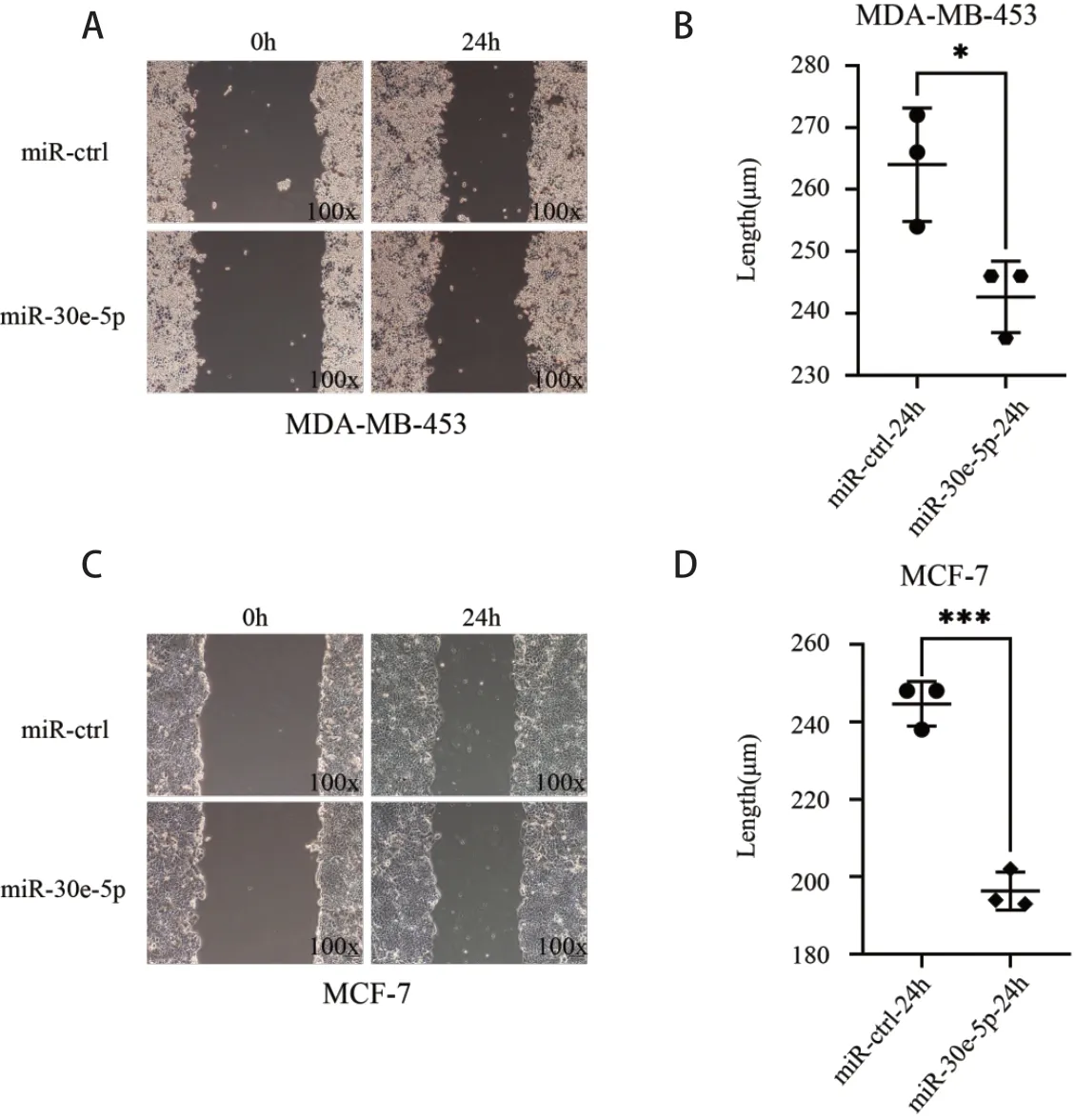
图3 miR-30e-5p 抑制细胞迁移(×100,*P < 0.05)Figure 3.MiR-30e-5p Inhibits Cell Migration (×100, *P < 0.05)
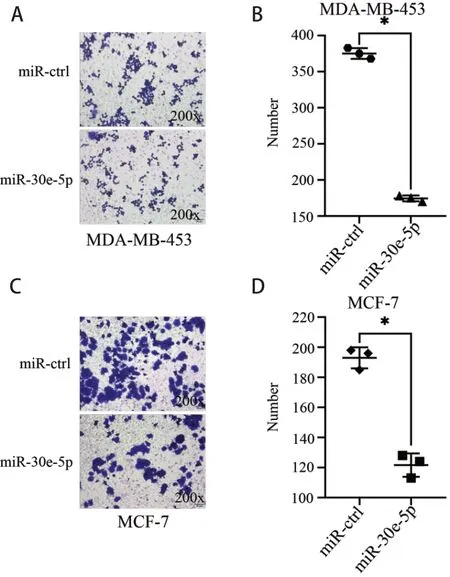
图4 miR-30e-5p 抑制细胞侵袭(结晶紫染色,×200,*P <0.05)Figure 4.MiR-30e-5p Inhibits Cell Invasion (Crystal Violet Staining,×200, *P < 0.05)
A-B. Transfection of miR-30e-5p down-regulates the invasion ability of MDA-MB-453 cells; C-D. Transfection of miR-30e-5p down-regulates the invasion ability of MCF-7 cells
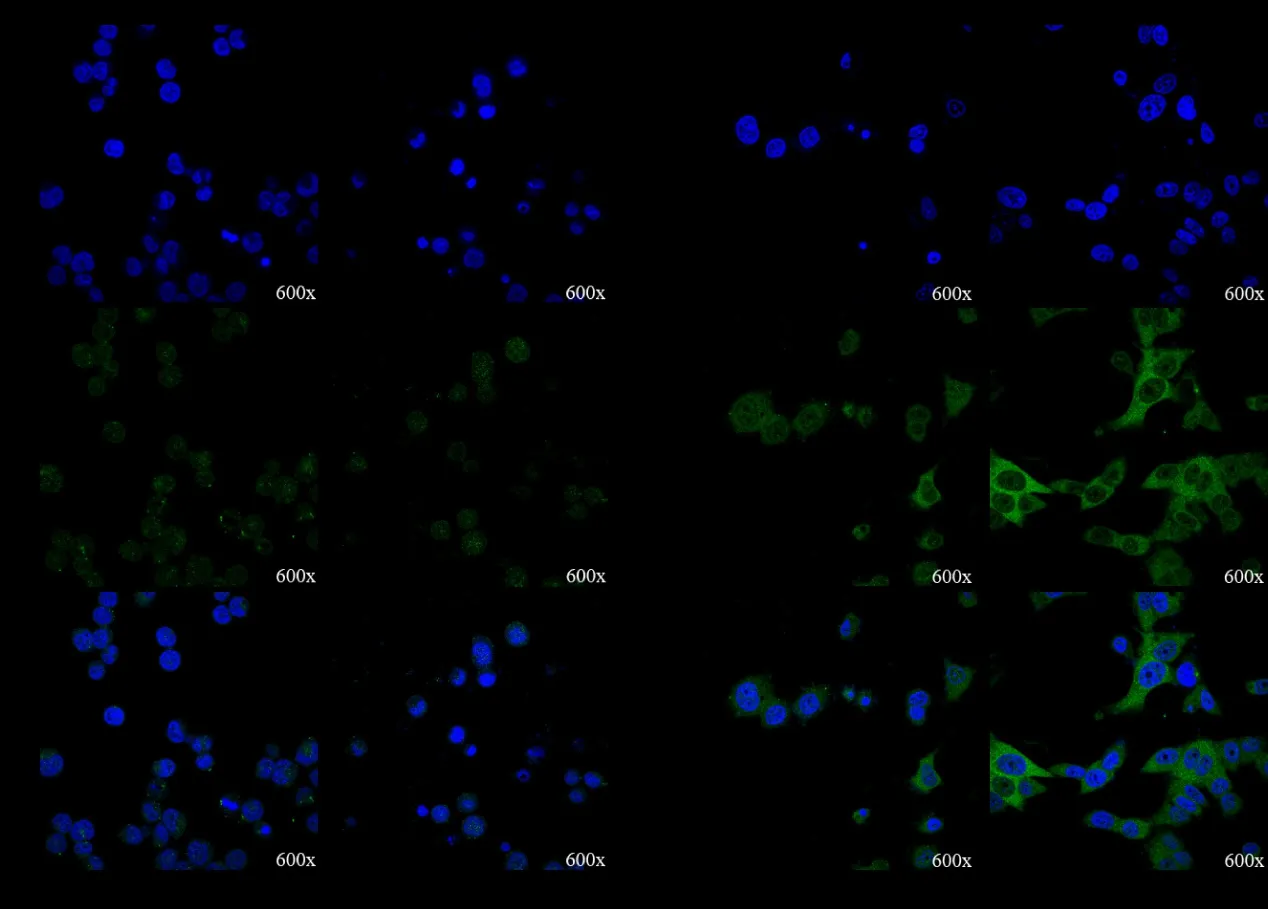
图 5 激光共聚焦显微观察转染miR-30e-5p 的细胞胞核内β-catenin 的水平下调(DAPI 染色,×600)Figure 5.Down-Regulated β-Catenin Level in the Nuclei of Cells Transfected with MiR-30e-5p Observed by Laser Confocal Microscopy (DAPI Staining, ×600)
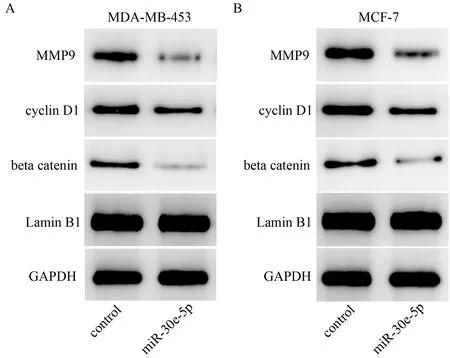
图 6 Western blot 显示MMP9、Cyclin D1 与核内β-catenin 表达水平明显下调Figure 6.Significantly Down-Regulated Levels of MMP9, Cyclin D1 and Nuclear β-Catenin in Western Blot
3 讨 论
近年来,miRNA 通过调控靶基因的表达从而影响癌细胞生物学行为一直是乳腺癌领域的研究热点,其中,对于miR-30e-5p 的研究还相对较少。P53是人类癌症中最频繁改变的基因,在侵袭性肿瘤中约有50%存在突变,在三阴性乳腺癌等难以治疗的癌症中80%以上发生突变[9]。P53 调控的miRNA相关通路进而影响肿瘤细胞恶性表型的机制还有待进一步发掘。本文利用染色质免疫共沉淀与荧光定量PCR 检测发现,在乳腺癌MCF-7 细胞中P53可结合miR-30e-5p 启动子区域,转录激活miR-30e-5p 的表达。
miR-30 家族具有抑制癌细胞侵袭和转移的作用,其在5’端附近具有相同的种子序列,而在3’端附近具有不同的补偿序列,在不同类型肿瘤中可同时发挥抑癌和致癌作用[10]。在乳腺癌中,miR-30或作为肿瘤抑制因子发挥作用[11-12]。研究表明,乳腺癌细胞中的miR-30c 表达降低,而miR-30c 能结合KRAS 转录产物的3’UTP 并沉默KRAS,抑制癌细胞的转移[13],并靶向作用于VIM/TWF1 而抑制细胞侵袭[14]。此外,miR-30c 可通过HER/RACI 途径发挥作用,或可作为他莫昔芬治疗潜在的预后生物标志物,为晚期雌激素受体阳性乳腺癌患者是否能从内分泌治疗中得到临床获益提供预测指标[15]。miR-30 家族的另一成员miR-30e 通过直接靶向IRS1 阻断AKT 和ERK1/2 途径的激活以及HIF-1α和VEGF 的表达,进而抑制细胞增殖、迁移和侵袭[16]。此外,RPS6KB1 与miR-30e 的3’-UTR 结合而成为其直接靶标,促进食管癌细胞增殖、侵袭和肿瘤生长[17]。有学者发现,miR-30 可通过抑制乳腺癌中的CTHRC1 从而抑制癌细胞侵袭和转移,并诱导细胞凋亡[18]。
Wnt/β-catenin 是在进化中高度保守的信号传导途径,具有调节细胞增殖、分化、迁移、凋亡和干细胞更新等功能。其中,β-catenin 是钙黏蛋白复合物的核心成分,可调节细胞增殖中涉及的多种蛋白质的表达,如cyclin D1,在乳腺癌组织中该蛋白表达上调,其核蓄积是激活Wnt/β-catenin 信号通路的关键[19-20]。研究发现,β-catenin 可作为某些miRNA的 靶 基 因,包 括miR-26b、miR-135、miR-214、miR-216a 和miR-340[21]。本 文 发 现 乳 腺 癌 细 胞 表 达miR-30e-5p 后,肿瘤细胞增殖、迁移和侵袭能力受到抑制,且miR-30e-5p 可通过抑制经典Wnt 通路发挥作用。
综上所述,本研究发现P53 可介导miR-30e-5p表达,通过抑制经典Wnt 通路从而抑制乳腺癌细胞恶性表型,证明miR-30e-5p 有希望成为乳腺癌治疗的潜在靶点,为乳腺癌靶向治疗提供指导。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

