胃肝样腺癌中PD-L1 表达与临床病理特征的关系及对预后的影响*
王涛,王蒙,梁彦旭,杜书祥,周杨,吴刚,孙培春
450003 郑州,郑州大学人民医院/河南省人民医院 胃肠外科
胃肝样腺癌(hepatoid adenocarcinoma of the stomach,HAS)是胃癌中一种罕见的组织学类型,在所有胃癌中发生率≤1%[1],由于目前对HAS 认识非常有限,临床上容易对其造成误诊和漏诊。HAS 由多角形嗜酸性肝细胞样肿瘤细胞组成,常伴有AFP不同程度的升高[2]。研究表明HAS 患者的预后较差,且易发生淋巴结转移和肝转移[3],目前HAS 的治疗主要以手术和化疗为主,但治愈率极低。近年来,免疫检查点抑制剂已成为肿瘤免疫治疗的热点,其机制是通过阻断程序性死亡受体1(programmed death-1,PD-1) /程序性死亡配体1(programmed deathligand 1,PD-L1)信号通路来改善人体自身免疫系统,从而达到杀死肿瘤细胞的目的[4]。多项研究表明普通胃腺癌中PD-L1 的表达与淋巴结转移、远处转移、浸润深度、血管浸润和恶性程度显著相关[5-6],且预示不良的预后。我们通过研究HAS 中PD-L1的表达情况,分析PD-L1 过表达是否可促进HAS 转移和浸润并影响预后。因此,探讨HAS 中PD-L1 表达与临床病理特征的关系及对预后的影响,深入了解HAS 的复发转移机制,可为PD-L1 阳性HAS 的免疫治疗提供新的依据。
1 资料与方法
1.1 一般资料
收集2014 年1 月至2021 年5 月我院收治的42 例HAS 患者的临床病理资料,并由两名病理科医师对病理信息进行重新确认。男33 例,女9 例,年 龄40 ~ 81 岁,平均年龄62.17 岁;PD-L1 阳 性25 例;AFP 染色阳性30 例;Ki67 阳性33 例;肿瘤分期根据第8 版UICC/AJCC TNM 分期确定,其中Ⅰ~Ⅱ期9 例,Ⅲ~Ⅳ期33 例;根据肿瘤分化程度:低分化27 例,中 ~ 高分化15 例;肿瘤浸润深度:T1/T2 7 例,T3/T4 35 例;出现淋巴结转移28 例;肿瘤位于贲门11 例、胃体15 例、胃窦16 例;溃疡型30 例;肿瘤直径 > 5 cm 21 例;存在脉管内癌栓29 例;神经侵犯24 例;19 例出现远处转移(16例肝转移、1 例肺转移、2 例同时出现胰腺、十二指肠和横结肠受侵)。
通过电话、短信及门诊随访,总生存期(overall survival,OS)从HAS 确诊开始计算到患者死亡或末次随访时间,42 例HAS 患者均有完整的随访资料。
1.2 检测方法与阳性判定
1.2.1 PD-L1 蛋白的检测 试剂采用兔抗人PD-L1单克隆抗体(克隆号22C3,丹麦DaKo 公司)。采用免疫组化MaxVision 法。将组织标本切片后固定-脱水-透明-浸蜡后,切成薄片(4 ~ 5μm)备用,采用樱花SAKURA Tissue-Tek 染色机进行HE 染色,使用全自动免疫组化机对组织标本进行免疫组化染色。按照22C3 PharmDx 试剂盒的操作流程进行操作,然后对切片进行复染-封片-阅片。PD-L1 蛋白检测均以人足月胎盘组织切片为阳性对照,以阴性质控抗体代替一抗作为阴性对照。我们采用联合阳性评分(combined positive score,CPS)来评估HAS组织中PD-L1 蛋白的表达水平,相较于肿瘤细胞阳性比例评分,CPS 不仅评判肿瘤细胞中PD-L1 的表达水平,同时也引入了淋巴细胞、肿瘤相关巨噬细胞等免疫细胞,可以筛查出更多可能从免疫治疗中获益的患者[7-8]。
1.2.2 PD-L1 阳性判定 PD-L1 阳性判定:CPS 计数标准 = (PD-L1 阳性的肿瘤细胞、淋巴细胞和巨噬细胞总数)/活的肿瘤细胞总数×100%。当 CPS ≥1%时,判定PD-L1 表达阳性[8]。
1.3 HAS 的病理组织学诊断
HAS 的诊断主要依靠病理组织学,病理形态上出现肝细胞分化区域的胃癌,不管血清AFP 或AFP染色是否阳性,均可诊断为HAS。在HE 染色下,肝样分化区类似于肝癌的病理学特征,由大、多角形嗜酸性肿瘤细胞构成,呈梁索状或实性巢状排列,胞质呈嗜伊红性细颗粒状红染、部分透明样,胞浆、血窦丰富[9]。HAS 镜下常表达Hep Par-1、Glypican-3、SALL4、AFP、CK19、CDX-2 等免疫组化标志物,可辅助诊断和排除诊断。HAS 的病理组织通常表现为普通腺癌与肝样分化区共存。一般将仅含肝样分化区的HAS,定义为单纯型胃肝样腺癌(simple hepatoid ad-enocarcinoma of stomach,SHAS);将含有普通腺癌的HAS,定义为混合型胃肝样腺癌(mixed hepatoid adenocarcinoma of stomach,MHAS)[10]。
1.4 统计学方法
采用SPSS 20.0 统计软件分析,PD-L1 表达与临床病理特征的关系应用χ2检验、连续校正卡方检验和Fisher 精确检验,PD-L1 表达和各项临床病理特征与预后的关系采用单因素分析和多因素COX回归分析。生存数据采用Kaplan-Meier 法和Log-Rank 检验分析,并绘制生存曲线。P< 0.05 为差异有统计学意义。
2 结 果
2.1 HAS 癌组织、癌旁组织中PD-L1 的表达情况
HAS 组织PD-L1 阳性表达率明显高于癌旁组织(59.52%vs4.76%),且差异具有统计学意义(P< 0.01,表1)。

表1 PD-L1 在癌与癌旁组织中表达的差异Table 1.PD-L1 Expression in Cancer and Adjacent Tissues
2.2 MHAS 中肝样腺癌区与普通腺癌区的PD-L1表达差异
在42 例HAS 中,20 例为SHAS,22 例为MHAS。在22 例MHAS 中,肝样腺癌区与普通腺癌区同时表达PD-L1 占31.82%(7/22),肝样腺癌区PD-L1 阳性率为54.55%(12/22),而普通腺癌区中PD-L1 阳性率为40.91%(9/22),但两者的PD-L1 表达并无差异(χ2= 0.820,P= 0.365)。
2.3 HAS 中PD-L1 的表达与临床病理特征的关系
HAS 中PD-L1 过表达与淋巴结转移、脉管内癌栓显著相关(P< 0.05),而与患者年龄、性别、肿瘤直径、TNM 分期、分化程度、肿瘤浸润深度、肿瘤位置、神经侵犯和远处转移均无相关(P> 0.05,表2)。
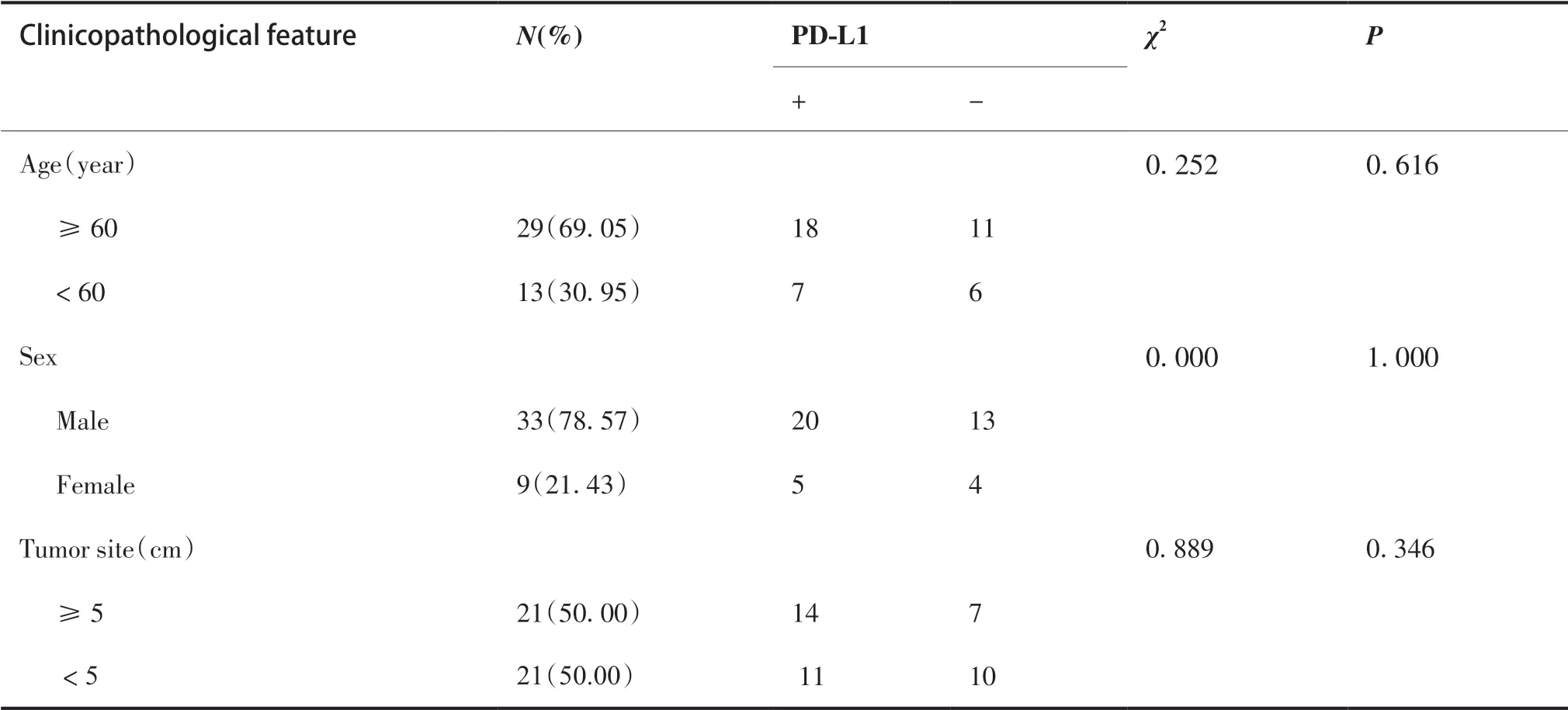
表2 胃肝样腺癌中PD-L1 表达与临床病理特征的关系Table 2.Relationship between PD-L1 Expression in and Clinicopathological Features of Hepatoid Adenocarcinoma of the Stomach
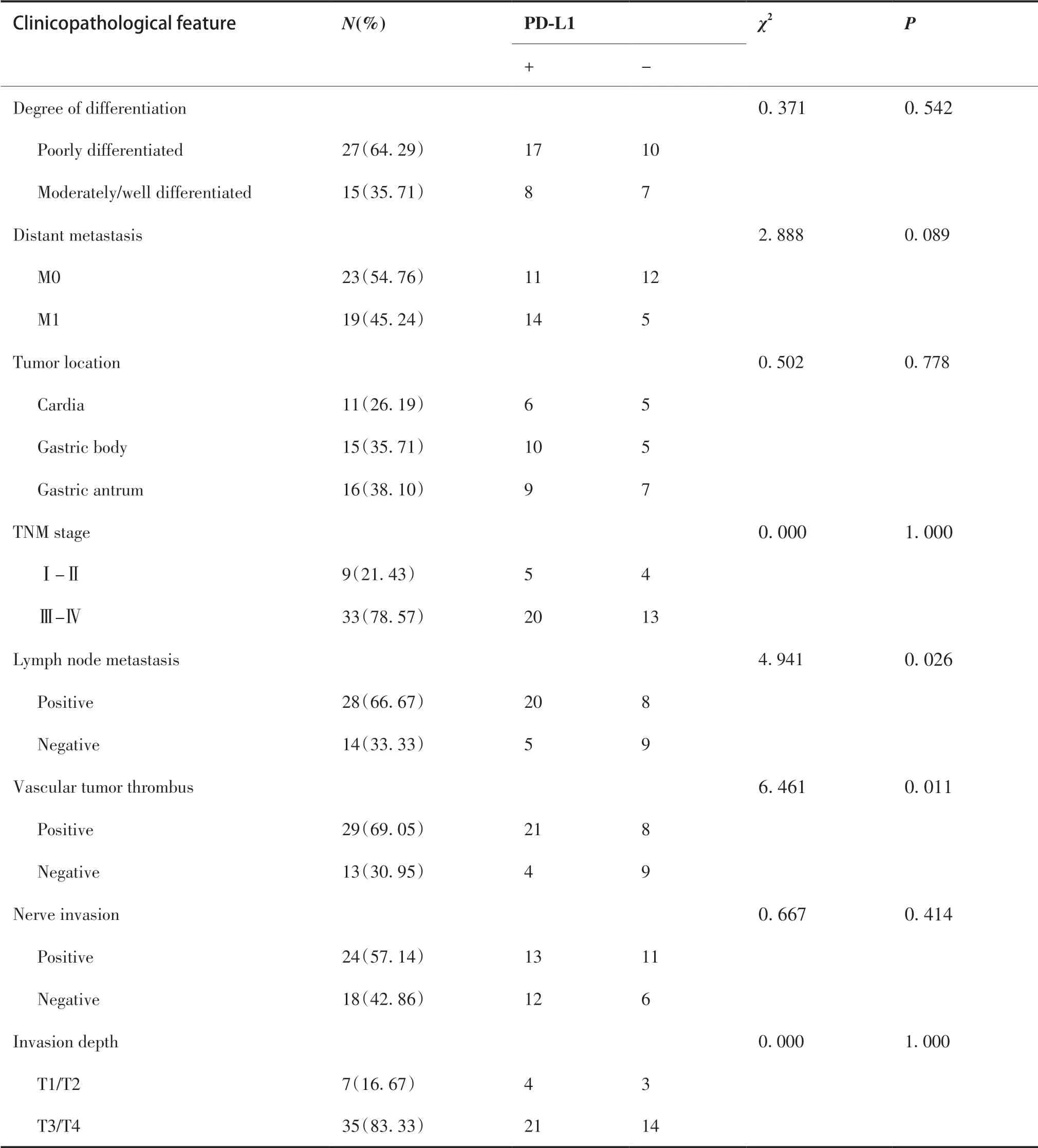
(Continued from previous page)
2.4 HAS 患者的预后情况
42 例患者随访截止时间2021 年10 月,随访5~56 个月,随访期间29 例患者死亡,平均生存期为26.9个月,中位生存期15 个月,1 年生存率为69.05%,3 年生存率为38.10%(图1)。根据Kaplan-Meier 生存曲线分析,PD-L1 过表达与HAS 患者OS 密切相关,即PD-L1 阳性者较阴性者术后生存时间明显缩短(χ2= 4.813,P= 0.028,图2)。
2.5 HAS 患者的生存分析
COX 单因素分析表明,年龄、远处转移、TNM 分期、淋巴结转移、脉管癌栓、AFP 染色、PD-L1 过表达是影响HAS 患者预后的不良因素(P< 0.05,表3);COX 多因素回归分析表明,术前有无远处转移、TNM 分期、AFP 染色是HAS 患者生存的独立影响因素(表4)。
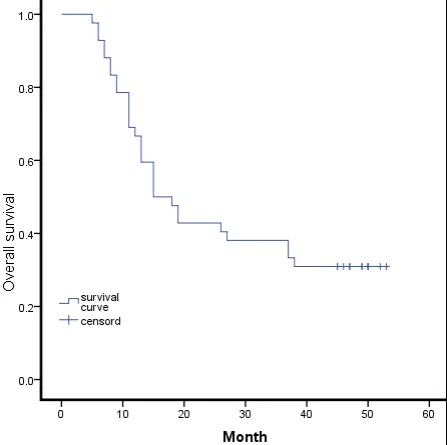
图1 HAS 患者生存曲线图Figure 1.Survival of HAS Patients
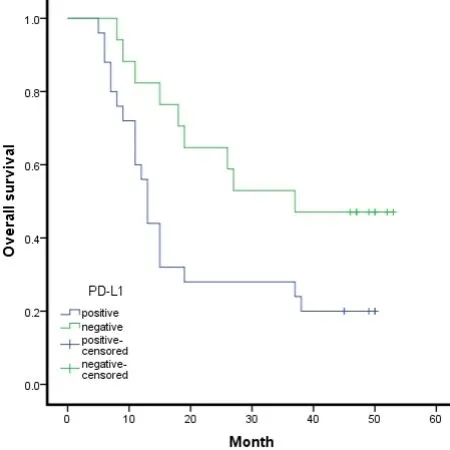
图2 PD-L1 阳性表达的HAS 患者生存曲线Figure 2.Survival of HAS Patients with Positive PD-L1 Expression
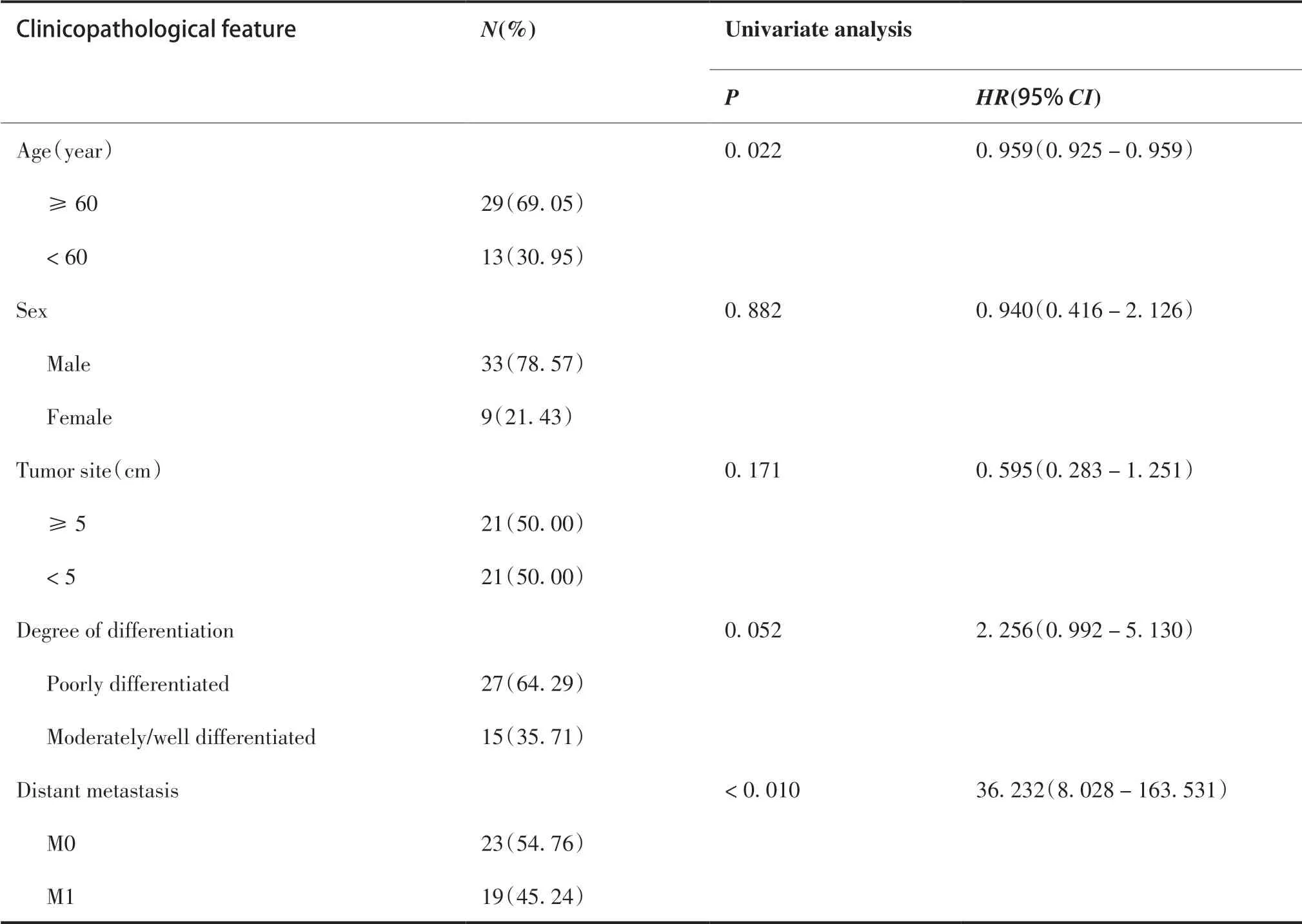
表3 胃肝样腺癌预后单因素分析Table 3.Univariate Analysis of the Prognosis of Hepatoid Adenocarcinoma of the Stomach
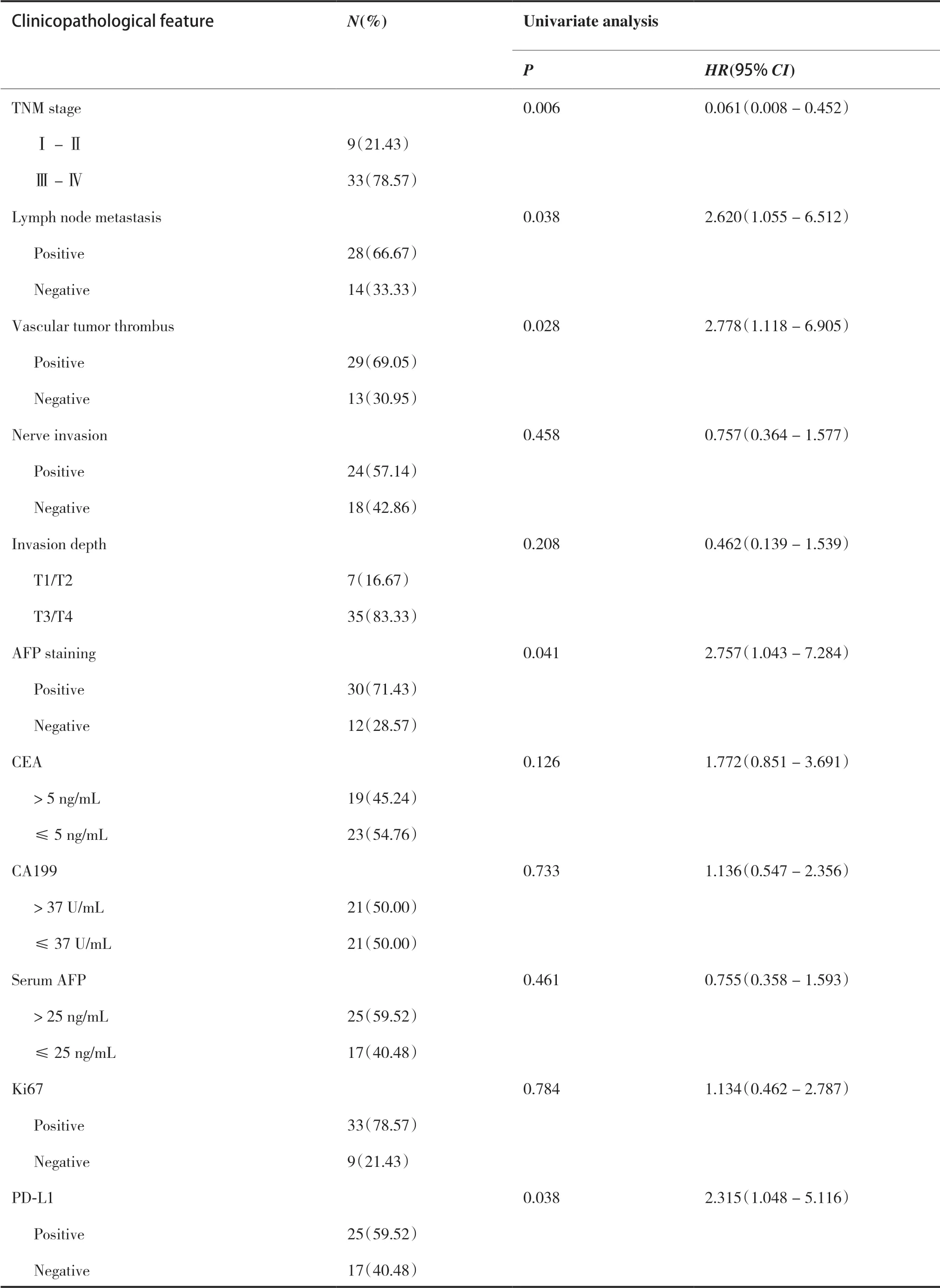
(Continued from previous page)

表4 胃肝样腺癌预后多因素分析Table 4.Multivariate Analysis of the Prognosis of Hepatoid Adenocarcinoma of the Stomach
3 讨 论
HAS 是胃癌的特殊亚型,发病率极低,早期易转移,预后差[10-12],既往研究表明HAS 中位生存期为6~17 个月[13],1 年、3 年、5 年生存率分别为30%~60%[14]、13%~52%[14-15]、9%~20%[16]。本研究HAS 中位生存期为15 个月,1 年、3 年生存率分别为69.05%和38.10%。如何早期准确诊断HAS至关重要,目前HAS 诊断金标准为病理组织学检测,但也有许多免疫标志物可协助诊断,如SALL4在成人正常胃组织及胃癌组织中不表达,在普通型胃癌中部分表达,而在HAS 中呈弥漫性表达[10]。Hep Par-1 是一种针对正常肝细胞和肿瘤肝细胞的单克隆抗体,被认为是正常肝细胞和肿瘤肝细胞的特异性标志物。CDX-2 在肠道肿瘤和伴有肠型上皮分化的肿瘤均表达阳性。CK19 在胃腺癌、胆管细胞癌和结直肠癌中阳性表达,在肝癌中较少表达,如果CK19阴性则可排除HAS,而CK19阳性可除外肝癌,这在HAS 肝转移时具有重要的诊断意义[17]。在我们的研究中42 例HAS 患者免疫组化显示胎肠标志物如AFP 染色阳性率为71.43%(30/42)、Glypican-3阳性率为67.65%(23/34)、SALL4 阳性率为68.75%(22/32)、CDX-2 阳 性 率 为65.71%(23/35)、CK19 阳性率为100.0%(35/35),肝细胞标志物Hep Par-1 阳性率为76.47%(26/34),以上免疫标记物在HAS 中广泛表达是协助诊断HAS 的灵敏指标。
研究表明肿瘤标记物(AFP、CEA、CA199 等)对HAS 的诊断有一定的辅助价值,且与患者的预后相关。既往研究表明肿瘤标记物CEA 升高预示HAS患者预后较差[16],但鲜有研究探讨其他肿瘤标记物对HAS 的预后价值。本研究结果显示AFP 阳性率为59.52%(25/42);CEA 阳性率为45.24%(19/42);CA199 阳 性 率 为50.00%(21/42),对AFP、CEA 和CA199 进行单因素分析发现三者对HAS 患者的预后均无影响(P> 0.05),由于本研究样本量较小,今后仍需大量研究探讨血清肿瘤标记物对HAS 患者的预后影响。我们还对可能影响HAS 患者预后的其他因素进行单因素分析发现,PD-L1 表达、年龄、淋巴结转移、TNM 分期、远处转移、AFP 染色、脉管癌栓是影响HAS 患者预后的不良因素(P< 0.05)。但进行多因素COX 回归分析发现PD-L1 表达、年龄、淋巴结转移、脉管癌栓并不是影响HAS 预后的独立影响因素,而AFP 染色、TNM 分期、远处转移为HAS 患者预后的独立影响因子(P< 0.05)。
PD-L1 是B7 共刺激分子家族的成员,与PD-1结合后,PD-1 胞质区的TISM 结构域中的酪氨酸发生磷酸化,募集SHP-2 磷酸酶,使Igα/β 和Syk发生去磷酸化,从而传递抑制性信号[18],这种信号对免疫细胞产生抑制作用,从而导致肿瘤细胞发生免疫逃逸和增殖。目前少有研究报道PD-L1 在HAS 中表达与临床病理特征的关系及对预后的影响。我们试图对42 例HAS 患者癌组织进行免疫组化检测,观察PD-L1 在HAS 中的表达水平,结果表明HAS 组织中PD-L1 的表达明显高于癌旁组织,且阳性率高达59.52%。而PD-L1 在普通胃腺癌和肝细胞癌中表达情况又如何呢?Wu 等[19]的研究表明340 例普通胃腺癌中PD-L1 的阳性率为40.3%,而李毓飞等[20]的研究表明胃癌中PD-L1的阳性率为37.3%,均低于HAS 中PD-L1 的表达水平;在肝细胞癌的有关研究中,PD-L1 阳性率在17% ~ 92.3%之间,差异较大,可能与样本量、染色技术、判定标准不同有关[21-23]。我们还对MHAS中肝样腺癌区与普通腺癌区的PD-L1 表达进行分析发现,MHAS 中肝样腺癌区与普通腺癌区共表达PD-L1 占31.82%,尽管肝样腺癌区PD-L1 的阳性表达率(54.55%)明显高于普通腺癌区(40.91%),但两者PD-L1 表达并无差异(P> 0.05)。进一步研究发现,HAS 中PD-L1 的阳性表达与淋巴结转移、脉管癌栓显著相关(P< 0.05)。王闫飞等[14]对30 例HAS 患者的病理资料进行分析,其中16例检测了PD-L1 的表达情况,发现PD-L1 的表达对HAS 患者的预后并无影响,我们对PD-L1 阳性 HAS 患者进行Kaplan-Meier 生存分析,发现PD-L1 过表达与HAS 患者生存期密切相关,PD-L1阳性者较阴性者生存期明显缩短(P< 0.05),这也证实PD-L1 在HAS 的进展中起着重要作用。PD-L1 阳性HAS 可能具有多种诱导PD-L1 表达的机制,并提示PD-1 驱动的免疫逃避可能在PD-L1阳性 HAS 中发挥重要作用,今后仍需大量研究进一步探讨。目前,HAS 治疗仍以手术与化疗为主的综合治疗模式,但HAS 的OS 却没有得到明显的改善。近年来,免疫检查点抑制剂在多种恶性肿瘤的治疗中取得良好效果[24]。2022 中国临床肿瘤学会胃癌诊疗指南中,我国已经将免疫治疗地位提升至一线并覆盖晚期胃癌全程治疗中,因PD-L1阳性HAS 患者的肿瘤微环境中也存在免疫抑制,故HAS 患者可能也是PD-L1/PD-1 抑制剂治疗的受益人群。早期检测HAS 中PD-L1 的表达情况对HAS 的治疗有一定指导意义,早期使用PD-1/PD-L1 抑制剂治疗PD-L1 阳性 HAS 患者可能会展现出更好的效果。
本研究尚存在一定的局限性。首先,由于部分病例存在随访时间的不足,故仅报道了3 年生存率的结果。其次由于本研究为回顾性研究,时间跨度长,有些临床病理数据缺失,可能对结果造成影响。最后本研究纳入的病例数较少,今后还需大量研究进一步探讨和验证结果。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

