真空包装冷鲜牛肉中生物保护菌的分离鉴定与生物学特性
杨慧轩,罗 欣,朱立贤,杨啸吟,韩广星,李 和,董鹏程,*,张一敏
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.国家肉牛牦牛产业技术体系临沂站,山东 临沂 276000;3.国家肉牛牦牛产业技术体系通辽站,内蒙古 通辽 028000)
随着居民生活水平、城市化进程的提高,我国冷鲜牛肉的消费逐渐成为主流,屠宰加工企业由冻肉向鲜肉转型趋势明显[1-2]。但是,由于冷鲜牛肉营养物质丰富、水分活度高,其在加工、销售过程中,腐败菌引起的资源浪费[3]以及食源性致病菌滋生(如沙门氏菌、单核细胞性李斯特菌和致病性大肠杆菌)引发的健康风险[4-6]是产业面临的严峻问题。研发能够替代传统化学抑菌剂的天然高效肉制品保鲜方式是市场的迫切需求。乳酸菌因其能够产生有机酸、细菌素及其他抑菌物质,是天然的减少肉品腐败、控制食源性病原体滋生的有益菌株,可作为生物保护菌而代替传统化学抑菌剂,具有良好的应用前景[7]。
乳酸菌如乳杆菌属(Lactobacillus)、肉食杆菌属(Carnobacterium)和乳球菌属(Lactococcus)等均可在肉品中占据优势,并抑制单核细胞性李斯特菌(Listeria monocytogenes)、肠炎沙门氏菌(Salmonella enteritidis)以及其他有害微生物的生长[8]。Chen Xue等[9]在真空包装牛肉的微生物多样性研究中发现,乳酸菌的菌群优势度是决定牛肉货架期的重要因素。此外,保护菌还能赋予肉品理想的感官特性,形成良好的风味。Nie Xiaohua等[10]发现接种乳酸菌的香肠内生成了高浓度的缬氨酸和亮氨酸,缬氨酸和亮氨酸和亮氨酸是风味化合物形成的前体。Slima等[11]发现益生菌的加入可以改善牛肉香肠组织结构,降低产品硬度。因此,筛选具有生物保护功能的乳酸菌,丰富适用于肉制品的生物保护菌菌种资源,对于发展多元化的防腐保鲜技术、提高生鲜肉制品生物安全水平具有重要意义。
真空包装是冷鲜牛肉的主要方式之一[12],乳酸菌较易在真空包装牛肉的菌群中占据优势[13],这为乳酸菌作为生物保护菌提供了应用前景。虽然大量乳酸菌被认为是“公认安全(generally regarded as safe,GARS)”[14],但仍有研究认为将具有抗生素抗性基因的乳酸菌作为保护菌使用,具有引发耐药性基因传播的风险[15],并且未经安全性检测的乳酸菌还可能存在编码激活溶细胞素和产生透明质酸酶等相关的毒力基因[16-18],对食品安全造成威胁。因此乳酸菌的安全性检测十分必要。
本研究以真空包装牛肉作为分离源,分离纯化优势乳酸菌,使用生理生化方法结合16S rDNA分子生物学方法对其进行鉴定,分析菌株的最适生长温度、生长和产酸能力、耐药性、毒力基因等生物学特性,并进一步通过琼脂扩散法研究了其抑菌性能,筛选安全可靠的生物保护菌株。旨在获得具有应用前景的乳酸菌,为生物保护菌的开发应用提供理论依据和菌株储备。
1 材料与方法
1.1 材料与试剂
牛背最长肌样品采自山东阳信亿利源清真肉类有限公司。
平板计数琼脂培养基、MRS培养基、MRS肉汤北京陆桥技术股份有限公司;生理生化鉴定管阿拉伯糖、纤维二糖、七叶灵、甘露醇、松三糖、蜜二糖、棉籽糖、水杨苷和海藻糖购自青岛海博生物技术有限公司,其余均购自北京陆桥技术股份有限公司;细菌DNA试剂盒、溶菌酶 康维世纪生物科技有限公司;Tris、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、Triton X-100、过氧化氢酶、革兰氏染色液试剂盒、抗生素 北京索莱宝科技有限公司;2×AccurateTaqMaster Mix(dye plus) 艾科瑞生物工程有限公司;蛋白酶K 美国Merck公司;通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGYTACCTTGTTACGACTT-3')以及毒力基因引物均由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
SPX智能型生化培养箱 宁波江南仪器厂;SW-CJ-1CU 洁净工作台 苏州安泰空气技术有限公司;MQT-60R振荡培养箱 上海旻泉仪器有限公司;BAGMIXER 400均质拍打器 法国Interscience公司;BX41TF生物显微镜 日本Olympus公司;T100TMThermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Epoch2酶标仪美国BioTek公司。
1.3 方法
1.3.1 乳酸菌分离
参照Mcsharry等[19]研究中乳酸菌菌群变化趋势,牛肉样品被无菌切分为牛排后立即真空包装并于室温放置48 h后取样,从牛肉表面收集10 g样品置于拍打袋中,加入90 mL无菌生理盐水,随后用均质拍打器拍打2 min。 拍打液经生理盐水梯度稀释后取100 μL稀释液于MRS+2% CaCO3培养基上涂板,37 ℃培养48 h后观察结果。选择具有明显溶钙圈并且符合乳酸菌菌落形态的单菌落进行纯化培养,挑取单菌落进行革兰氏染色观察菌体形态,之后选取目标菌株接种至MRS肉汤中。参照Sabo等[20]研究结果,为使菌体大量富集,在摇床内于37 ℃、220 r/min条件下培养18~24 h,富集后的菌液转移至30%甘油冻存管中于-80 ℃冰箱中保存备用。
1.3.2 生理生化鉴定
参照文献[21]中乳酸菌生理生化反应对分离菌株进行鉴定。
1.3.3 16S rDNA分子生物学鉴定
使用细菌DNA提取试剂盒获取待测菌株DNA,用16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGYTACCTTGTTACGACTT-3')作为上下游引物进行PCR扩增。PCR体系(50 μL):2×AccurateTaqMaster Mix(dye plus)25 μL,模板2 μL,引物27F 2 μL,引物1492R 2 μL,RNase free water补至终体积50 μL;PCR扩增条件:第1阶段:95 ℃预变性3 min;第2阶段:95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;第3阶段:72 ℃延伸2 min。PCR扩增产物经琼脂糖凝胶电泳检测DNA浓度后,送往生工生物工程(上海)股份有限公司进行DNA序列测定。
1.3.4 最适生长温度的测定
将活化3 代并生长至对数期的新鲜菌液按2%接种比例接种到MRS肉汤中,为测定不同温度条件对分离菌株生长的影响,将菌液在4、20、25、30、35、40 ℃培养24 h后用酶标仪测定光密度值(OD600nm)。
1.3.5 生长产酸能力测定
参照潘晓倩等[22]方法,活化3次的乳酸菌按2%的接种比例转接至MRS肉汤中,于摇床培养,摇床条件设置为30 ℃、200 r/min。前18 h每2 h取样测定菌液光密度值(OD600nm)以及pH值,18 h后每6 h取样测定,每个时间点设置3次平行。
1.3.6 耐药性测定
参照Maragkoudakis等[23-24]方法,选择四环素、庆大霉素、青霉素、链霉素、氨苄青霉素、卡那霉素和红霉素进行乳酸菌的耐药性测试。将乳酸菌菌液(1%,V/V)接种至含有抗生素(2、4、8、16、32、64、128、256、512、1 024 μg/mL)的MRS肉汤中,混匀后转移至96 孔板内,37 ℃培养24 h后用酶标仪测定OD600nm并判断菌株对抗生素的敏感性,其结果通过最小抑菌浓度(minimum inhibitory concentration,MIC)(μg/mL)表示,耐药性标准参照欧洲食品安全局耐药折点水平[25]。
1.3.7 毒力基因测定

表1 毒力基因筛选引物Table 1 Primers used for screening of virulence factor genes

续表1
利用上述引物(表1)对乳酸菌分离株的毒力基因进行检测。PCR扩增条件参照Hossain等[26]方法,具体条件如下:94 ℃预变性1 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,35个循环,72 ℃最终延伸7 min,4 ℃保存。扩增产物最后经2%琼脂糖凝胶电泳检测片段大小,使用10 000 bp的标记物作为分子质量测定标准。
1.3.8 分离菌株抑菌性测定
1.3.8.1 分离菌株发酵液制备
参考Zoumpopoulou等[27]方法,使用分离菌株的发酵液用于研究其在体外对抗病原菌的拮抗活性。将分离菌株在MRS肉汤培养基中过夜培养,之后将培养基液体4 ℃、8 000 r/min离心20 min,然后通过微孔滤膜(0.22 μm)过滤以收集无细胞发酵液。
1.3.8.2 分离菌株抑菌性测定
为测定分离菌株对致病菌的拮抗能力,采用琼脂扩散法评估分离菌株的抗菌活性,并选择标准菌株鼠伤寒沙门氏菌ATCC 14028、单核细胞性李斯特菌1/2a血清型CMCC 54004、单核细胞性李斯特菌4b血清型ATCC 19115、大肠杆菌O157:H7 S2和金黄色葡萄球菌ATCC 25923作为指示菌。具体实验步骤如下:在无菌培养皿中先倾倒15 mL胰蛋白胨大豆琼脂,待其凝固后,再覆盖5 mL含有1 g/100 mL琼脂粉和6(lg(CFU/mL))指示菌的胰蛋白胨大豆肉汤。然后将牛津杯(d=8 mm)插入双层平板中,并在孔内注入240 μL无细胞发酵液。在37 ℃培养18~24 h后测量每个抑制圈的直径,每组平行测定6次。
1.3.9 分离菌株抗菌物质的确定
为进一步探究分离菌株的抗菌物质,参照Zoumpopoulou[27]和Salehizadeh[28]等方法,分别采用2 mg/mL蛋白酶K、0.5 mg/mL过氧化氢酶和1 mol/L NaOH作为抑制剂处理发酵液,以检测乳酸菌抑菌性是否来源于蛋白质类代谢产物、H2O2或有机酸。通过观察抑菌圈的直径减少范围显示抑制剂的抑制作用。排除实验均在双层平板上等距放置8 mm直径牛津杯,孔内分别填充240 μL乳酸菌发酵液和经排除实验处理的发酵液,指示菌浓度设置为5(lg(CFU/mL)),平皿覆盖陶瓦盖后于37 ℃培养24 h后观察抑菌圈,每组设置6个平行。
1.4 数据处理
菌株序列应用BLAST程序,在GenBank基因数据库中比对测序结果,最终的数据集使用MEGA X进行分析并绘制系统发育树,非加权组平均法进行聚类分析,以序列间差异数值作为单位长度。最适生长温度和抑菌性测定相关指标采用双因素方差分析,使用IBM SPSS Statistics 26软件的一般线性模型中单变量,选用最小显著性差异法对双因素的主效应进行多重比较,并以F检验判断双因素交互作用的显著性(P<0.05,交互显著)。结果使用SigmaPlot 14.0软件作图,并以表示。
2 结果与分析
2.1 乳酸菌的分离与筛选
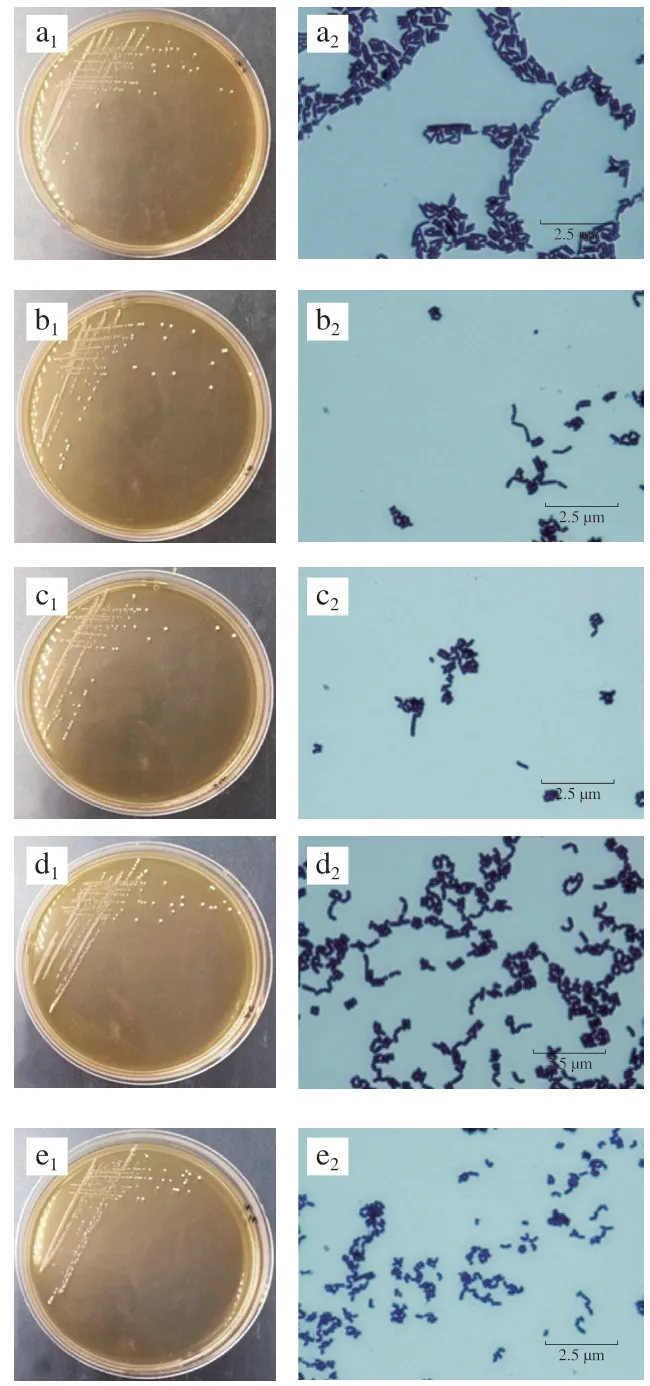
图1 分离菌株的菌落和菌体形态特征Fig. 1 Colonial and morphological characteristics of isolated strains
研究从MRS+2% CaCO3共筛选分离得到43 株疑似菌株,经纯化后选出7 株活化性能好、具有明显溶钙圈、革兰氏阳性、具备乳酸菌菌落和菌体形态特征以及接触酶阴性的备选菌株作为研究对象。其编号分别为RS-13、RS-16、RS-24、RS-25、RS-32、RS-33和RS-41。研究通过对分离菌株的菌落形态和菌体形态(图1)观察可知,7 株分离菌株菌落形态均为圆形、白色菌落,菌落大小均为2 mm以上,且质地柔软边缘整齐,轻微隆起但不透明,均具备乳酸菌菌落特征。本研究中7 株分离菌株形态均为杆状,成对排列,其中RS-41杆状较为细长,上述分离株菌体形态具有一般乳杆菌属的形态特征。
2.2 分离菌株的生化鉴定
由表2可知,7 株分离菌株均与标准菌株清酒乳杆菌清酒亚种(Lactobacillus sakeisubsp.sakei)BNCC185970的鉴定结果一致。该结果与沈雷[29]和Tsafrakidou[30]等对清酒乳杆菌的生理生化鉴定结果一致,均未对甘露醇、棉籽糖、松三糖、鼠李糖、山梨醇、木糖反应呈阳性。根据上述结果初步判断7 株分离菌株具备清酒乳杆菌生理生化特征。
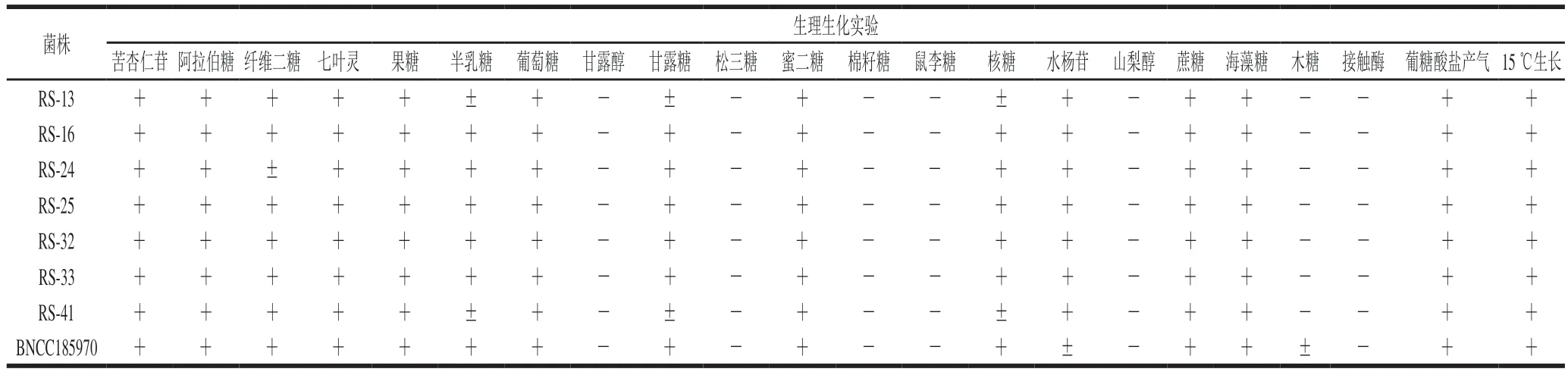
表2 分离菌株的鉴定Table 2 Biochemical identification of the isolates
2.3 分离菌株的16S rDNA 分子生物学鉴定
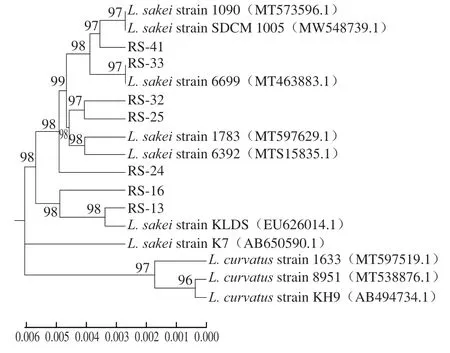
图2 分离菌株16S rDNA序列系统发育树Fig. 2 Phylogenetic tree based on 16S rDNA sequences of the isolates
将分离菌株经16S rDNA测序,均得到长度约为1 500 bp的序列,采用系统发育树方法,通过进化距离对乳酸菌进行种水平鉴定,最终分析结果如图2所示。本研究分离菌株与BLAST平台上清酒乳杆菌标准菌株的同源性均在99.8%以上,序列分析表明,分离菌株序列均与清酒乳杆菌序列聚类,并结合生理生化鉴定结果可基本判定7 株分离菌株为清酒乳杆菌。
2.4 分离菌株的最适生长温度和产酸能力
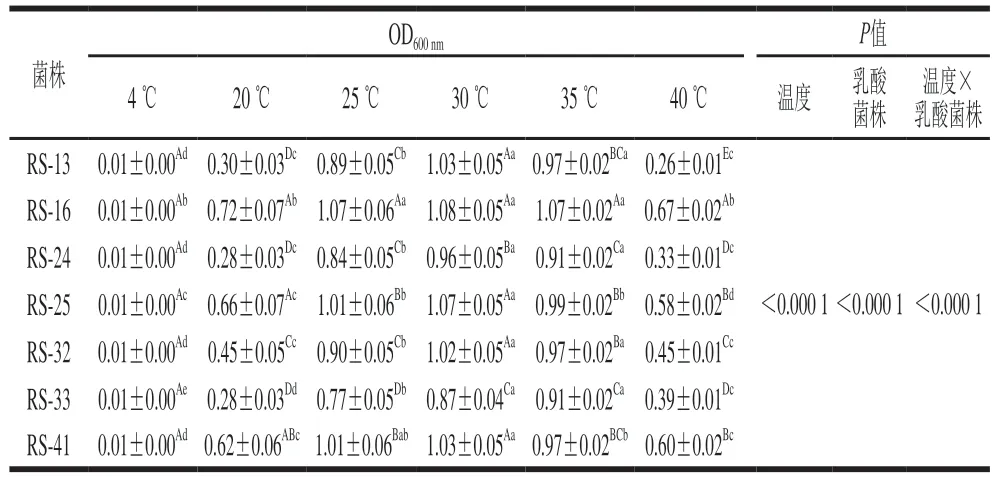
表3 分离菌株最适生长温度Table 3 Optimum growth temperatures of the isolates
由表3可知,乳酸菌株和温度双因素交互显著(P<0.05),7 株分离乳酸菌在25~35 ℃之间均能较好生长,在20 ℃以下或40 ℃以上时生长能力均受到不同程度抑制。7 株乳酸菌在不同生长温度下的生长能力具有显著差异,其中菌株RS-16和RS-25在所有温度下均具有较好的生长能力。
根据7 株分离株的最适生长温度结果,本研究在30 ℃条件下继续探究了分离株的生长和产酸能力,结果如图3所示。分离菌株生长迟滞期较短为0~4 h,在此间生长速度和产酸速度均较为缓慢,4~14 h期间为分离株的生长对数期,菌株快速生长并且大量生产有机酸,菌株活性在期间最强,培养基pH值显著下降,14 h后达到对数末期,菌株生长速度逐渐减缓,进入生长稳定期,同时pH值趋于稳定。本研究分离的菌株在生长和产酸趋势与潘晓倩[22]及赵改名[31]等研究一致。在本研究中,不同菌株生长时期所持续的时间基本一致,但最终积累的细胞数量不同。菌株的生长能力与产酸能力相关,其中相同时间内RS-16和RS-25富集的菌量较多,其产酸能力也较强,可将pH值降至4.2左右,而生长能力相对较弱的RS-33仅能将pH值降至5左右,在所分离的7 株菌中,有6 株可将培养基pH值降低到4.6以下,大部分菌株均具有较强的产酸能力。
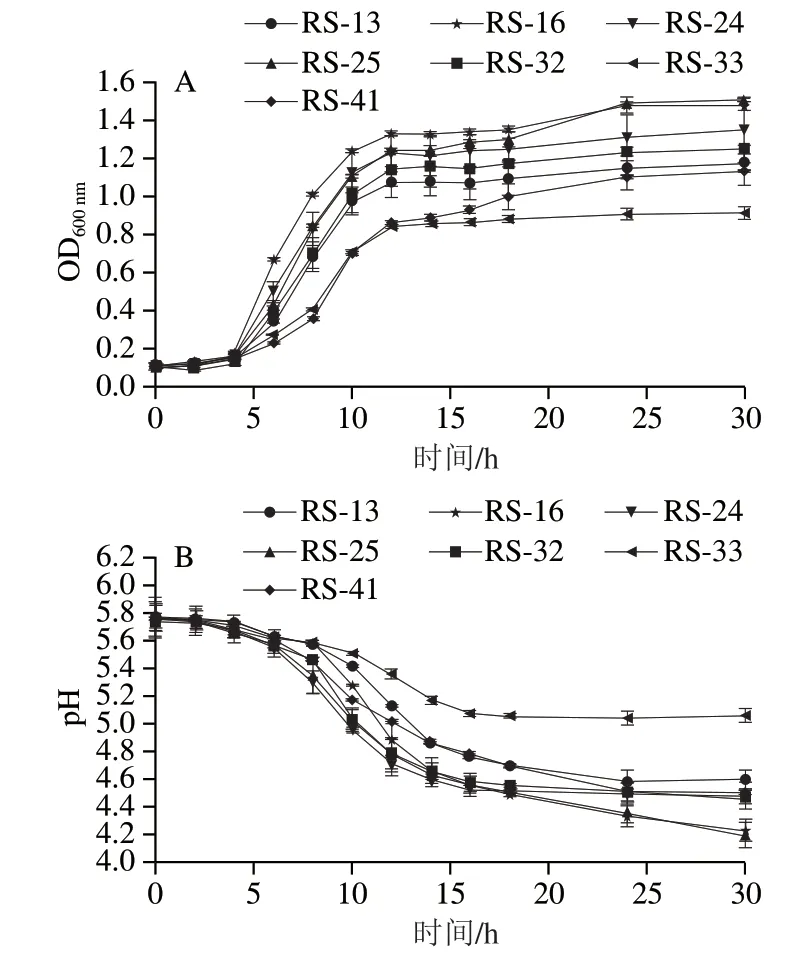
图3 分离菌株生长曲线(A)和产酸曲线(B)Fig. 3 Growth curves (A) and acid-producing curves (B) of the isolates
2.5 分离菌株的耐药性和毒力基因分析
耐药性和耐药基因的传递是威胁公共卫生安全的重要因子,因此该指标对生物保护菌的评价具有重要意义。分离菌株的MIC值及毒力基因检测结果如表4所示。本研究分离的乳酸菌株对临床重要的抗生素普遍敏感,而RS-41则表现出了对于红霉素和庆大霉素的抗性,该结果与Maragkoudakis等[24]研究一致,该研究使用肉汤稀释法对肉制品和乳制品中分离出的10 株具有潜在生物保护功能的乳酸菌进行了耐药分析,存在部分菌株对红霉素和庆大霉素产生抗性。部分乳酸菌不能合成细胞色素的基本成分血红素卟啉,因此缺乏细胞色素介导的电子转运系统(与氨基糖苷类抗生素的摄取相关)[32],导致其对氨基糖苷类抗生素(如庆大霉素)耐药[33]。由于该固有耐药性没有在细菌间传递的风险,这种“耐药”的乳酸菌通常用于防止抗生素使用条件下的菌群失调,其与抗生素的联合使用可以预防和治疗肠道感染[15,34]。相反,同属于乳酸菌的肠球菌由于其编码四环素、红霉素和氯霉素的Tn916-Tn1545家族转座子被报道可以通过偶联转移到其他革兰氏阳性菌中[35],其作为生物保护菌的使用受到了限制。Hummel等[36]发现许多用于肉类发酵的乳酸菌,除对庆大霉素外,同时存对环丙沙星、链霉素、氨苄西林、氯霉素、青霉素G、四环素和红霉素的耐药菌株。乳酸菌的耐药性由于菌株之间的差异会有所不同,如多药转运蛋白、细胞壁自溶系统缺陷以及耐药基因的存在都可能导致了菌株之间的差异[35]。与此同时,培养基中的成分也会影响到耐药性的评估,例如在含有胆汁的培养基中乳酸杆菌对氨基糖苷类抗生素会更敏感[36],因此,在比较、分析不同报道耐药性时应明确测定方法、培养条件等。
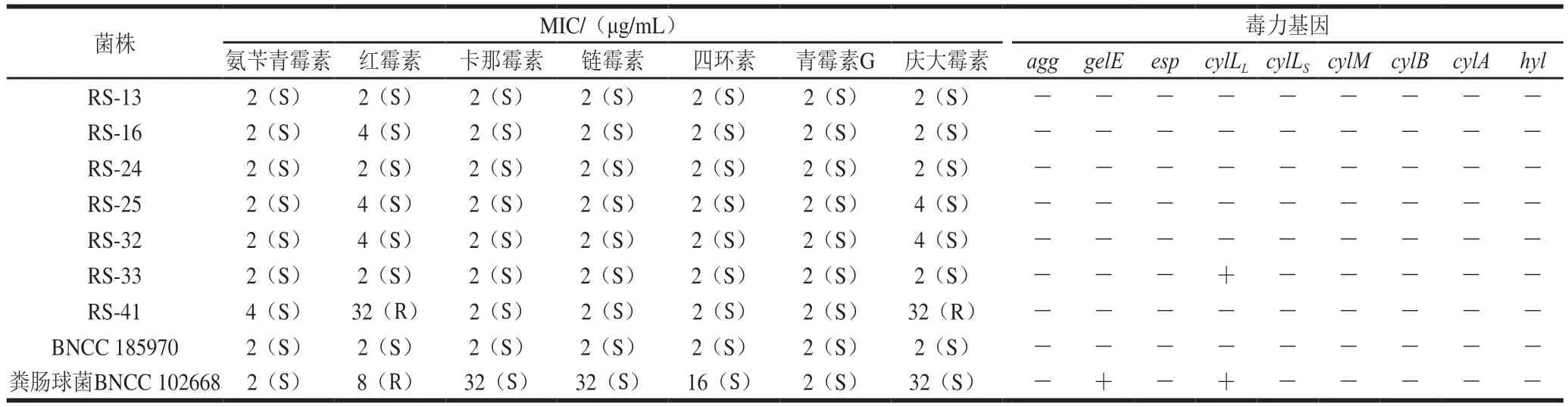
表4 各抗生素对分离菌株的MIC和毒力基因检测Table 4 MIC of antibiotics against the isolates and their virulence genes
大部分离菌株均未检测出表1中常见的毒力基因,而RS-33则检测具有cylLL基因,该基因与cylLS共同编码溶细胞素的2个结构亚基,与溶细胞素的表达、成熟、分泌和激活相关。值得注意的是,由于细菌致病性的产生需要多个系统协同运作(如沙门氏菌毒力岛),个别存在的毒力基因并非与致病性必然有关,例如聚集蛋白相关的agg和参与免疫逃避相关的esp等基因则与肠道定植有关,反而有助于其发挥益生作用[37-38]。本研究中除RS-41表现出耐药性以及RS-33检测具有cylLL基因以外,其他菌株均未表现出耐药性或发现毒力基因存在,可作为生物保护菌备选菌株。另外,我国已出台了在食品中应用乳酸菌的安全性指导原则,如国家总局2020年发布的《保健食品原料用菌种安全性检验与评价技术指导原则》。但是目前生物保护菌的概念还相对模糊,根据乳酸菌不同用途所进行的安全性检验仍需细致划分,与乳酸菌相关的致病机理需要进一步探讨,为乳酸菌安全性评价提供理论依据。
2.6 分离菌株的抑菌性
以大肠杆菌O157:H7、单核细胞性李斯特菌、沙门氏菌和金黄色葡萄球菌作为指示菌株,测定7 株分离菌株的抑菌效果,结果显示乳酸菌菌株和指示菌株双因素交互显著(P<0.05)(表5)。由表5可知,7 株分离菌株对所有指示菌产生的抑菌圈直径均大于8 mm,均产生拮抗作用,但不同菌株对不同指示菌的拮抗效果有较大差异:分离菌株对沙门氏菌抑菌效果最好(P<0.05),其次为大肠杆菌O157:H7,最后为单核细胞性李斯特菌和金黄色葡萄球菌。这可能是因为不同的指示菌对与乳酸菌的代谢物质耐受能力、亚致死的环境胁迫(例如酸胁迫)下的应激反应不同[39]。Salah等[40]研究发现金黄色葡萄球菌比其他指示菌对乳酸菌代谢产物具有更强的耐受力。Cattaneo等[41]研究结果也显示金黄色葡萄球菌在所有指示菌株中的拮抗效果不显著,测试的所有乳酸菌对金黄色葡萄球菌表现出的抑菌效果均无统计学意义。与较强的生产、产酸能力对应,在不同分离菌株中,RS-16和RS-25对其抑制效果最好(P<0.05)。鉴于以上结果,本研究以鼠伤寒沙门氏菌为指示菌,进一步分析了RS-16和RS-25的主要抑菌产物。由表6可知,分离菌株发酵液经蛋白酶K、H2O2酶处理后产生的抑菌圈范围与对照组无显著差异(P>0.05),而经NaOH处理后,菌株抑菌圈完全消失,证明菌株抑菌性来源于有机酸。同时验证了“分离菌株对于鼠伤寒沙门氏菌抑制效果较好,而单核细胞性李斯特菌和金黄色葡萄球菌的抑制效果则相对较差的研究结果”:在单核细胞性李斯特菌中存在的谷氨酸脱羧酶系统[42]以及金黄色葡萄球菌的转录起始因子(σB)[43]会促进其耐酸性,进而降低乳酸菌代谢产物对其的抑菌效果。与大肠杆菌、单核细胞性李斯特菌相比,鼠伤寒沙门氏菌缺乏谷氨酸耐酸代谢系统,因此耐酸性存在一定缺陷[44]。大量相关研究发现乳酸菌产生的有机酸(尤其是乳酸和乙酸)对广泛的微生物具有抑制作用,其可造成较低的pH值环境,并且,有机酸分子之间还存在协同作用,例如乳酸造成的酸化有利于乙酸非解离形式的存在,从而增强抗菌活性[45]。此外,除有机酸以外,乳酸菌可能存在其他多种抑菌途径(如产生胞外多糖、细菌素,营养竞争抑制等),其抑菌机制仍需全面探究与验证。
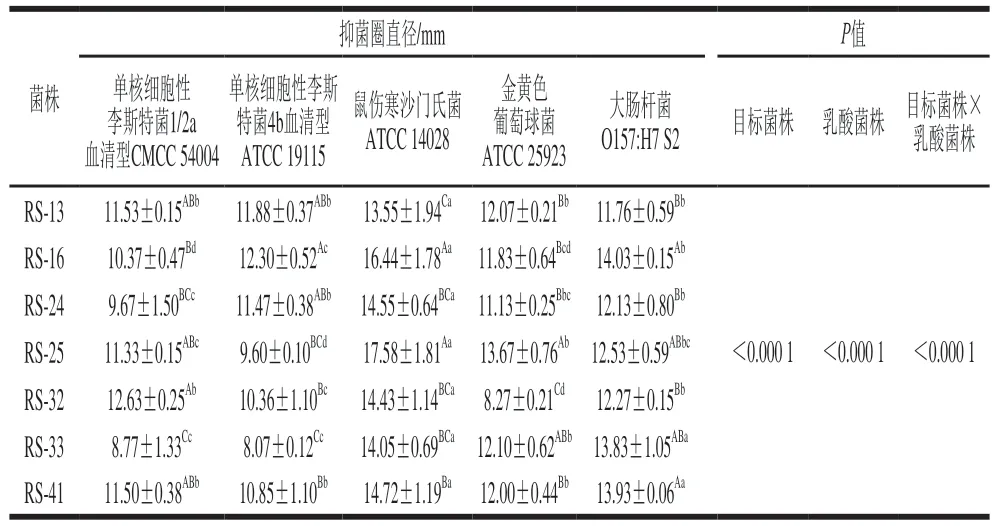
表5 分离菌株对致病菌的抑菌效果Table 5 Antibacterial effect of the isolated strains on pathogenic bacteria

表6 排除各假定抗菌物质对菌株抑菌能力的影响Table 6 Influence of protease, catalase or alkaline treatment on the antibacterial ability of the selected strains
3 结 论
可作为生物保护菌的乳酸菌分离源极为广泛,但以牛肉源作为分离源的研究在相关研究领域鲜有报道,并且真空包装是生鲜牛肉普遍的包装方式,具有良好的应用前景。本研究对真空包装牛肉中具有生物保护功能的乳酸菌进行分离筛选,共得到7 株具有生物保护潜力的菌株。经形态学观察、生理生化鉴定、16S rDNA分子生物学鉴定后,7 株乳酸菌均可鉴定为清酒乳杆菌。由最适生长温度、生长产酸能力结果可知RS-25和RS-16具有较好的生长产酸能力,为其发挥生物效果提供了前提条件。通过细菌耐药性测试和毒力基因检测发现除菌株RS-41对红霉素和庆大霉素产生抗性,以及菌株RS-33发现存在cylLL基因外,其他菌株均未检出耐药性和毒力基因。虽然对不同目标菌属的拮抗程度不同,但7 株分离菌株对所有目标指示菌的拮抗均有显著效果。其中RS-25和RS-16对鼠伤寒沙门氏菌的抑制效果最好。进一步的抑菌物质测定实验证实了有机酸是分离出生物保护菌的重要抑菌物质之一,但是所筛选的保护菌株代谢产生的有机酸是否会造成牛肉酸败、具体应用方法,亟待进一步的接种实验进行验证。本研究表明真空包装牛肉可作为生物保护菌良好的分离源,其中分离得到的清酒乳杆菌RS-25和RS-16具有良好的生物保护潜力,为生物保护菌的开发应用提供了菌株储备和理论依据。

