磷脂强化乳脂肪体系对易氧化营养素包埋稳定性的影响
陈 晨,王霁月,陆乃彦,2,*,杜 琳
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学 合成与生物胶体教育部重点实验室,江苏 无锡 214122;3.国家市场监督管理总局信息中心,北京 100820)
目前销售的乳粉以母乳为黄金标准,在蛋白质比例、营养素添加等方面尽可能的接近人乳,是替代母乳和补充营养的良好选择[1]。因此,国内对于乳粉的研究主要集中于模拟母乳的基料组成和比例[2-3]、结构脂质[4-5]、特殊生物活性成分[6]等问题。在乳粉的加工工艺中,目前市售乳粉使用最多的原料乳是牛乳。首先要对原料乳进行机械剪切加工(包括高压均质、微射流、超声等),该处理使乳液体系中的分散物微粒化、均匀化,从而维持体系的物理稳定性[7-9]。但在剪切和高湍流的破裂力将脂肪球机械碎成更细的脂肪球过程中,乳脂肪球膜(milk fat globule,MFG)的结构遭到破坏。因此,市售大部分的乳粉复溶后呈现乳粉加工过程中磷脂球膜的结构严重破坏,其极性脂质均未形成膜状结构[10]的现象。
本实验优选营养强化剂中的鱼油,其富含ω-3多不饱和脂肪酸,利于婴儿大脑发育和视网膜形成[11];VE作为一种脂溶性天然抗氧化剂,可确保婴幼儿免疫系统的正常发育;胡萝卜素为VA的前体,它对婴儿免受胃肠道和呼吸道感染具有重要的保护作用[12],但这些易氧化营养素的含量在天然乳和乳粉中受加工方式、乳源产地、泌乳情况等诸多因素限制[13]。本实验利用包埋和脂基载体技术模拟母乳脂肪球膜结构,在牛乳均质时添加卵磷脂制备磷脂强化的均质乳,磷脂自组装覆盖到均质后的牛乳脂肪球表面,构造磷脂双亲分子保护层进一步增强体系物理稳定性,同时研究分析MFG中包埋鱼油的磷脂强化乳的贮藏氧化稳定性,以及VE和β-胡萝卜的贮藏保存率。为后续探究模拟天然乳脂肪球结构和包埋脂溶性的营养强化剂的保护方法提供依据,也为开发营养强化乳提供工艺技术支撑。
1 材料与方法
1.1 材料与试剂
食品级液体鱼油(提取自天然深海鱼类,含二十二碳六烯酸(docosahexaenoic acid,DHA)28.7%,含二十碳五烯酸(eicosapentaenoic acid,EPA)42.8%) 陕西刘嘉辉生物科技有限公司;DL-α-生育酚(纯度≥96%)、β-胡萝卜素(纯度≥97%) 合肥博美生物科技有限责任公司;尼罗红 美国Sigma-Aldrich公司;尼罗蓝、DL-α-生育酚乙酸酯(纯度≥96%,HPLC级)、2,6-二叔丁基对甲酚(GC级)、正己烷(HPLC级)上海阿拉丁生化科技股份有限公司;MDA试剂盒南京建成生物工程研究所;多聚赖氨酸玻片 南通鎏盛实验器材有限公司;正己烷、二氯甲烷、无水乙醇、甲醇、乙腈等色谱用试剂为国产色谱纯,其余化学试剂为国产分析纯。
1.2 仪器与设备
1525EF高效液相色谱仪 美国Waters公司;Zetasizer Nano ZS电位仪 英国Malvern公司;S3500激光粒度分析仪 美国Microtrac公司;LSM 710激光共聚焦显微镜 德国蔡司公司;电子天平 美国Mettler Toledo公司;MP-501A超级恒温槽 上海一恒科学仪器有限公司;JHG-Q54-P100高压均质机 上海普丽胜机械有限公司;T10高速分散机 德国IKA公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 高不饱和脂肪酸的包埋样品制备
样品O:在600 mL牛乳中添加质量分数1%富含EPA和DHA的鱼油,于53 ℃预热后,使用高速分散机以6 300 r/min预混合1 min,随后使用两级均质机在20 MPa条件下进行均质,得到无磷脂保护的乳脂肪球包埋的鱼油样品[14-15]。
样品OP:在添加鱼油的同时加入质量分数0.5%卵磷脂,得到同时加油和磷脂的乳脂肪球包埋鱼油样品[14-15]。
样品PO:改变外源性磷脂添加方式,首先在牛乳中添加质量分数0.5%外源性磷脂,在上述条件下对体系进行均质,待系统稳定后再次加入质量分数1%的鱼油,二次均质后得到加工顺序为先加磷脂后加鱼油的乳脂肪球包埋鱼油对照样品[14-15]。
1.3.1.2 VE包埋样品制备
样品E:在600 mL牛乳中加入质量分数0.25%VE[16],于53 ℃预热后,使用高速分散机以6 300 r/min预混合1 min,随后使用两级均质机在20 MPa条件下进行均质,得到乳脂肪球包埋VE样品。
样品EP:在添加VE的同时加入质量分数0.5%卵磷脂,得到磷脂强化乳脂肪球包埋VE的乳液样品。
1.3.1.3β-胡萝卜素包埋样品制备
样品C:在600 mL牛乳中加入0.021 gβ-胡萝卜素粉末,添加量相当于占乳中油相质量分数的0.1%[17-18],于53 ℃预热后,使用高速分散机以6 300 r/min预混合1 min,随后使用两级均质机中在20 MPa条件下进行均质,得到乳脂肪球包埋β-胡萝卜素样品。
样品CP:在添加β-胡萝卜素的同时加入质量分数0.5%卵磷脂,得到磷脂强化乳脂肪球包埋β-胡萝卜素的乳液样品。
1.3.2 微观结构观察
1 mL乳液样品使用10 μL尼罗红(1 mg/mL溶于丙酮)和200 μL尼罗蓝(210 μg/mL溶于乙醇)双染[19],染色样品在室温下避光30 min。然后,取10 μL样本置于多聚赖氨酸玻片上,盖上盖玻片。
采用激光共聚焦显微镜观察样品,所用的尼罗红荧光探针由标准配备氩离子Ar激光器激发,激发波长为514 nm;尼罗蓝由He-Ne激光器激发,激发波长为633 nm。发射光接收范围为500~740 nm,针孔为90.2,增益值为700~800,均用×63油镜进行观察,扫描范围为512 nm×512 nm。
1.3.3 粒度测定
粒度测定基于多源激光衍射法,约0.2 mL乳稀释到100 mL水中,再加入1 mL 35 mmol/L EDTA(NaOH调至pH 7.0)缓冲液裂解乳中的酪蛋白胶束。乳脂肪球在波长466 nm和633 nm处的折射率分别为1.460和1.458。粒径结果用D3,2(体积-表面积平均直径)和D4,3(质量-体积平均直径),以及Dm(多数直径)表示[6],并按下式计算:

式中:ni为直径为di的脂肪球总数量。
1.3.4 Zeta电位测定
使用电位仪测量牛奶样品的Zeta电位。样品用超纯水稀释500 倍。测量温度为20 ℃,对每个样品进行12次读数。
1.3.5 过氧化值和丙二醛(malonic dialdehyde,MDA)测定
使用密封玻璃瓶对样品进行分装保存,于50 ℃恒温烘箱中静置,检测加速贮藏过程中的氧化情况。在第0、1、4、8、12天取出样品进行氧化程度检测。初级氧化检测使用油脂氢过氧化物含量检测,次级氧化检测使用MDA测试[20-21]。其中MDA测试使用试剂盒标准方法进行测定,氢过氧化物测定方法如下[20-22]:
溶剂一:将异辛烷和异丙醇按照3∶1(V/V)混合;溶剂二:将甲醇和丁醇按照2∶1(V/V)混合。取0.4 mL样品,加入1.5 mL溶剂一并充分振摇后,在3 400×g离心2 min。取上层有机相0.2 mL,加入2.8 mL溶剂二混匀。加入15 μL 0.3 g/mL硫氰酸铵和15 μL亚铁离子溶液(0.264 mol/L氯化钡和0.288 mol/L硫酸亚铁混合后离心),室温下反应20 min,之后于510 nm波长处测量吸光度。用过氧化氢做标准曲线计算样品中的过氧化值。
1.3.6 VE的定量测定
使用密封玻璃瓶对样品进行分装保存,之后于50 ℃恒温烘箱中静置,检测加速贮藏过程中的氧化情况。在第0、1、3、7、12天取出样品进行保护效果检测,以剩余VE浓度为评价标准。采用液液萃取的方法提取乳状液中的VE,然后通过高效液相色谱法测定其含量[23]。步骤如下:吸取1 mL乳液样品,加入1 mL 8 mmol/L VE乙酸酯的无水乙醇溶液,涡旋15 s混匀。然后,加入4 mL正己烷,高速剪切90 s(10 000 r/min),于4 ℃、3 500×g离心5 min,吸取上层清液1 mL至离心管,氮气吹干,加入2 mL甲醇涡旋30 s并静置40 min重新溶解,过0.45 μm有机膜进行高效液相色谱上样分析。色谱条件:C18色谱柱(4.6 mm×250 mm,5 μm);流动相为100%甲醇;流速为1 mL/min;紫外检测波长292 nm;进样量10 μL。其中,VE乙酸酯作为内标对VE定量。VE色谱图见图1。
图1 VE的高效液相色谱图Fig. 1 HPLC chromatogram of vitamin E
1.3.7β-胡萝卜素的定量测定
使用密封玻璃瓶对样品进行分装保存,之后于50 ℃恒温烘箱中静置,检测加速贮藏过程中的氧化情况。在第0、1、3、7、12天取出样品进行保护效果检测,以剩余β-胡萝卜素浓度为评价标准。乳液中的β-胡萝卜素通过有机溶剂萃取法进行提取,其含量使用高效液相色谱法测定[17-18]。取1 mL乳液样品于离心管中,加入1 mL DMSO振荡破乳,再加入3 mL正己烷,旋涡振荡30 s后放入离心机中,在10 000×g离心5 min。待离心结束后取出上层清液,定容至10 mL棕色容量瓶中,即可萃取出β-胡萝卜素。
使用高效液相色谱对萃取的β-胡萝卜素进行定量。使用C30反相分析柱(250 mm×4.6 mm,5 μm)。
检测条件为:进样量20 μL;检测波长450 nm;柱温箱25 ℃;控制样品室温度5 ℃;流动相A相为甲醇-乙腈-水(84∶14∶2,V/V),B相为二氯甲烷;流动相流速设置为1.0 mL/min。梯度洗脱程序设置如下:流动相A和流动性B的比例为80∶20,在15 min内将流动相B梯度上升至55%,保持5 min;然后在5 min内将流动相B梯度下降为20%,最后在此比例下再洗涤5 min。
利用高效液相色谱测定β-胡萝卜素的含量,首先根据GB 5009.83—2016《食品中胡萝卜素的测定》绘制β-胡萝卜素标准曲线,线性结果表明β-胡萝卜素浓度与峰面积呈良好的线性关系,R2=0.999,其回归方程为y=1.523x-0.163。
1.4 统计分析
所有测定至少重复3次。采用SPSS 20.0对结果进行统计学处理,根据单因素方差分析法比较分析数据的显著性差异(P<0.05)。所有数据均以表示。
2 结果与分析
2.1 乳脂肪球对高不饱和脂肪酸的包埋和保护
2.1.1 高不饱和脂肪酸包埋样品的微观结构
在前期模拟母乳的奶粉乳液研究中,发现通过添加大豆卵磷脂可制备富含磷脂的均质乳,保护其乳脂肪球膜结构,可提高乳液体系的物理稳定性[24]。通过该脂类运载系统,可以将富含EPA和DHA等脂溶性营养素的鱼油装载到乳状液滴中,制备出高不饱和脂肪酸包埋样品。
如图2所示,中性脂质被尼罗红标记为红色,蛋白质被尼罗蓝标记为绿色。无磷脂保护的样品O中油滴略有聚集,分散不均匀,油滴表面形成了蛋白包被的结构;相比之下,添加磷脂保护的样品OP和样品PO中油滴形状规则完好,蛋白质和油脂标记重合的现象较少。样品OP有更多的蛋白质分散于水相中,水油两亲性体系中的磷脂作为生物膜重要的两亲物质将会更多吸附于球膜,在油滴表面的蛋白质吸附较少;样品PO水相中蛋白质较少,球膜表面的蛋白质吸附就会更多,相对球膜上的磷脂少。

图2 包埋样品的微观结构Fig. 2 Microstructures of different encapsulated samples
2.1.2 高不饱和脂肪酸包埋样品的粒径分布和Zeta电位
样品O、OP和PO中油滴的体积平均粒径分别为(0.44±0.00)、(0.40±0.00)、(0.39±0.01)μm,其乳脂肪球的典型粒径体积分布如图3所示。对比样品O,添加磷脂的样品OP和PO能够使粒径减小,是由于磷脂具有双亲性[23],当油滴颗粒被分散,尺寸减小时,磷脂分子的非极性头基可能会吸附在油滴表面,形成高稳定性的磷脂包被鱼油/乳脂肪小液滴。样品OP和样品PO的鱼油添加顺序不同,样品PO粒径分布范围大于样品OP,样品PO中较大直径(0.8 μm)附近的油滴占比相较于样品OP有所增加,而小粒径(<0.4 μm)的部分也分布更为广泛。这可能是PO在第1次均质中磷脂已经和乳脂肪球重组为较为稳定的新乳脂肪球,这些小粒径的新乳脂肪球更难在二次均质中重新打开并包埋鱼油油滴。结果表明了外源磷脂的添加能使体系中的脂滴形成更小的颗粒,提高乳液的稳定性[25-26]。

图3 不同方式包埋鱼油样品的典型粒径体积分布Fig. 3 Typical particle size distribution curves for different encapsulated fish oil samples in terms of volume percentage

表1 不同方式包埋鱼油样品的Zeta电位值Table 1 Zeta potential values of different encapsulated fish oil samples
水包油型乳状液的稳定性与Zeta电位绝对值有关,Zeta电位绝对值越大,乳液越趋于稳定[27]。如表1所示,生鲜牛乳灭酶后的Zeta电位为(-9.61±0.03)mV,样品O的Zeta电位为(-12.33±0.21) mV,当鱼油加入牛乳中均质时,鱼油和乳脂肪球均质为小颗粒油滴,表面积大大增加,牛乳在均质后乳脂肪球表面电位绝对值增加。对于有外源卵磷脂保护的样品OP的Zeta电位为(-14.53±0.17) mV,电位绝对值明显大于PO(-13.87±0.12)mV,可能是由于油滴外层包被的磷脂具有比水相蛋白在油水界面具有较高的电性,强静电斥力可抑制乳滴之间发生接触和碰撞而产生的聚集和絮凝现象[28-29]。此外,样品PO在第1次均质时产生的小粒径磷脂包被乳脂肪球难以在第2次均质时参与破碎重组,且使用的油相DHA和EPA链长大于14,油相的极性较弱且分子体积较大,较难从水中渗透到胶束内部,难以形成微乳结构[30]。因此导致样品PO中没有足够的磷脂包埋新加入的鱼油油滴,形成的膜层中仍有部分水相蛋白,造成样品OP形成的磷脂包埋效果强于样品PO。
2.1.3 高不饱和脂肪酸包埋样品的贮藏氧化稳定性
如图4所示,在O、OP、PO三组样品加速贮存1 d后,均观察到脂质过氧化物浓度增加,这可能是由于氢过氧化物在油脂氧化的初期阶段(链增长阶段)的不稳定分解造成的。而OP中过氧化产物增加较小,这表明OP中磷脂包膜的结构有一定的抗氧化作用。随着贮藏放置时间的延长,氢过氧化物会进一步分解为醛酮醇等小分子次级产物,氢过氧化物的产生与分解达到一种动态的平衡,氢过氧化物值趋于稳定[31]。在贮藏期实验的后期(2~12 d),O、OP、PO三组样品的脂质氢过氧化物浓度分别从(3.57±0.00)mmol/mL下降至(2.81±0.26)mmol/mL,从(3.06±0.00)mmol/mL下降至(1.28±0.26)mmol/mL(P<0.05),从(2.29±0.26)mmol/mL下降至(1.79±0.26)mmol/mL(P>0.05)。在贮藏第2天,样品PO氢过氧化物含量明显低于样品O(P<0.05),且贮藏后期第12天,样品OP氢过氧化物含量明显低于样品O(P<0.05)。随着贮藏时间的延长,样品OP和样品PO的氢过氧化产物含量明显低于样品O,这表明添加的外源磷脂对初级氧化有抑制效果。

图4 贮藏过程中不同方式包埋鱼油样品的脂质氢过氧化物含量Fig. 4 Lipid hydroperoxide content of encapsulated fish oil samples during storage

图5 贮藏过程中不同方式包埋鱼油样品的MDA含量Fig. 5 MDA content of encapsulated fish oil samples during storage
如图5所示,在贮藏期实验期(0~12 d),样品O中的MDA浓度显著升高(第0、1、4、8、12天),从(2.86±0.29)nmol/mL显著增长至(15.87±0.16)nmol/mL(P<0.05)。样品OP中的MDA浓度从(2.71±0.43)nmol/mL(第0天)显著增长至(5.17±0.08)nmol/mL(第2天),在贮藏第4天达到稳定,在贮藏12 d后缓慢下降至(4.29±0.16) nmol/mL(P>0.05)。样品PO中的MDA浓度从(3±0.14)nmol/mL(第0天)显著增长至(7.12±0.17)nmol/mL(第2天),同样在第4天后维持在较低水平上下波动,在贮藏12 d后缓慢下降至(6.64±0.18)nmol/mL(P>0.05)。对比样品PO,样品OP的MDA含量降低(第2、8、12天),尤其在贮藏实验的后期(第8、12天),样品OP的制备工艺相比于样品PO能够制备出更优质的磷脂保护膜层,将氧化维持在较低水平,有更好的贮藏氧化稳定性。次级氧化生成的醛和其他产物的形成会造成产品中的异味,外源性磷脂的添加不仅可以减缓体系中的高不饱和脂肪酸的次级氧化进程,将氧化维持在较低水平,还能够减少产品氧化酸败产生的异味,保护感官品质。
2.2 乳脂肪球对VE的包埋和保护
2.2.1 VE包埋样品的粒径和Zeta电位
根据2.1节外源磷脂强化乳包埋鱼油添加顺序的实验结论,优选了外源磷脂和易氧化营养素同时加入的工艺方法,进一步表征外源磷脂强化乳脂肪体系在贮藏过程中VE和β-胡萝卜素的包埋保护作用,并对比有无外源磷脂添加的效果差异。

表2 VE包埋样品的液滴粒径和Zeta电位Table 2 Droplet sizes and zeta potentials of encapsulated vitamin E samples
如表2所示,样品E和样品EP体系中油滴的体积平均粒径分别为(0.44±0.01)μm和(0.42±0.00)μm,样品EP中包埋VE的油滴粒径更小。表2结果显示样品EP的Zeta电位为(-13.83±0.40)mV,电位绝对值显著大于样品E的(-12.47±0.17)mV。由于外源性磷脂具有双亲性[25],磷脂分子的非极性头基吸附在油滴表面,样品EP的球膜表面形成电性更高的保护膜层,形成高稳定性的磷脂包被VE/乳脂肪小液滴。
2.2.2 VE包埋样品中VE的贮藏稳定性
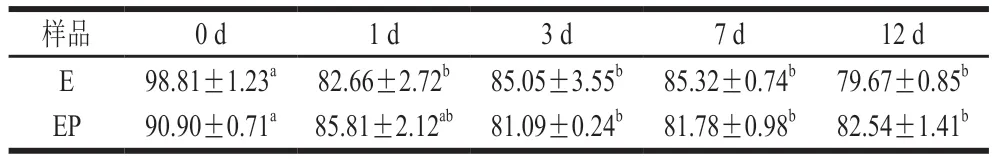
表3 贮藏过程中不同包埋样品中VE含量Table 3 Stability of encapsulated VE during storage μmol/L
如表3所示,样品E加速贮藏1 d后,VE浓度从(98.81±1.23) μmol/L显著降至(82.66±2.72) μmol/L(P<0.05),在贮藏12 d后下降至79.67±0.85 μmol/L。EP样品样品加速贮藏3 d后,VE浓度从(90.90±0.71)μmol/L显著下降至(81.09±0.24)μmol/L,在贮藏实验的后期(第7、12天),VE含量下降不显著(P>0.05)。

图6 贮藏过程中不同包埋样品的VE保存率Fig. 6 Preservation rate of encapsulated vitamin E during storage
如图6所示,在贮藏的第1天样品E和样品EP的VE保存率分别下降至(83.66±3.29)%和(94.39±2.47)%,在贮藏12 d后,样品E和样品EP的VE保存率分别下降至(80.63±1.06)%和(90.80±1.71)%,样品EP VE保存率明显高于样品E(P<0.05)。总体而言,样品E中VE的氧化损失更大,这可能是由于高稳定性的磷脂包被VE/乳脂肪小液滴可以有效抵御外来环境因素的影响,同时对VE含量和活性有一定的保护作用[16],可提高实验乳液体系对VE的包埋稳定性。O/W型乳液体系中磷脂和生育酚有一定的协同作用,含有氨基的磷脂(如磷脂酰乙醇胺和磷脂酰丝氨酸)能够将氧化的生育酚也能转化回生育酚[32]。
2.3 乳脂肪球对β-胡萝卜素的包埋和保护
2.3.1β-胡萝卜素包埋样品的粒径和Zeta电位

表4 β-胡萝卜素包埋样品的液滴粒径和Zeta电位Table 4 Droplet sizes and zeta-potentials of encapsulated β-carotene samples
如表4所示,样品C和样品CP体系中油滴的体积平均粒径分别为(0.37±0.01)μm和(0.28±0.00)μm,CP的油滴粒径更小。样品CP的Zeta电位为(-13.53±0.40) mV,电位绝对值显著大于样品C(-12.37±0.33)mV,其稳定性更好。
2.3.2 包埋样品中β-胡萝卜素的贮藏稳定性
如表5所示,在贮存期实验期(0~12 d),样品C中的β-胡萝卜素质量浓度从(174.59±1.64)ng/mL显著下降至(112.67±1.20) ng/mL(P<0.05),而样品C中的β-胡萝卜素质量浓度从(157.91±3.35)ng/mL(第0天)显著下降至(121.60±3.17)ng/mL(第3天),缓慢下降至(112.15±2.87)ng/mL(第12天)。

表5 贮藏过程中不同包埋样品的β-胡萝卜素含量Table 5 Stability of encapsulated β-carotene samples during storage

图7 贮藏过程中不同包埋样品的β-胡萝卜素的保存率Fig. 7 Preservation rate of encapsulated β-carotene samples during storage
如图7所示,在贮藏期实验的后期(2~12 d),样品C和样品CP的β-胡萝卜素保存率(相对于第0天)持续下降,样品CP的β-胡萝卜素含量保存率均高于样品C。在贮藏期实验的12 d,样品CP的β-胡萝卜素含量保存率下降至(71.02±2.56)%,显著高于样品C的β-胡萝卜素含量保存率(64.54±1.06)%(P<0.05)。以卵磷脂为乳化剂制备的以油脂为载体的β-胡萝卜素乳液,外源磷脂的添加能使乳液中油滴界面膜更加致密,减缓乳液的氧化进程,降低β-胡萝卜素的降解程度[34]。
3 结 论
通过添加外源性磷脂(卵磷脂)来自组装牛乳均质后的乳脂肪球表面的磷脂层,包埋易氧化的鱼油、VE和β-胡萝卜素等营养素,进一步提升提升磷脂强化乳脂肪体系的功能性及应用价值。总体来看,包埋外加的卵磷脂可形成直径更小、表面电位绝对值更大和物理性质更稳定的磷脂强化乳液,在加速贮藏过程中可抑制油脂的初级氧化和减缓次级氧化的程度。相比较而言,磷脂和鱼油同时加入的工艺包埋方法优于鱼油后加的包埋方法,该工艺方法形成了更致密的油滴界面膜,可提高乳液体系对VE和β-胡萝卜素的包埋稳定性,降低VE和β-胡萝卜素在贮藏期间的降解程度[33]。本实验探索了制备磷脂强化乳脂肪体系的制备工艺及其包埋的脂溶性营养素的抗氧化研究,为未来新型配方乳粉的研发提供了重要的理论依据,但对于外源性磷脂在包埋体系中保护脂溶性营养素在分子水平上的机理有待进一步证实。

