外源蛋白对大豆油脂体稳定性的影响
刘子豪,梅雅欣,彭 郁,傅 娆,秦琛强,倪元颖,温 馨
(中国农业大学食品科学与营养工程学院,北京 100083)
油脂体也被称为油体或脂质体,是植物储存油脂的细胞器[1-2],其核心基质为甘油三酯,在其周围覆盖着一层混合性保护膜——油脂体膜,由磷脂单分子层与嵌入其中的油脂体蛋白组成[3]。油脂体蛋白包括油体蛋白、油体钙蛋白及油体固醇蛋白,其分子质量分别为14~17、24~28 kDa和35~60 kDa[2]。通过水提法提取油脂体能较好地保持其天然结构,并以水包油乳液形式稳定存在,相比于使用传统的高度精炼植物油结合额外的乳化剂和均质步骤制备乳液,天然油脂体在乳液相关应用方面具有广阔前景[4]。
天然油脂体的稳定性主要由其独特的膜结构决定。Yang Nan等[5]利用原子力显微镜对大豆、芝麻和花生油脂体的机械性能进行分析,发现油脂体是一种柔性液滴,在对其施加的压缩应变高达0.3时亦能很快恢复。Nikiforidis等[6]研究发现玉米胚芽油脂体在长时间贮藏过程中较为稳定,不易聚集。但在油脂体作为食品配料的应用过程中,不同的加工处理条件会使油脂体稳定性受到一定影响[7]。Iwanaga等[8]研究发现大豆油脂体在相对较低的盐浓度(≤25 mmol/L)或pH值远离等电点时较为稳定,不易聚集和分层,而在高盐浓度或pH值位于等电点(pH 4)附近时稳定性较差;在热处理(30~90 ℃)条件下较为稳定,但当温度超过60 ℃时,Zeta电位降低,界面特性发生改变。
水提法提取油脂体时,研磨和浸泡过程会使种子中一部分贮藏蛋白附着在油脂体外,形成油脂体膜以外的第2层蛋白膜[7]。这些外源蛋白与油脂体膜相互作用,可能会对油脂体的稳定性和界面性质产生正面或负面影响。Nikiforidis等[9]对玉米胚芽油脂体的研究表明,有外源蛋白附着的油脂体在贮藏过程中具有更好的物理稳定性。大豆蛋白含量较高,且部分大豆蛋白具有两亲性,在油脂体的提取中容易附着在油脂体膜上,从而对大豆油脂体的稳定性造成影响。Ishii等[10]通过对比富含外源蛋白的大豆粗油脂体(crude oil bodies,COB)与不含外源蛋白的纯油脂体(purified oil bodies,POB)的界面和乳化特性发现外源蛋白赋予COB更高的电位,但却使其更容易聚集。然而,在食品加工中常见的酸碱、盐和热处理等因素对大豆COB和POB稳定性的影响仍然未知。因此,本研究以大豆为原料,探究外源蛋白对大豆油脂体稳定性的影响,以期为提高天然油脂体在加工中的稳定性提供研究思路。
1 材料与方法
1.1 材料与试剂
大豆(垦丰十六)采自黑龙江省巴彦县;氢氧化钠、盐酸、硫酸和氯化钠(均为分析纯) 国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris)、四甲基乙二胺(N,N,N',N'-tetramethylethylenediamine,TEMED)、丙烯酰胺、蛋白上样缓冲液、电泳蛋白标品北京索莱宝生物科技有限公司。
1.2 仪器与设备
TGL-16C高速冷冻离心机 上海安亭科学仪器厂;FE-500DE pH计 瑞士梅特勒-托利多集团;Mastersizer 2000激光粒度仪、Zetasizer Nano ZS电位分析仪 英国马尔文仪器有限公司;LUMI Fuge全功能稳定性分析仪德国LUM GmbH公司;DYY-6C电泳仪 北京六一仪器厂;Mini-PROTEAN Tetra Cell电泳槽 美国Bio-Rad公司;HR2095破碎机 飞利浦电子香港有限公司;SE206脂肪测定仪、KN520自动凯氏定氮仪器、SPH620消解仪济南阿尔瓦仪器有限公司;DSH-50A-1水分测定仪 上海佑科仪器仪表有限公司;DHR-2旋转流变仪 美国TA Instruments公司。
1.3 方法
1.3.1 大豆COB和POB的提取
参照Chen Yeming等[11]的方法并加以改进。称取60 g大豆,按1∶7(g/mL)比例在去离子水中4 ℃浸泡18 h,使用破碎机最大挡位破碎90 s,三层纱布过滤后获得滤液。将滤液于离心机中4 ℃、10 000×g离心30 min后用药匙分离上层悬浮乳膏于烧杯中。按1∶5(g/mL)比例加入去离子水洗涤乳膏,重复洗涤后4 ℃、10 000×g离心30 min,离心两次,收集上层悬浮乳膏即为COB。
参照Chen Yeming等[11]的方法并加以改进。称取60 g大豆,按1∶7(g/mL)比例在去离子水中4 ℃浸泡18 h,使用破碎机最大挡位破碎90 s,三层纱布过滤后获得滤液。使用0.1 mol/L NaOH溶液调节滤液至pH 11后于离心机中4 ℃、10 000×g离心30 min。用药匙分离上层悬浮乳膏于烧杯中,按1∶5(g/mL)比例加入去离子水,使用0.1 mol/L NaOH溶液调节乳膏悬浮液至pH 11,重复洗涤后4 ℃、10 000×g离心30 min,离心两次,收集上层悬浮乳膏即为POB。
1.3.2 油脂体组分分析
1.3.2.1 含水率测定
精确称取1.00 g新鲜油脂体于水分测定仪中,设定烘干温度105 ℃,持续烘干至质量不再变化,记录含水率,实验重复3次。
1.3.2.2 脂肪含量测定
将烘干的油脂体置于剪裁好的脱脂滤纸中封口,将滤纸放入索氏提取器中,设定恒温循环器温度8 ℃,索氏提取器温度60 ℃,提取试剂为石油醚,索氏抽提5 h。提取完成后室温冷却,取出并转移至蒸馏烧瓶进行旋蒸,测定旋蒸前后质量差计算脂肪含量,实验重复3次。
1.3.2.3 蛋白含量测定
精确称取0.25 g烘干的油脂体于消化管中,加入6 g硝酸钾、0.4 g硫酸铜和8 mL浓硫酸,于消解仪420 ℃消解1 h。消化管冷却至室温后于自动凯氏定氮仪中进行测定,使用标定过的盐酸溶液进行滴定至溶液变为灰绿色,记录滴定所用盐酸体积,实验重复3次。按下式计算蛋白质含量(X):
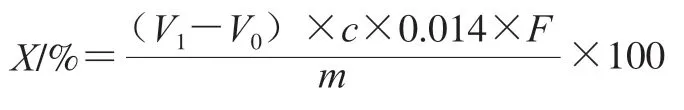
式中:V1为盐酸消耗体积/mL;V0为空白盐酸消耗体积/mL;c为盐酸浓度/(mol/L);F为大豆蛋白系数6.25;m为样品质量/g。
1.3.2.4 蛋白组成分析
使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析蛋白组成。分别用去离子水稀释新鲜制备的COB和POB为质量分数10%的乳液,分别加入30 μL乳液与10 μL含β-巯基乙醇的蛋白上样缓冲液,95 ℃加热5 min,冷却后离心。采用5%浓缩胶和15%分离胶,取10 μL样品上清液,设置恒压80 V,待溴酚蓝前沿道分离胶时,改变电压为110 V进行电泳至溴酚蓝到达玻璃板底部。电泳完成后,将凝胶于快速染色液中染色并脱色至电泳条带清晰,背景脱色干净后用凝胶成像系统成像,使用ImageJ软件分析结果。
1.3.3 油脂体乳液粒径和Zeta电位测定
参照Iwanaga等[8]的方法,将新鲜制备的COB和POB分别用去离子水稀释100 倍,持续搅拌30 min,使用激光粒度仪测定乳液粒径,设定分散相折射率为1.47,连续相折射率为1.33,得到粒径分布图,并计算平均粒径(D4,3)。使用电位分析仪测定乳液Zeta电位。
1.3.4 油脂体乳液物理稳定性测定
使用全功能稳定性分析仪测定油脂体乳液在加速离心过程中乳液透光率动态变化,获得澄清指数-时间变化曲线。将新鲜制备的COB和POB分别用去离子水稀释100 倍,搅拌均匀后准确加至LUMi离心管的刻度线,设置温度25 ℃,转速3 000 r/min,间隔10 s,循环360次进行测定。
1.3.5 油脂体乳液稳定性观察
将新鲜制备的COB和POB分别用去离子水稀释100 倍,取9 mL于玻璃试管中,观察油脂体乳液状态并采集图像。
1.3.6 油脂体流变学特性测定
1.3.6.1 静态流变学特性测定
使用旋转流变仪进行分析。选用40 mm不锈钢椎板夹具,设置Flow Ramp模式,在测定温度25 ℃,平衡时间30 s,间距1 050 μm,剪切速率1~100 s-1,测定时间60 s条件下,测定黏度/剪切速率曲线,实验重复3次。
1.3.6.2 动态流变学特性测定
采用TA型流变仪的平板夹具进行测定。在25 ℃、角频率1~100 rad/s、应变1%条件下,对各样品进行频率扫描,从而得到样品的弹性模量(G')、黏性模量(G″)和损耗角正切值(tanδ),实验重复3次。
1.3.7 不同环境因素对大豆油脂体乳液稳定性的影响
1.3.7.1 pH值的影响
将制备的COB和POB分别稀释3 倍制成油脂体乳液,分成9 份,分别加入到pH 3、4、5、6、7、8、9、10、11的缓冲溶液中,测定油脂体乳液的粒径和Zeta电位[8,11]。
1.3.7.2 离子强度的影响
参照Iwanaga等[8]的方法,将制备的COB和POB分别用0、10、25、50、100、250 mmol/L NaCl溶液稀释100 倍,静置1 h后测定油脂体乳液的粒径和Zeta电位。
1.3.7.3 温度的影响
将制备的COB和POB分别稀释100 倍,分成8 份,置于恒温水浴锅内,使中心温度分别达到30、40、50、60、70、80、90、100 ℃后保持加热30 min,然后迅速冷却至室温后测定油脂体乳液的粒径和Zeta电位。
1.4 数据处理
利用SPSS Statistics 21.0软件对数据进行方差分析(P<0.05,差异显著),采用Origin Pro 2019软件绘图。
2 结果与分析
2.1 大豆COB和POB组分分析
如表1所示,COB含水率更高,这可能是由于油脂体表面附着的较厚的蛋白质层在离心期间阻碍了油脂体的进一步聚集和浓缩,从而使其较POB保留了更多的水分。与POB相比,COB较POB具有更高的蛋白含量,这表明部分大豆蛋白附着在油脂体表面,随油脂体被共同提取。

表1 大豆COB和POB组分Table 1 Major components of soybean COB and POB
由图1可知,大豆POB蛋白由明显的3 条条带组成,24、17 kDa和16 kDa,均为大豆油体蛋白,而大豆COB除含有以上油体蛋白外还含有多种外源蛋白,主要是大豆球蛋白和β-伴大豆球蛋白的亚基,以及一些过敏蛋白。油体蛋白具有延伸的中心疏水结构域,根据分子模型,其形成两个由转弯区隔开的α-螺旋发夹结构[12],油体蛋白N末端和C末端结构域与磷脂极性端缔合,这种独特的结构与两亲性的表面活性剂的结构类似,为油脂体提供了维持稳定的界面活性[13-14]。除了由于两亲性蛋白质锚定在油脂体界面上,界面网络还可能通过静电相互作用维持稳定[15]。界面上的极性脂质可以带负电荷,并通过静电吸引力与界面蛋白的碱性氨基酸残基相互作用[16]。此外,外源蛋白可能存在蛋白酶和酯酶活性,对油脂体膜结构酶解破坏,造成油脂体破乳。Zhao Luping等[17]也通过碱液洗涤去除了大豆油脂体表面附着的β-伴大豆球蛋白、大豆球蛋白和致敏蛋白(如Gly m Bd 30K),得到了完整的大豆POB。

图1 大豆COB和POB蛋白电泳图Fig. 1 Electropherograms of soybean COB and POB proteins
2.2 大豆COB和POB乳液稳定性分析
油脂体乳液的稳定性与油脂体之间静电排斥和静电吸引的平衡有关。乳滴的表面电荷量决定着乳滴间的斥力大小,而表面电荷的多少可以通过Zeta电位的绝对值反映[18]。如图2所示,大豆COB和POB乳液的Zeta电位分别为(-35.03±0.60)、(-14.00±1.86) mV。油脂体膜由磷脂层和蛋白组成,油体蛋白是油脂体膜蛋白的主要组成部分[19],其中部分疏水基团会与油脂体内部的甘油三酯接触,而其N端和C端带正电荷的氨基酸残基与带负电荷的磷脂通过盐桥作用相结合而处于水相,构成了大豆POB的电位体系。而大豆COB表面的外源蛋白可为其提供一定的负电荷,因此具有较POB更高的电位绝对值。Matsumura等[20]研究发现,这些外源蛋白的附着提高了大豆COB的表面电荷密度,增加了油脂体之间的静电斥力,可能对其稳定性有积极的作用。

图2 大豆COB和POB的Zeta电位Fig. 2 Zeta potential of soybean COB and POB
粒径大小也可以从一定程度上反映乳液的稳定性,通常当乳液粒径分布越均一且粒径越小时,乳液体系越稳定。由图3A可知,大豆COB和POB粒径均呈现单峰分布,表明提取得到了较为均一的油脂体。由图3B可知,大豆COB和POB的D4,3分别为(552.93±9.40)、(475.06±4.49)nm,COB呈现出显著较大的D4,3。这可能是因为在COB提取过程中部分大豆蛋白可能会通过疏水作用、静电作用、氢键或二硫键与油脂体膜中的油体蛋白结合[1],附着在油脂体膜上,从而增加了COB粒径,而经过多次碱液洗涤,这些外源蛋白可以溶解在碱液中而被去除,因此POB粒径较小。Ishii等[10]测得大豆COB和POB的D4,3分别为(0.70±0.08)、(0.59±0.03)μm,与本研究结果相近。

图3 大豆COB和POB的粒径分布图(A)和D4,3(B)Fig. 3 Particle size distribution (A) and D4,3 (B) of soybean COB and POB
澄清指数-时间变化曲线中,澄清指数越高则说明乳液体系越不稳定[21-22]。由图4A、B可知,与大豆POB乳液相比,大豆COB乳液在离心过程中透光率变化较小,表明其稳定性较好。同样,由图4C可以看出,大豆COB和POB乳液澄清指数在前期保持相对稳定,但在20 min后急剧上升,表明两者均发生了不同程度的失稳;在失稳过程中,POB乳液澄清指数始终高于COB乳液,这表明COB乳液体系在离心条件下具有更好的物理稳定性。油脂体膜上的油体蛋白与磷脂相互作用,可以在油/水界面形成强大的弹性网络保护油脂体[23],而外源蛋白通过增加油脂体的电荷密度,提供了额外的静电斥力,从而进一步增加了油脂体的稳定性。此外,外源蛋白增加了油脂体的空间位阻。有研究表明部分物质和大豆的油脂体膜结合,可通过增加空间位阻而提高油脂体的乳化稳定性[24]。
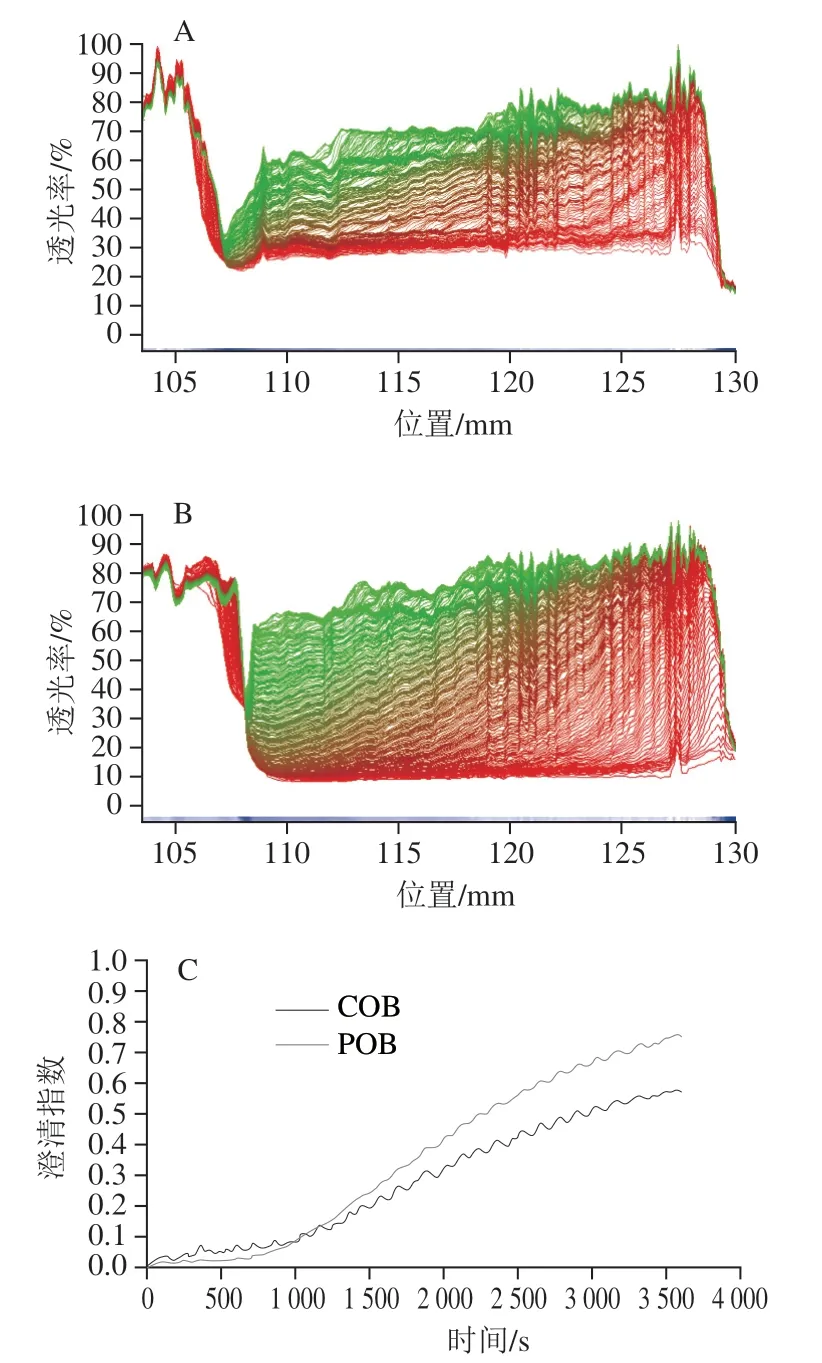
图4 COB(A)和POB(B)稳定性分析图谱和透光率曲线(C)Fig. 4 Stability of COB (A) and POB (B) and light transmittance curves (C)
2.3 COB和POB流变学特性分析
从图5可以看出,大豆COB和POB的黏度都表现出随剪切速率升高而降低的趋势,这个结果说明大豆COB和POB均具有剪切稀化特性,为假塑性流体。当剪切速率增大时,乳液体系中存在的比较散乱的粒子因为会受到流层之间的剪应力作用,而减少互相黏连和钩挂,或发生旋转滚动进而收缩成团,于是表现为黏度降低的现象[25]。另外,在不同剪切速率下,大豆COB的黏度始终高于大豆POB,这可能是由于大豆COB中含有大量的外源蛋白,这些蛋白分子之间,以及蛋白分子与水之间可能形成网络结构,增加了大豆COB乳液的流动阻力,从而使其黏度高于不含有外源蛋白的大豆POB乳液。
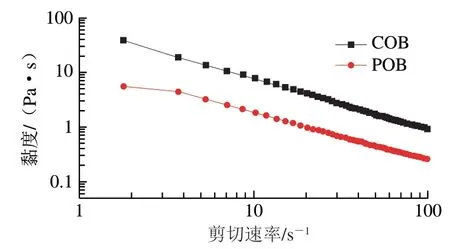
图5 COB和POB的黏度随剪切速率的变化曲线Fig. 5 Viscosity verses shear rate curves of COB and POB
G'代表材料贮存能量的能力,G″代表材料释放能量的能力。从图6A可以看出,在角频率扫描测定过程中,大豆COB、POB的G'均高于G″。随着角频率的增大,大豆COB和POB的G'和G″逐渐增大,说明大豆COB和POB的弹性和黏性都逐渐升高,均表现出黏弹性。此外,在不同角频率下,大豆POB的G'和G″始终高于COB,说明大豆POB内部结构可能较为紧密,在遭受变形后,具有更强的恢复能力。由图6B可知,大豆COB和POB各组的tanδ都小于1。tanδ越大,体系中黏性成分比重较大,体系表现流体的特征;相反,tanδ值越小,体系中弹性成分越多,体系表现固体的特征[26-27]。相较于大豆POB,COB具有更高的tanδ值,这表明COB具有更好的黏弹性,这可能是由于COB中的外源蛋白附着在油脂体表面,为COB提供了额外的空间位阻,因此为油脂体之间的挤压碰撞提供了缓冲。基于这一特性,COB可以作为稳定剂等功能性配料应用于肉制品等食品加工产业。
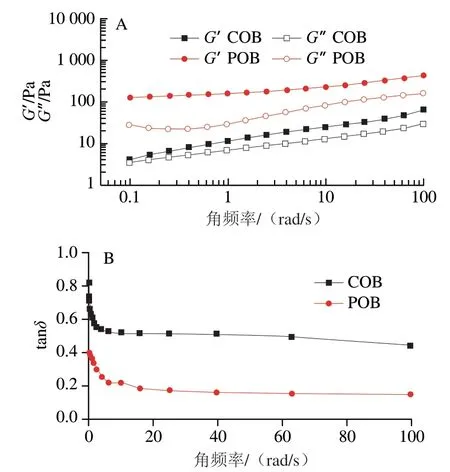
图6 大豆COB和POB的G'、G″(A)和tanδ(B)随角频率的变化曲线Fig. 6 Angular frequency-dependent curves of G', G″ (A) and tanδ (B) of soybean COB and POB
2.4 不同环境因素对大豆COB和POB乳液稳定性的影响
2.4.1 pH值对大豆COB和POB乳液稳定性的影响
由图7可知,大豆COB和POB乳液的Zeta电位分别在pH 4.5和pH 5.5左右趋近于0 mV,表明两者的等电点分别位于该值。大豆COB的等电点与大豆球蛋白和β-伴大豆球蛋白接近[28],这表明COB较高的电荷量主要是由外源蛋白提供,也再次证实了COB表面附着有大量的大豆贮藏蛋白。此外,尽管多数POB乳液的Zeta电位绝对值低于COB乳液(除pH 4附近),即维持乳液稳定的静电作用力较小,但POB乳液电位随pH值变化幅度较小,始终维持在-15~15 mV,这表明POB乳液相较于COB乳液受酸碱因素影响较小。Nikiforidis等[9]研究发现由于外源蛋白的存在,玉米胚芽COB在不同pH值下电位始终低于POB,这与本研究在大豆油脂体上的结果相似。

图7 不同pH值下大豆COB和POB乳液的Zeta电位变化Fig. 7 Zeta potential of soybean COB and POB emulsions at different pH
由图8可知,不管是大豆COB乳液,还是POB乳液,在远离等电点时,其D4,3显著小于等电点附近pH值的粒径,这表明乳液在远离等电点pH值时处在较为稳定的状态。结合图9可知,大豆COB乳液在pH 4、5,POB乳液在pH 5、6时,出现沉淀和上浮现象,乳液失稳,粒径无法准确测定,此时pH值接近油脂体等电点,说明静电斥力在维护油脂体乳液稳定性中具有重要作用。有研究表明,静电斥力较小会使乳液中的蛋白质絮凝、聚集导致乳化性降低,而远离等电点时,静电斥力提高,增加了蛋白的溶解性从而提高乳液的稳定性[29]。Lawal等[30]认为,随酸碱度增加,蛋白质逐渐变性,导致蛋白内部的疏水基团暴露,更多疏水基团指向油相,增强了与油相之间的作用,从而使乳液稳定性有所上升。而Qi Baokun等[31]研究发现在碱性条件下,随pH值增加大豆油脂体蛋白的β-折叠结构数量增加,促进了大豆油脂体的聚集。因此,在较高pH值下大豆油脂体的稳定性变化有待进一步探究。
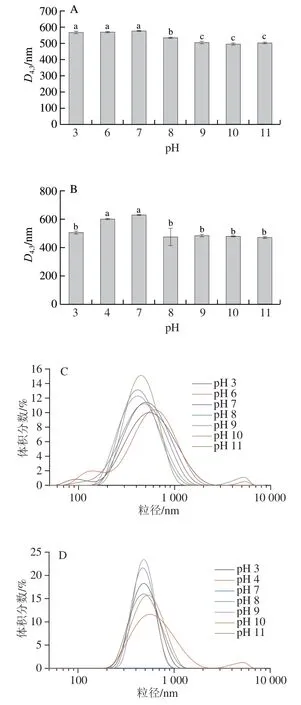
图8 不同pH值下大豆COB和POB乳液的D4,3(A、B)和粒径分布图(C、D)Fig. 8 D4,3 (A, B) and droplet size distribution (C, D) of COB and POB emulsions at different pH

图9 不同pH值下大豆COB(A)和POB(B)乳液状态Fig. 9 Pictures of COB (A) and POB (B) emulsions at different pH
2.4.2 离子强度对大豆COB和POB乳液稳定性的影响
由图10可知,随着Na+浓度逐渐升高,大豆POB和COB乳液的Zeta电位绝对值逐渐减小;当Na+浓度超过100 mmol/L后POB乳液的Zeta电位稳定在-2 mV左右,当Na+浓度达到250 mmol/L时Zeta电位绝对值降低到9.0 mV。与POB乳液相比,富含外源蛋白的COB乳液在Na+浓度变化的过程中,Zeta电位绝对值下降幅度较大且剧烈。由于组成油脂体膜的磷脂和蛋白质在膜外侧携带负电荷,同时,COB含有大量带电蛋白质,因此COB在中性提取环境中呈现更高负电性。而当低浓度的Na+加入时,Na+与外层蛋白质分子相结合,吸附在其表面,由于Na+携带正电荷,从而通过静电屏蔽效应降低了油脂体表面电荷,导致Zeta电位绝对值逐渐降低[18]。
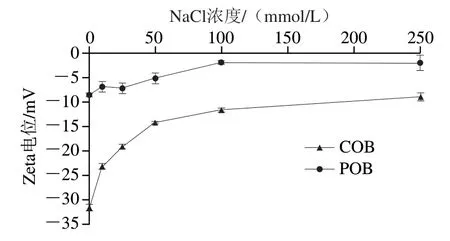
图10 不同Na+浓度下大豆COB和POB乳液的Zeta电位变化Fig. 10 Zeta potential of soybean COB and POB emulsions at different sodium concentrations
由图11和12可知,大豆POB乳液在不同Na+浓度环境中,粒径分布始终呈现单峰的稳定状态,且乳液呈现均一的乳白色;而COB乳液的D4,3随着Na+浓度的增加快速增加,在Na+浓度为50 mmol/L时,可观察到有沉淀生成,随着Na+浓度的进一步增加,出现严重的絮凝和沉淀。上述结果表明,在不同Na+浓度下,大豆POB乳液较COB乳液具有更高的稳定性。Huang等[32]在提取番茄籽油脂体时,发现了相似的现象,富含蛋白的番茄籽油脂体更易受阳离子的影响而发生聚集。研究表明,阳离子通过静电屏蔽作用降低油脂体之间的静电斥力,从而使油脂体容易发生絮凝[33]。此外,阳离子可能与蛋白相互作用,改变它们的构型并抑制蛋白质间疏水相互作用,从而破坏油脂体膜结构,影响油脂体乳液稳定性[34]。

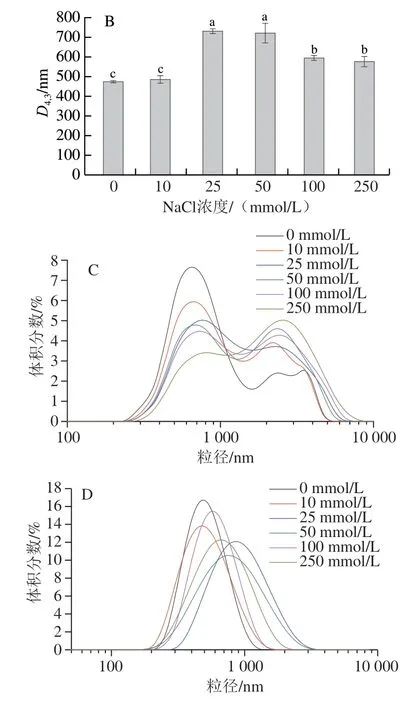
图11 不同Na+浓度下大豆COB和POB乳液D4,3(A、B)和粒径分布图(C、D)Fig. 11 D4,3 (A, B) and droplest size distribution (C, D) of COB and POB emulsions at different sodium concentrations

图12 不同Na+浓度下大豆COB(A)和POB(B)乳液状态Fig. 12 Pictures of soybean COB (A) and POB (B) emulsions at different sodium concentrations
2.4.3 温度对大豆COB和POB乳液稳定性的影响
由图13可知,不同温度加热对大豆POB乳液Zeta电位影响均较小,热处理后仍带负电荷,带电性质并没有发生改变。大豆COB乳液经过40 ℃处理后,Zeta电位绝对值随着处理温度的增加稍有下降,当处理温度为90 ℃时,电位绝对值达到最低值。电位绝对值的下降可能是由于热处理改变了其外源蛋白构象,使环境中的负电离子与其作用减弱,导致其表面电荷密度下降[35]。此外,研究表明,外源蛋白中含有磷脂酶,会水解磷脂生成带负电的脂肪酸和脂活性物质,部分负电性物质附着在油脂体膜上,增加油脂体电荷密度[36]。经过热处理的油脂体Zeta电位绝对值比未经过热处理的Zeta电位绝对值小,可能是由于热处理导致酶失活,减少了负电性物质的生成,从而导致COB乳液Zeta电位绝对值下降。
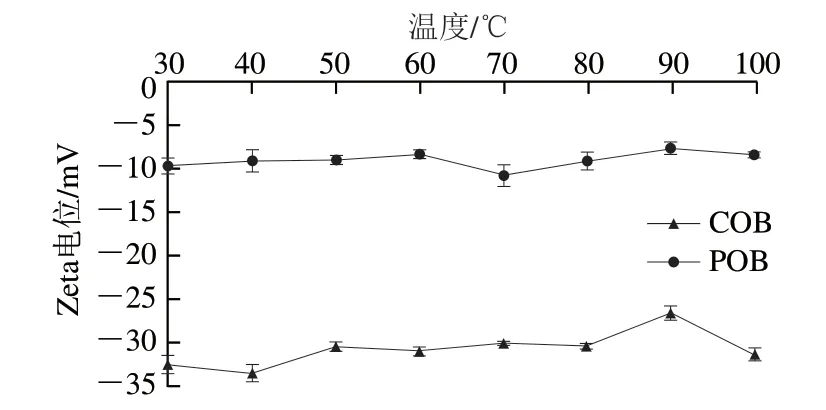
图13 不同温度下大豆COB和POB乳液的Zeta电位变化Fig. 13 Zeta potential of soybean COB and POB emulsions at different temperatures
由图14可知,30 ℃加热30 min后大豆COB乳液的D4,3为(654.63±7.56)nm,100 ℃加热30 min后为(426.73±6.33)nm,其D4,3总体随热处理温度的上升显著下降,且较大的聚集体在50 ℃以上加热处理后消失,这可能是由于随着温度的升高,COB乳液体系活动逐渐剧烈,原本发生聚集的小部分油脂体重新分散,导致其D4,3下降。而大豆POB乳液的D4,3随温度变化幅度较小,这表明大豆POB乳液相较于COB乳液具有更强的耐热性,这与Zeta电位结果一致。由图15可知,在不同温度处理下COB和POB乳液的宏观状态并未发生改变。陈业明等[33]研究发现,经过80 ℃热处理,油脂体上外源蛋白明显减少,油脂体的纯度增加。大豆球蛋白的变性温度为(90±2) ℃,β-伴大豆球蛋白的变性温度为(70±2)℃,热处理可能使外源蛋白变性脱落,导致COB的粒径减小[37]。Chen Yeming等[38]研究发现热处理可以钝化大豆油脂体中脂肪酶活性,有利于油脂体的贮藏,防止油脂氧化,进一步增加油脂体的稳定性。
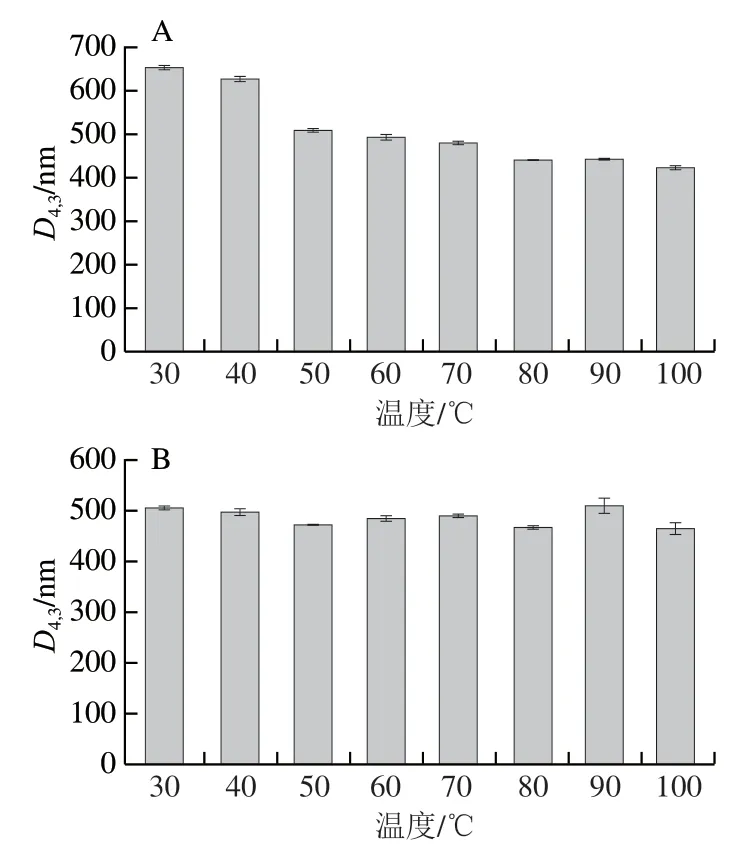
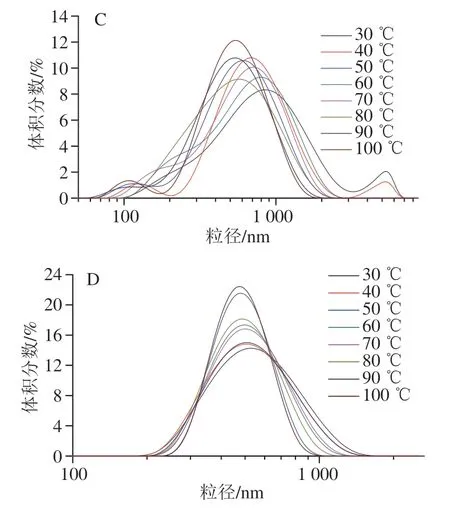
图14 不同温度下大豆COB和POB乳液的D4,3(A、B)和粒径分布图(C、D)Fig. 14 D4,3 (A, B) and droplet size distribution (C, D) of COB and POB emulsions at different temperatures

图15 不同温度下大豆COB(A)和POB(B)乳液状态Fig. 15 Pictures of soybean COB (A) and POB (B) emulsions at different temperatures
3 结 论
通过水提法辅助去离子水洗涤或碱液洗涤,成功提取并得到蛋白组分具有明显差异的大豆COB和POB。提取所得大豆POB只含有油体蛋白,而COB除含有油体蛋白外,还含有大量其他大豆蛋白,主要包括大豆球蛋白、β-伴大豆球蛋白和过敏蛋白。大豆COB和POB的D4,3分别为(552.93±9.40)nm和(475.06±4.49)nm,Zeta电位分别为(-35.03±0.60)mV和(-14.00±1.86)mV。COB和POB均具有剪切稀化特性,但在不同剪切速率下,大豆COB的黏性均高于POB,外源蛋白的存在改变了大豆油脂体的加工性能;此外,外源蛋白附着在COB上,形成了油脂体膜以外的第2层蛋白膜,并提供额外的电荷,导致COB粒径和Zeta电位绝对值均大于POB。大豆POB中蛋白等电点位于pH 5.5左右,而大豆COB中蛋白等电点位于pH 4.5左右,此pH值也是大豆球蛋白和β-伴大豆球蛋白的等电点。外源蛋白的存在导致大豆COB在酸碱环境下较POB更容易失稳。大豆COB的D4,3随Na+浓度增加迅速增大,并出现大量聚集,而大豆POB则更为稳定,这可能是由于Na+会通过静电屏蔽作用降低蛋白间的静电斥力,而大量外源蛋白的存在导致COB更容易发生絮凝,稳定性降低。热处理过程中,大豆COB的D4,3随热处理温度升高而降低,这可能是由于加热导致外源蛋白变性脱落,但大豆COB和POB乳液在不同热处理温度下都呈现出了较好的稳定性。

