鳙鱼头汤中微/纳胶粒的体外消化特性及加工条件的影响
林 柳,李晓朋,曹振海,陶宁萍,2,*,王锡昌,2,邓尚贵
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.浙江海洋大学食品与药学学院,浙江 舟山 316000)
鳙鱼头含有丰富的必需氨基酸和脂溶性营养素,且单不饱和脂肪酸(monounsaturated fatty acid,MUFA)可达到鱼头总脂肪酸的80%以上,远高于海水鱼类;同时,二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)的含量可达其多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)总量的50%以上,是n-3 PUFA的优质来源[1]。受传统饮食习惯的影响,鳙鱼头多以鱼头汤的形式食用。目前,关于汤品的研究主要集中于不同熬煮工艺对其营养及风味物质溶出的影响[2-4]。随着食品胶体认知的深入,汤中微/纳胶粒(micro/nano-sized colloidal particles,MNCPs)的形成过程、生物活性和药用价值逐渐被关注。有研究表明[5-12],熬煮过程中,营养物质经加热、沸腾和浸提后,溶入到汤中的单分子物质之间相互作用并自组装形成MNCPs。汤中聚集物的药用价值及生物活性也被报道:葛根芩连汤中的聚集物胶粒被证实具有抗糖尿病活性[9];金枪鱼头汤中不同粒径的MNCPs具有抗氧化能力[10]。然而,对汤中MNCPs的消化行为及生物利用度鲜有报道。
有研究发现[10-11],鱼汤熬煮过程中,甘油三酯(triglyceride,TG)自组装形成MNCPs,而糖、蛋白及磷脂等物质包被在MNCPs外围,构成了MNCPs膜,在保护MNCPs的完整性上扮演着重要角色。在汤品加工成商品的过程中,盐的加入一方面可增加蛋白水合作用,促进乳化;另一方面可通过降低MNCPs膜间的静电斥力,破坏MNCPs稳定性[13-14]。此外,均质给予的高速剪切力、对流撞击等机械作用,可形成体积更小、膜比表面积更大的MNCPs,在静电斥力和空间位阻作用下,进一步形成更加稳定的体系[4]。盐和均质对MNCPs和MNCPs膜原有结构的改变,可能进而影响其在胃肠道中的消化行为及生物可及性。因此,有必要探究MNCPs及MNCPs膜在消化过程中的修饰,以及其组成和结构对脂质生物可及性的影响。体外模拟胃肠道消化模型操作便捷、周期短、成本低和不受伦理限制,可以方便监测消化过程中脂质的物理化学变化。
本研究通过马尔文粒度分析仪、光学显微镜及激光共聚焦显微镜对各阶段体外模拟胃肠消化后鳙鱼头汤(bighead carp head soup,BCHS)消化产物中MNCPs的形态和微观结构变化进行多角度表征,并分析MNCPs中脂质的释放探究不同加工条件下BCHS中MNCPs的物理变化及生物可及性,解析加盐和均质对MNCPs消化特性的影响,为MNCPs在人体吸收利用与烹调条件之间的相关性提供一定理论基础。
1 材料与方法
1.1 材料与试剂
30个真空包装的杭州千岛湖鳙鱼头(体质量(0.96±0.03)kg、长(19±1)cm、宽(13±1)cm)购于淘宝店千岛湖天然岛,在24 h内通过冷链运抵上海海洋大学实验室,于-40 ℃下贮藏备用。大豆油 益海嘉里金龙鱼粮油食品股份有限公司;食盐(300 g/包)中国盐业集团有限公司。
十九烷酸、十九烷酸甲酯、37种脂肪酸甲酯混合标准品 上海安谱科学仪器有限公司;胃蛋白酶(比活力750 U/mg)、胰酶(比活力50 U/mg) 美国Sigma-Aldrich公司;尼罗红、猪胆盐、磷酸盐缓冲液(phosphate buffered saline,PBS)、柠檬酸盐-磷酸盐缓冲液(mcilvaine buffer,MB) 上海麦克林生化科技有限公司;固绿FCF 美国Avanti Polar Lipids公司;载玻片 美国赛默飞世尔科技公司;盖玻片 江苏世泰实验器材有限公司。
1.2 仪器与设备
UV-2200紫外分光光度计 美国Unico公司;Trace GC Ultra气相色谱仪 美国赛默飞世尔科技公司;RV 10旋转蒸发仪 德国IKA集团;SP-2560气相色谱柱德国默克公司;MS600F倒置生物显微镜 上海名兹精密仪器有限公司;MS3000激光粒度分析仪 英国马尔文仪器有限公司;Spotlight 400傅里叶变换红外光谱仪美国珀金埃尔默仪器有限公司;FD-1C-50+真空冷冻干燥机 北京博医康实验仪器有限公司;LSM710 NL0激光共聚焦显微镜 德国徕卡显微系统公司;GYB60-6S高压均质机 上海东华高压匀浆泵厂。
1.3 方法
1.3.1 BCHS的制备
参考Qian Xueli等[15]和樊馨怡[16]的方法熬煮BCHS:将鳙鱼头切成3 cm×3 cm×2 cm小块,清洗干净后晾干。将(20±1) g大豆油于120 ℃预热30 s,加入(400±2)g鱼块油煎40 s,加入3.2 kg饮用水(鱼∶水=1∶8,m/m)在97 ℃熬煮30 min后,再在90 ℃下熬煮120 min,制得BCHS。加入0.5%(m/m)的食盐到BCHS,制得加盐BCHS(salted BCHS,SBCHS)。将1 L SBCHS冷却至室温后于高压均质机(10~20 MPa)下均质,重复两次,制得均质SBCHS(homogenous SBCHS,HSBCHS)。将制备完成的BCHS、SBCHS和HSBCHS分装于150 mL的小瓶中待用。
1.3.2 体外消化模拟
1.3.2.1 消化液模拟液的配制
胃液模拟液(simulated gastric fluid,SGF)和肠液模拟液(simulated intestinal fluid,SIF)浓缩液的配制参考Minekus等[17]方法,见表1。

表1 SGF和SIF浓缩液的配制Table 1 Preparation of SGF and SIF
配制500 mL SGF:称取3.0 g胃蛋白酶溶解于375 mL SGF浓缩液中,再加入0.25 mL 0.3 mol/L的CaCl2(H2O)2溶液和124.75 mL去离子水,用6 mol/L HCl溶液调节至pH 2.0。配制500 mL SIF:称取2.0 g胰酶和4.25 g胆盐溶解于375 mL的SIF浓缩液中,加入1.0 mL 0.3 mol/L CaCl2(H2O)2和124 mL去离子水,用6 mol/L HCl溶液调节至pH 7.0。
1.3.2.2 胃消化阶段
用6 mol/L HCl溶液分别调节100 mL BCHS、SBCHS和HSBCHS样品的pH值至(2.0±0.1),于37 ℃恒温水浴锅预热10 min,随后加入100 mL已预热的模拟胃液消化液(37 ℃),放入37 ℃、120 r/min恒温振荡水浴锅中振荡2 h,定期取出胃消化后的样品以备分析。
1.3.2.3 小肠消化阶段
取100 mL胃消化后的样品,用1 mol/L NaOH溶液调节至pH(7.0±0.1),加入100 mL已预热的模拟肠液消化液(37 ℃),放入37 ℃、150 r/min恒温振荡水浴锅中振荡2 h,用1 mol/L NaOH溶液滴定使混合体系的pH值维持在7.0±0.1,定期取出肠消化后的样品以备分析。
1.3.3 MNCPs表征
1.3.3.1 MNCPs粒径及粒径分布测定
参考Zhang Ruojie等[18]的方法并进行适当调整:分别将BCHS、SBCHS、HSBCHS及其各阶段消化产物样品稀释10 倍,在室温下进行测定。小肠消化产物的遮光度范围为5%~15%,其他样品的遮光度范围为5%~10%。使用pH 7.0 0.2 mol/L PBS稀释未经消化及经小肠消化后的样品,使用pH 2.5 0.2 mol/L MB稀释胃消化样品。设置MNCPs折射率为1.460,分散相折射率为1.330。平均粒径由表面积平均粒径(D3,2)表示。
1.3.3.2 MNCPs形貌特征观察
消化过程中每30 min收集一次样品,用于显微镜观察。取15 μL消化物于载玻片上,用倒置生物显微镜(50 倍目镜)观察胃肠道消化过程中MNCPs的形态变化。
1.3.3.3 MNCPs微观结构观察
使用激光共聚焦显微镜分别观察BCHS、SBCHS、HSBCHS及其各消化阶段的样品[19-20]。样品染色(TG与蛋白质混染):将100 μL 42 μg/mL TG染色液尼罗红(用丙酮配制)和10 μL 1 mg/mL蛋白质染色液固绿FCF染色液(用水配制)添加到1 mL样品中,涡旋振荡1 min混合均匀后备用。取10 μL染色后的样品于载玻片上,用盖玻片固定后避光静置10 min,使用63 倍油浸物镜(数值孔径1.4)成像。氩激光器的激发波长为488 nm,He-Ne激光器的激发波长为543 nm。
1.3.4 傅里叶变换红外光谱分析
分别取20 mL BCHS、SBCHS、HSBCHS及其各消化阶段的样品于-80 ℃冰箱预冻24 h,放入冻干机36 h冻干,于干燥器中贮藏以备分析使用。
使用单点ATR模式采集红外光谱,扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描信号累加次数32次,以空气为背景。利用Spectrum软件对原始谱图进行基线校正,13 点平滑处理并按最大峰值进行归一化后,得到样品的红外光谱图。
1.3.5 脂肪酸组成分析
1.3.5.1 样品前处理
参考Folch等[21]的方法提取样品中总脂肪:将20 mL样品与400 mL氯仿-甲醇(2∶1,V/V)溶液混匀,于4 ℃冰箱中静置24 h。加入10 mL 0.9% NaCl溶液(m/m),摇匀后在4 ℃下静置分层,除去上层相,重复2~3次。收集并合并下层相,使用旋转蒸发仪于40 ℃脱溶后,得到总脂肪。
称取0.08~0.1 g总脂于50 mL圆底烧瓶中,参考Zhang Jing等[22]的方法对脂肪酸进行甲酯化,并利用气相色谱仪对脂肪酸组成和含量进行测定。
1.3.5.2 气相色谱分析
色谱柱:Agilent SP-2560毛细管柱(100 m×0.25 mm,0.2 μm);检测器:火焰离子化检测器;升温程序:起始温度70 ℃,以50 ℃/min升至140 ℃,保持1 min,4 ℃/min升至180 ℃,保持1 min,3 ℃/min升至225 ℃,保持30 min;汽化室温度250 ℃;载气氮气;柱流速1 mL/min;分流比45∶1;进样量1 μL。
分别按下式计算胃肠消化后BCHS、SBCHS和HSBCHS样品中总脂肪酸(total fatty acid,TFA)、饱和脂肪酸(saturated fatty acid,SFA)、不饱和脂肪酸(unsaturated fatty acid,UFA)、MUFA和多PUFA的脂肪酸释放率:

式中:m0为消化前样品中脂肪酸含量/g;m1为经胃肠消化后样品中脂肪酸含量/g。
1.4 数据处理
2 结果与分析
2.1 处理方式对各消化阶段BCHS中MNCPs粒径及其分布变化的影响

图1 各消化阶段的BCHS(A)、SBCHS(B)和HSBCHS(C)图Fig. 1 Photos of BCHS (A), SBCHS (B) and HSBCHS (C) at each digestion stage
如图1所示,经加盐和均质后,未消化的3种BCHS的外观并无显著变化,均为均一稳定的乳白色液体。由图2可知,未消化的3种BCHS中均存在着从纳米到微米级的MNCPs。在未消化阶段,BCHS与SBCHS均呈现多峰分布状态,但SBCHS右侧峰的高度相较于BCHS更低并整体向左靠拢。结合图3可知,未消化SBCHS中MNCPs的D3,2减小了0.42 μm,其原因是NaCl提高了蛋白质的水合作用,增强了蛋白质之间以及蛋白质和脂肪之间的结合,促进了汤中脂滴的乳化[13]。进一步均质后,未消化HSBCHS的D3,2降低为0.507 μm,且粒度分布更集中,但同样没有呈现单峰分布;这可能是由于高压均质破坏了汤中MNCPs原本稳定的结构,并重新排布,而汤中的蛋白不足以将剪切形成的细微的MNCPs包裹完全,导致相邻的MNCPs间吸引力大于排斥力,进而聚集。

图2 未消化(A)、胃消化(B)、肠消化(C)不同处理BCHS样品的粒径分布图Fig. 2 Particle size distribution of BCHS samples with different treatments before digestion (A), after gastric digestion (B), and after gastrointestinal digestion (C)

图3 各消化阶段BCHS、SBCHS和HSBCHS的D3,2Fig. 3 D3,2 of BCHS, SBCHS and HSBCHS at each digestion stage
经胃消化后,3种BCHS均出现了明显的相分离,主要为最上面的油层,中间细软的絮凝层以及下面伴有少量絮凝物的水相(图1);MNCPs粒径分布由原来的多峰分布逐渐趋向于单峰正态分布(图2),且D3,2极显著增大(P<0.01)(图3),表示MNCPs发生了明显的聚集性行为。这是由于胃蛋白酶的作用降解了MNCPs膜上的部分蛋白,使MNCPs原本稳定的结构发生改变,MNCPs间的斥力降低,胶粒之间发生聚集。另外,胃中的酸性条件,改变了汤中原有体系的pH值,使未消化完全的蛋白质发生絮凝。由图2、3可知,胃消化BCHS与SBCHS粒径分布的峰形更相似,而HSBCHS的粒径分布则更集中,且D3,2极显著大于BCHS与SBCHS(P<0.01)。
经小肠消化后,3种BCHS中絮状物消失并形成肉眼可见的不溶性复合物(图1),MNCPs的粒径明显增大,峰向右偏移。原有粒径范围内的胶粒明显减少,表示汤中大部分MNCPs已被消化。生成的大粒径(100~1 000 μm)胶粒,可能是小肠消化形成的不溶性胆盐复合物,其次是消化液中的Ca2+与小肠消化过程中释放出来的脂肪酸结合,形成的不溶性皂钙。由图3可知,整个消化过程中3种BCHS中MNCPs的D3,2变化趋势相似,均表现为先增大后减小且大于消化前。
2.2 处理方式对各消化阶段BCHS中MNCPs形貌特征变化的影响
如图4所示,3种未消化的BCHS中均可观察到大小不一且边缘完整的球形胶粒并均匀分散于汤中;其中,HSBCHS中MNCPs的数量明显增加且尺寸明显减小,这与粒径结果一致。胃消化过程中,MNCPs主要表现为聚集性行为,且加盐和均质未改变MNCPs在整个胃消化过程中的形态变化规律,但在不同消化节点仍存在差异,特别是HSBCHS:胃消化前10 min胶粒的变化最为显著,MNCPs间不断靠拢,脂滴发生融合,胶粒变大;胃消化10 min时,BCHS中部分MNCPs聚集体的中心已观察不到完整的球形胶粒,但边缘依然凹凸不平,显示为半球形,而SBCHS的聚集物中还可观察到完整的球形胶粒。与BCHS和SBCHS具有明显差别的是,HSBCHS中的MNCPs同样发生聚集,但并未出现大的脂滴聚集体,而是以小胶粒的成团形式存在。在后续的消化过程中,胶粒不断融合;胃消化20 min时,BCHS中已经能够观察到边缘完整的大粒径球形胶粒,而SBCHS无明显变化;胃消化30 min时,SBCHS的聚集体中心已观察不到与未消化样品相同粒径的MNCPs存在,但边缘依然凹凸不平,未完全融合。胃消化60 min后,BCHS和SBCHS中脂滴形态无显著变化,并且在胃消化结束时,聚集体边缘变得光滑,形状变得完整;相较于BCHS与SBCHS,HSBCHS虽然同样形成了大的脂滴,但是依然存在广泛的细小胶粒物在聚集物的周围或单独存在,这是由于均质处理使脂滴破散,原本膜上的蛋白质不足以包被新形成的MNCPs,因此汤中原本分散的蛋白质以及表面活性物质重新吸附到界面,构成新的膜结构,增加了胶粒稳定性。
小肠消化过程中,MNCPs聚集物在胰酶的作用下,膜结构被完全破坏,MNCPs聚集体裂解。如图5所示,小肠消化到30 min时,BCHS与SBCHS中的胶粒已变得不规整,边缘开始破裂(如箭头所示);HSBCHS中胶粒的裂解速度更快,已可观察到明显的破散(如方框所示)。小肠消化到60 min时,在胆盐的作用下脂滴的表面张力进一步降低,发生明显乳化并形成细微的乳滴,但这些微滴并未完全散开,依然成团存在。小肠消化结束时,大部分脂滴消失,但仍可观察到较大的聚集物以及零星存在的小胶粒物;相较于BCHS,SBCHS中观察到细微的胶粒物更为分散且数量更多,HSBCHS中的聚集体则更小。这些依然存在的聚集体可能是未消化完全的脂滴,也可能是胆盐与磷脂,单甘脂或脂肪酸等形成的含脂聚集体。

图4 BCHS(A)、SBCHS(B)和HSBCHS(C)中MNCPs在胃消化阶段的光学显微镜图Fig. 4 Optical micrographs of MNCPs in BCHS (A), SBCHS (B) and HSBCHS (C) during gastric digestion

图5 BCHS(A)、SBCHS(B)和HSBCHS(C)中MNCPs在肠消化阶段的光学显微镜图Fig. 5 Optical micrographs of MNCPs in BCHS (A), SBCHS (B) and HSBCHS (C) during intestinal digestion
2.3 处理方式对各消化阶段BCHS中MNCPs微观结构变化的影响
进一步观察MNCPs在胃肠消化过程中微观结构的变化,验证光学显微镜的结果。如图6所示,未消化的各处理BCHS样品中,TG(红色探针)自组装形成MNCPs,蛋白质与MNCPs外围的脂质分子结合共同构成MNCPs双层膜,同时使MNPs之间的静电斥力增大,从而抑制MNCPs之间的聚集作用,使MNCPs以单独的球形胶粒均匀分布于汤中,这与已报道的研究一致[23-24]。从SBCHS中观察到部分MNCPs粒径变大的现象且MNCPs中间可以明显观察到蛋白质的存在;可能是由于局部盐浓度过高,NaCl通过降低胶粒表面的静电排斥作用,使胶粒之间相互吸附形成了粒径较大的胶粒,并将汤中存在的水溶性蛋白胶粒或MNCPs膜上的蛋白包裹其中。经物理破碎后,从HSBCHS中观察到MNCPs的尺寸更小且分布更广,其原因可能是经物理剪切后,汤中蛋白质和胆固醇等类脂成分作为表面活性剂参与构成新的MNCPs膜,稳定了MNCPs结构,这与粒径和光学显微镜的结果一致。与未消化相比,3种BCHS经模拟胃肠消化后脂滴的大小以及分散程度存在明显差异。

图6 BCHS(A)、SBCHS(B)和HSBCHS(C)中MNCPs在各消化阶段的激光共聚焦图像Fig. 6 Laser confocal images of MNCPs in BCHS (A), SBCHS (B) and HSBCHS (C) during the entire digestion process
由图6可知,经胃消化后,蛋白质凝块裂解,圆环消失,中心包裹的TG被释放并聚集,形成TG聚集物。MNCPs的聚集主要是由于膜蛋白被胃蛋白酶分解,其次是模拟胃液中的酸性环境以及高离子浓度,使原本稳定的MNCPs膜受损,TG暴露,胶粒发生聚集[25-26]。同时,还可观察到HSBCHS的聚集物最小,这也与光学显微镜观察的结果一致。值得注意的是,胃消化完成后,还可观察到结构完整的球形胶粒,HSBCHS中最为明显。有研究表明牛乳以及羊乳脂肪球在胃消化完成后,也观察到部分乳脂肪球结构依然完整,探究发现主要是由于其外围所包被的磷脂未被消化,依然以圆环的形式包裹着脂滴,使得脂肪球的结构依然稳定未发生明显变化,在保护乳脂肪球的完整性上扮演着重要角色[27-28]。已有研究表明[23-24],汤中MNCPs的膜上同样存在磷脂等物质。因此在胃消化阶段,MNCPs膜上磷脂以及糖等物质在保护MNCPs的完整性上起重要作用。而HSBCHS中保持原有状态的胶粒较多,可能是均质后MNCPs表面积增加,原有的膜不能将新形成的MNCPs全部包裹,汤中的蛋白和磷脂等表面活性物质吸附到新形成的界面上,新形成的MNCPs膜上所含的磷脂比其在熬煮过程中形成的MNCPs膜上的多,因此胃消化后HSBCHS中MNCPs所含膜结构的完整性优于BCHS与SBCHS。
此外,在3种BCHS的胃消化产物中,还可观察到未消化的蛋白质以及蛋白质位置的改变,部分蛋白质由原来以圆环的形式分布在MNCPs外围转移到了脂滴的中心,如箭头所示。蛋白质未被完全降解的原因主要有3个:1)部分蛋白质由于高度糖基化不能被胃蛋白酶分解,或胃蛋白酶对部分蛋白质不起作用,需要进一步在小肠中通过胰蛋白酶才能被降解[29-31]。2)经过胃消化过程后,脂滴重新排布并发生聚集,蛋白质在聚集过程中,被包裹在脂滴内部,阻断了蛋白质与胃蛋白酶之间的接触。3)消化过程中pH值的波动降低了胃蛋白酶的活性,使其酶解能力变弱。当胃消化产物进入小肠后,胆盐附着在脂滴周围,置换了MNCPs膜上的磷脂与蛋白质等物质,使脂肪球变成微乳,增大脂滴与胰脂肪酶以及辅脂酶的接触面积,促进脂质消化。同样,可观察到胃中未消化的蛋白质会在胰蛋白酶的作用下进一步水解。由图6可知,经小肠消化后,消化产物中依然存在着红色荧光区域并伴随有黑色孔洞,但其边缘模糊。这可能来自于未消化完全的MNCPs,或者区别于原本的MNCPs,是由胆盐、磷脂、脂解产物以及未降解的TG形成的含脂絮凝物。
2.4 不同处理方式各消化阶段BCHS中MNCPs的红外图谱分析
如图7所示,未消化的BCHS、SBCHS和HSBCHS在3 288、2 924、2 854、1 745、1 645、1 546、1 453、1 399、1 382、1 237 cm-1等波数附近出现明显特征峰,进一步说明,3种BCHS中的组成物质相似,加盐与均质处理并未改变汤中的物质组成。其中,2 924、2 854、1 745 cm-1波数附近出现的明显吸收峰主要是由脂肪中—CH3、—CH2—的反对称伸缩振动以及C=O对称伸缩振动所引起。图7中3 288 cm-1处的N—H键的伸缩振动、1 645 cm-1处的C=O伸缩振动、1 546 cm-1处的N—H带结合C—N伸缩振动、1 453 cm-1处的—CH2—弯曲振动、1 399 cm-1处的—COO—对称伸缩振动、1 237 cm-1处的N—H和C—H弯曲振动、甘氨酸残基的—CH2—特征振动,主要贡献物质为蛋白质。
经胃消化后,3种BCHS中MNCPs的峰型基本保持不变,表明汤中的整体物质并未发生明显改变。小肠消化后,红外图谱变化明显,在1 300~1 200 cm-1(主要为酰胺III带)以及1744 cm-1(主要为脂肪羰基以及TG)波数附近均未出现明显吸收峰,表明经小肠消化后,部分蛋白质和脂质已完全降解。羧酸盐的特征基团(—COO—)中,C—O的对称伸缩振动在1 420~1 300 cm-1,因此推测小肠消化后,BCHS、SBCHS和HSBCHS在该波数段出现的明显吸收峰(红色圆圈所示),可能来自于消化过程中产生的游离脂肪酸与溶液中Na+、Ca2+等生成的羧酸盐。
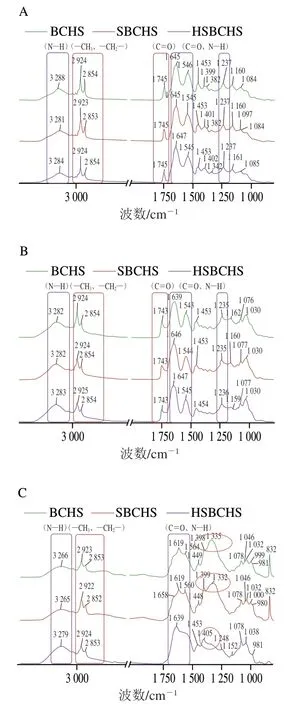
图7 未消化(A)、胃消化(B)、肠消化(C)不同处理BCHS样品的红外光谱图Fig. 7 Infrared spectra of BCHS samples with different treatments before digestion (A), after gastric digestion (B), and after gastrointestinal digestion (C)
2.5 消化后不同处理方式BCHS中MNCPs脂肪酸的释放分析
从图8A可以看出,SBCHS的TFA释放率相较于BCHS极显著降低(P<0.01),原因可能是脂解消化作为界面反应,一方面加盐后汤中Na+浓度增加,促进其与膜上脂肪酸形成不溶性皂[32];而小肠中胆盐、脂肪酸等作为负电性成分,与Cl-发生静电排斥,两种离子均影响脂肪酶在MNCPs膜上聚集,致使脂肪酸的释放率降低。进一步均质处理后,HSBCHS的TFA释放率相较于SBCHS提高约3%;HSBCHS的SFA的释放率高于BCHS,但二者之间无极显著差异(P≥0.01)。均质机械力作用下,生成的小粒径MNCPs,直接影响油水界面处脂肪酶的有效作用位点数量,在一定程度上弥补了加盐后汤中部分脂肪酸释放率的降低。
由图8B~D可知,3种BCHS释放的脂肪酸种类一致,均为8种SFA、6种MUFA以及9种PUFA,但每种类型脂肪酸的释放率各有不同。值得注意的是,C20:5(EPA)与C22:6(DHA)是两种重要的n-3 PUFA,对人体健康具有重要的生理功效。由图8D可知,SBCHS的EPA和DHA的释放率相较于BCHS均明显降低,然而进一步均质处理后,EPA和DHA的释放率分别提高约29.1%和34.8%,推测一方面为均质后增加了酶解反应的位点,另一方为SFA和MUFA作为较弱的负电组分结合于MNCPs膜表面,从而促进了具有更多双键结构的EPA和DHA的释放。

图8 胃肠消化后BCHS、SBCHS和HSBCHS中MNCPs的脂肪酸释放率Fig. 8 Percentage of fatty acids released from MNCPs in BCHS,SBCHS and HSBCHS after gastrointestinal digestion
3 结 论
通过体外模拟胃肠道消化模型从不同消化阶段消化产物的表征以及脂质的消化情况等角度探究BCHS中MNCPs的消化特性以及加盐和均质对其消化特性的影响。结果表明,3种BCHS在消化过程中的整体变化趋势相似。在胃消化过程中,MNCPs均表现为膜上蛋白质降解后,MNCPs之间融合,粒径增大,即MNCPs的聚集性行为;在小肠消化过程中,经胆盐和胰酶作用,脂滴破散,表现为MNCPs聚集体的裂解。加盐和均质未改变MNCPs在胃肠消化过程中的整体变化趋势,但相同阶段依然存在差异。通过对消化产物的表征发现,加盐后,SBCHS中MNCPs的D3,2均减小,但仍存在部分破乳现象,使胶粒之间相互吸附发生聚集,部分蛋白质被包裹其中,同时,加盐增加了MNCPs的稳定性,降低脂肪酸释放率。进一步均质后,HSBCHS中MNCPs的D3,2进一步减小,改变了原有的膜结构,MNCPs重新排布,增加了MNCPs中脂质和胰酶之间的接触位点,促进脂肪酸的释放。综上所述,在胃消化阶段胃蛋白酶对MNCPs界面稳定的膜结构的破坏是MNCPs消化的前提,并且均质处理在一定程度上弥补了加盐后汤中部分脂肪酸释放率的降低。

