重组变构人TRAIL联合5-FU对裸鼠结直肠癌移植瘤的抑制作用
孙同友, 赵丽霞, 崔玉洁, 周 硕, 梁秀军, 孙大永
(1.河北省承德市中心医院, 河北 承 德 067000 2.河北省人民医院肿瘤五科, 河北 石家庄 050057 3.承德医学院研究生院, 河北 承 德 067000 4.承德医学院基础医学研究所, 河北 承 德 067000)
结直肠癌(colorectal cancer,CRC)是常见的胃肠道恶性肿瘤,起源于结直肠黏膜上皮,包括结肠和直肠的恶性肿瘤,全球范围内CRC的发病率和死亡率分别占所有恶性肿瘤发病的第3位和第2位[1]。我国的形势也很严峻,根据国家癌症中心发布的2015年我国恶性肿瘤流行病学数据,CRC发病占全组人群的第3位,其导致的死亡占第5位,造成了很大的社会经济负担[2]。对于局限性疾病,手术、放疗和化疗等标准治疗手段的疗效尚可[3],尽管如此,最终40%以上的患者会出现远处转移,目前手段对转移性CRC的治疗仍然具有挑战性。在过去几十年里,细胞毒性药物联合化疗一直是治疗晚期CRC的主要措施,为了寻求突破,人们通过化疗联合生物靶向药物来提高总生存率(overall survival,OS),尽管如此,晚期CRC的5年生存率仍然相对较低,仅为14%左右,与局部区域性CRC相比,其平均OS约为30个月,疗效不能令人满意[4]。因此,探索新的针对晚期CRC的有效药物及治疗手段显得尤为重要。rmhTRAIL(CPT)是野生型TRAIL环化变构而来,其在安全性、稳定性、溶解性及抗癌生物活性方面都表现的更佳[5]。课题组前期体外研究结果显示CPT单药及其与5-FU联用对CRC细胞增殖有明显抑制作用,并能诱导细胞凋亡[5]。实验动物模型是体外细胞实验结果向体内研究结果转化的桥梁,在癌症发生机制及药理学研究中都发挥着关键作用。皮下接种异位移植瘤模型因为其操作简单、成瘤率高及肿瘤生长快等特点,是人类研究癌症过程中最常使用的方法之一[6]。故本实验选择6周龄雌性BALB/c裸鼠,建立人CRC皮下移植瘤模型,研究CPT单药及其与5-FU联合对裸鼠皮下移植瘤的抑制作用,以期为今后临床应用CPT治疗结直肠癌提供理论依据。
1 材料与方法
1.1材 料
1.1.1实验细胞和实验动物:人CRC HCT116细胞株由联勤保障部队第九八〇医院肿瘤科实验室惠赠;体重18-22g的BALB/c裸鼠,6周龄、雌性,由北京维通利华实验动物技术有限公司购买,动物许可证为SCXK(京)2016-0011。SPF级的实验动物饲养于恒定温度和湿度的环境中,饲料及饮水均经灭菌处理,一笼5只裸鼠,每日光照12h。
1.1.2主要试剂:CPT由北京沙东生物公司馈赠;氟尿嘧啶注射液由上海旭东海普药业有限公司生产;1640培养液(Gibco)、PBS缓冲液(HyClone);FBS(胎牛血清,Gibco)、0.25%含EDTA胰酶(Sigma);TUNEL(罗氏公司)、DAPI(上海碧云天公司)、异氟烷(上海雅培制药有限公司)、激光扫描共聚焦显微镜(日本Olympus公司)、OCT冰冻切片包埋剂(美国SAKURA公司)、电子游标卡尺(美国Fisher公司)、手术器械(美国Fisher公司)。
1.2方 法
1.2.1细胞培养及建立裸鼠移植瘤模型:人CRC细胞HCT116培养于RPMI-1640培养基(含10%胎牛血清)中,并置于5% CO2、37℃及饱和湿度的培养箱内,每天换液1次,用胰蛋白酶溶液消化细胞传代。将HCT116细胞制成单细胞悬液,用细胞计数板计数,测得细胞悬液密度为5×107个/mL,于25只裸鼠右侧腋窝中部外侧皮下分别注射单细胞悬液120μL。
1.2.2实验动物分组及给药:自接种之日起,每隔1d观察裸鼠右侧腋窝接种部位皮下成瘤情况,利用游标卡尺测量裸鼠结直肠癌移植瘤的长短径,并根据公式算出肿瘤体积,公式:肿瘤体积=1/2×长径×短径2。实验分组:待皮下移植瘤大小至100-120mm3时,将25只裸鼠随机分为5组,每组5只:对照组,5-FU组,CPT组,CPT低剂量联合5-FU组及CPT高剂量组联合5-FU组,每组5只。治疗剂量及方法:对照组注射生理盐水;5-FU组每次的剂量为每只5mg/kg,采取尾静脉注射的方式;CPT单药组的剂量为每次每只7.5mg/kg,以腹腔注射的方式给药;CPT联合5-FU组,5-FU给药剂量及方式同前,CPT腹腔注射剂量为每次每只2.5mg/kg或7.5mg/kg,两药给药间隔时间为4h。每2d注射一次,一共给药10次。基于预实验结果及既往文献报道选择给药剂量以及给药方式[7]。
1.2.3观察实验动物的一般情况、测量体重及肿瘤长短径:自用药当天开始,每天观察并记录动物的精神、活动、饮食、饮水等一般表现,并观察皮下移植瘤有无红肿破溃;裸鼠体重每5d测量1次、并测量皮下移植瘤的长短径。所有动物均在用药第25天采用颈椎脱臼法迅速处死,剥离肿瘤,测量大小,称量瘤重,拍摄照片,根据公式算出第25天时的移植瘤肿瘤抑制率和体积抑制率。肿瘤抑制率=(1-实验组瘤重/对照组瘤重)×100%;肿瘤体积抑制率=(1-实验组瘤体积/对照组瘤体积)×100%。
1.2.4TUNEL/DAPI双染检测细胞凋亡:将剥除的移植瘤组织用冰冻切片机制成冰冻切片,切片的厚度3μm。按TUNEL(末端脱氧核苷酸转移酶“dUTP”介导的dUTP缺口末端标记法)/DAPI(4',6-二脒基-2-苯基吲哚二盐酸盐)试剂盒操作说明检测细胞凋亡:4%多聚甲醛常温固定切片20min,用PBS漂洗30min,细胞通透液破膜通透2min,PBS漂洗后加TUNEL反应混合液(TdT+荧光素标记的dUTP)避光孵育60min,加DAPI避光孵育5min,PBS漂洗3次后用甘油封片,用激光扫描共聚焦显微镜观察细胞凋亡情况,于400倍视野下计数凋亡细胞数,并拍照。

2 结 果
2.1CPT和5-FU对实验动物生活状态的影响:在研究进程中,给药后实验动物均一般情况良好,未出现精神萎靡、行动迟缓、不思饮食等情况;移植瘤表面未见出血及坏死,每组裸鼠均未见死亡发生。统计显示,药物对裸鼠体重的影响无统计学意义(F药物=0.174,P=0.949),时间对裸鼠体重的影响有统计学意义(F时间=150.864,P<0.001),分组和时间对动物体重影响的交互作用有统计学意义(F交互=24.648,P<0.001)。从实验开始到第10天各组动物体重逐渐增大,而从第10天到实验结束,只有对照组和CPT组动物体重小幅上升,其它组动物体重逐渐减小。见图1。

图1 CPT与5-FU联用对实验动物体重的影响
2.2CPT联合5-FU对裸鼠皮下移植瘤的生长抑制作用:人CRC裸鼠皮下移植瘤模型构建成功,重复测量的方差分析结果显示:时间和药物之间具有交互效应(F交互=118.779,P<0.001),且药物和时间对裸鼠皮下移植瘤的影响均有统计学意义(F分组=249.381,P<0.001;F时间=1577.999,P<0.001),皮下移植瘤体积随着时间的延长而逐渐增大,与其它组比较,高剂量CPT联合5-FU组移植瘤体积增大最为迟缓(P<0.01)。在各时间点与对照组比较,单用CPT或5-FU均能抑制裸鼠人CRC皮下移植瘤生长(P<0.01);当CPT与5-FU联合时,抑制人CRC皮下移植瘤的生长作用愈加显著,且以高剂量CPT(7.5mg/kg)联合5-FU组最为明显,与其它组比较差异有统计学意义(P<0.01),联合组之间比较差异也有统计学意义(P<0.01)。实验结束时,以对照组裸鼠移植瘤体积最大,而高剂量CPT联合5-FU组的肿瘤体积最小。见图2和表1。剥取肿瘤称量瘤重,统计显示:各组间差异具有统计学意义(F=38.112,P<0.001),对照组肿瘤质量最大,单药5-FU及CPT组的瘤重与对照组比较差异有统计学意义(P<0.01),但两单药组之间比较差异无统计学意义(P>0.05);联合组与单药组及对照组相比差异有统计学意义(P<0.01),而两联合组之间比较差异无统计学意义(P>0.05)。见图3、图4、表2。
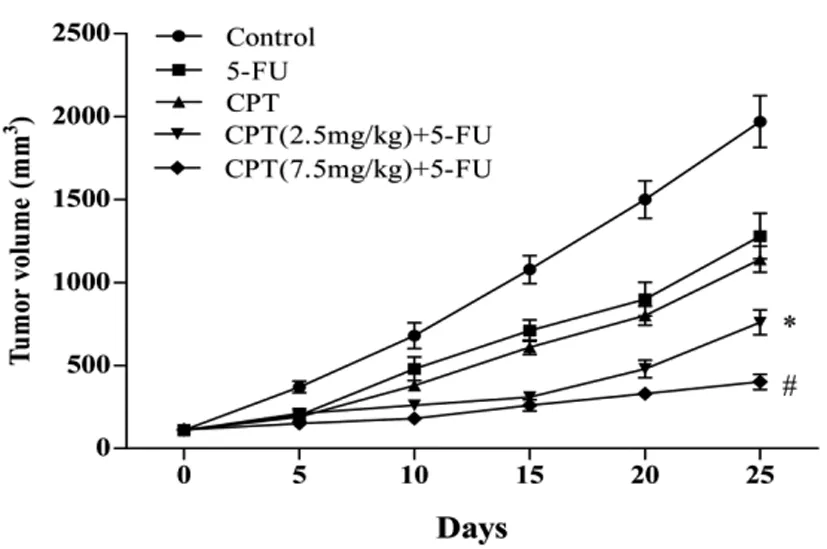
图2 CPT联合5-FU对皮下移植瘤体积的影响

图3 CPT联合5-FU对皮下移植瘤的生长抑制作用
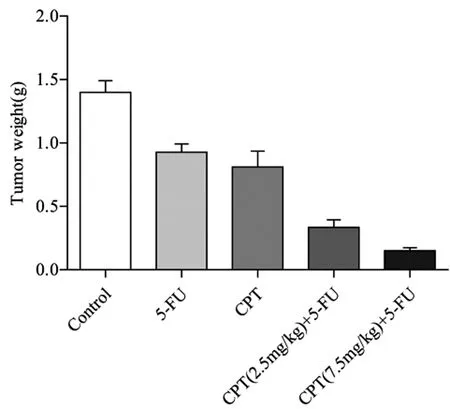
图4 CPT联合5-FU对皮下移植瘤重量的影响
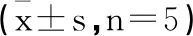
表1 实验结束时裸鼠移植瘤体积及抑瘤率
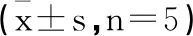
表2 裸鼠移植瘤质重及瘤重抑制率
2.3CPT联合5-FU对人CRC裸鼠皮下移植瘤细胞凋亡的影响:激光共聚焦显微镜扫描显示TUNEL/DAPI染色后CPT联合5-FU治疗的裸鼠肿瘤细胞呈绿色荧光,而未经治疗的对照组或单药CPT及5-FU组治疗的裸鼠肿瘤细胞没有显示明显的绿色荧光,表明CPT与5-FU联用诱导裸鼠皮下移植瘤细胞发生了凋亡;对凋亡肿瘤细胞数进行计数,统计显示:各组间均数差异具有统计学意义(F=201.784,P<0.001),其它组与对照组比较均有统计学意义(P<0.001),联合组与两单药组相比差异也有统计学意义(P<0.05),联合组之间比较差异也有统计学意义(P<0.05)。见图5、表3。

图5 CPT联合5-FU对皮下植瘤细胞凋亡的影响

表3 肿瘤凋亡细胞数
3 讨 论
随着分子生物学和分子诊断技术的迅速发展,科学家们认识到癌症发生不仅涉及细胞凋亡通路受阻、细胞信号转导通路异常,还可由一种或多种抑癌基因失活或原癌基因激活所引起,是一个多步骤多阶段的复杂过程。CRC发生的危险因素主要包括遗传易感性、表观遗传学改变、饮酒、高脂肪饮食、缺乏运动以及肠道黏膜的慢性炎症等[8]。从结肠腺瘤发展到CRC涉及到多个基因的缺失或突变,包括APC基因缺失、RAS癌基因突变以及抑癌基因DCC和p53的缺失等[9]。基于对癌症发病机制的深入认识,针对癌症发生发展的某个或某些靶点进行精准打击的靶向治疗在恶性肿瘤治疗中取得了很大进展,而在CRC中以靶向抗肿瘤血管生成治疗药物进展最为迅速,这类药物主要包括针对血管内皮生长因子(VEGF)和表皮生长因子受体(EGFR)的大分子单抗以及血管内皮生长因子受体(VEGFR)的小分子酪氨酸激酶抑制剂(VEGFR-TKIs)[10]。虽然靶向抗肿瘤血管生成药物在CRC治疗中取得了一定疗效,但是由于缺乏有效且可靠的预测疗效的标志物以及获得性耐药等问题,总体疗效仍不尽如人意。近几年,免疫治疗药物异军突起,给肿瘤病人带来了新的希望和治疗选择。在有高度微卫星不稳定/错配修复功能缺陷(MSI-H/dMMR)的转移性结直肠癌(metastatic Colorectal Cancer,mCRC)中,免疫治疗的疗效较传统治疗手段显著提高[11],但是,只有5%左右的mCRC患者伴有MSI-H/dMMR,而不具备MSI-H/dMMR的mCRC对免疫治疗的反应性较差。
TRAIL不同于传统的化疗药物,也不同于靶向以及免疫治疗药物,它能靶向性的杀伤肿瘤细胞,而对正常细胞没有毒性,这使它成为被寄予厚望的抗癌明星因子。CPT是由TRAIL环化变构后得到,其在稳定性、半衰期及抗癌活性等方面均强于TRAIL。我们第一次报道了CPT单药及其联合5-FU在体外能抑制CRC细胞的增殖并能诱导其凋亡。啮齿动物在生理功能和结构方面与人类相似,被认为是研究CRC良好的模型。将细胞悬液注射于BALB/C裸鼠腋下建立了CRC移植瘤模型,来评价药物的抗肿瘤活性。在本研究中,我们也成功构建了人CRC裸鼠皮下移植瘤模型,并应用CPT联合5-FU的方案治疗,观察体内抗肿瘤效果,5-FU的用量为5mg/kg,远低于临床常用剂量,且明显低于其它实验中的用量[12,13]。结果显示:各组实验动物对治疗方案耐受性良好,未出现拒食、死亡等情况,各组动物在体重上未见明显差异。单药CPT或CPT联合5-FU均能抑制CRC移植瘤生长;绘制移植瘤生长体积曲线显示与对照组相比,治疗组移植瘤的生长速度明显较慢,且以高剂量CPT与5-FU联合组移植瘤的生长最慢;称量裸鼠移植瘤的瘤重,结果显示联合治疗组裸鼠移植瘤的瘤重明显低于对照组及单药组,并且以7.5mg/kg的CPT联合5-FU组瘤重减轻最显著,这表明高浓度CPT有更强的抑制裸鼠移植瘤生长作用,与体外实验结果一致。
本研究应用TUNEL/DAPI染色法检测移植瘤细胞凋亡情况,结果显示CPT、5-FU及两者联合治疗也引起了移植瘤细胞凋亡,激光扫描共聚焦显微镜下可见代表细胞凋亡的绿色荧光,以大剂量CPT联合5-FU引起的裸鼠移植瘤细胞凋亡最明显,且与其它组比较具有统计学意义(P<0.001),这与体外实验结果一致。而两单药组之间相比细胞凋亡没有显著差异,考虑主要与用药剂量较小及机体复杂代谢环境等因素有关。本研究首次探讨CPT联用5-FU对CRC的治疗作用,有很多方面需要总结和完善,比如选择不同的CRC细胞系、尝试多种剂量组合方案、对移植瘤组织中凋亡通路有关分子进行检测等。
综上,本研究结果表明CPT单药及其与5-FU联合治疗CRC在体内也展示出了良好的抗肿瘤活性,且对实验动物无明显毒性。这为深入探索CPT联合5-FU治疗CRC提供了实验基础。

