雷帕霉素对JAK2 V617F阳性HEL细胞增殖凋亡及PD-1/PD-L1信号通路的影响
齐 林, 王 蕊, 谢旭磊, 张 朝, 成志勇, 付建珠
(1.承德医学院研究生院, 河北 承 德 067000 2.河北省石家庄市第四医院内科, 河北 石家庄 050000 3.河北省保定市第一医院血液内科, 河北 保 定 071000)
经典BCR-ABL阴性骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)主要包括真性红细胞增多症(polycythemia vera,PV),原发性血小板增多症(essential thrombocythemia,ET)及原发性骨髓纤维化(primary myelofibrosis,PMF)。约95%的PV,50%的ET和PMF患者存在JAK2 V617F突变。人红白血病HEL细胞,因其存在JAK2 V617F天然突变,故成为研究MPN的良好载体。程序性死亡受体1(Programmed Death1,PD-1)及其配体1(Programmed Death-Ligand1,PD-L1)是一对免疫共刺激因子。肿瘤细胞表达PD-L1与淋巴细胞PD-1结合,并诱导T细胞耐受并抑制其增殖,减少细胞因子分泌,同时增强调节性T细胞(Regulatory T cell,Treg cell)的功能,进而使免疫系统对肿瘤细胞的杀伤力减弱[1]。研究表明,雷帕霉素(Rapamycin,Rapa)具有抑制肿瘤的作用。哺乳类雷帕霉素靶蛋白(mammal target of rapamycin,mTOR)是PI3K/AKT通路的组成成分之一,与肿瘤细胞增殖等密切相关。但Rapa在MPN中对其肿瘤细胞表面的PD-1/PD-L1影响报道较少。本研究初步探讨了Rapa对HEL细胞PD-1/PD-L1通路以及Treg细胞的影响及相互关系,对MPN的临床诊治提供理论依据。
1 材料与方法
1.1主要药品和试剂:Rapa购自美国Targetmol公司,规格为10mg/支,批号为T1537,使用前应用二甲亚砜将Rapa配置成终浓度为10nM、50nM及100nM的溶液,-20℃保存。人红白血病细胞株HEL细胞购自中国科学院上海生命科学研究院细胞资源中心,PD-1(FITC Mouse Anti-Human CD279)、PD-L1(PE Mouse Anti-Human CD274)抗体和FITC Annexin V试剂盒购自美国BD PharmingenTM公司,CCK-8试剂盒购自北京博奥森公司,Caspase 3/7活性检测试剂盒购自上海爱必信公司,mTOR抗体购自博士德生物工程有限公司,RNA提取试剂盒购自深圳佰思珂生物公司,引物由生工生物工程公司合成,反转录和qPCR试剂盒均购自广州复能基因公司。
1.2试验方法
1.2.1细胞培养:人红白血病HEL细胞具有JAK2 V617F突变,并经定量PCR鉴定证实,是研究MPN的良好载体[2]。将HEL细胞悬浮于含10%胎牛血清的RPMI 1640培养液中,置于37℃、5%CO2的培养箱中培育,选取处于对数生长期细胞试验。选取2021年4月至6月在保定市第一医院体检的5名健康志愿者,其中男性3名,女性2名;年龄(38±11)岁,范围25~53岁。本研究获得保定市第一医院伦理委员会批准,所有志愿者均知情同意。无菌条件下留取5例健康志愿者抗凝外周血各3mL,应用淋巴细胞分离液分离淋巴细胞,使用10%胎牛血清的RPMI 1640培养液培养。
1.2.3Transwell小室细胞迁移检测:将洗涤后对数生长期密度约为1×105/mL的HEL细胞重悬于无血清的RPMI1640培养液200μL并加入上室,下室加入含10%胎牛血清的RPMI1640培养基500μL。分别加入等体积终浓度为10nM、50nM和100nM的Rapa,空白对照组加入等体积的二甲亚砜,37℃恒温箱培育24h。24h后,取下室的细胞悬液轻轻淋洗Transwell小室下壁,显微镜下计数下室细胞。
1.2.4实时荧光定量PCR(qRT-PCR)mRNA检测:收集不同处理组1×106细胞,Trizol提取各组细胞总RNA,酶标仪鉴定RNA纯度及定量。进一步反转录合成cDNA。PCR反应体系:总量为20.0μL,其中cDNA模板2μL,上、下游引物各为2μL,5×BlazeTaq qPCR Mix 4μL,ROX Reference Dye 0.1μL,ddH2O 9.9μL。扩增条件为:95℃ 30s,95℃ 10s,60℃ 30s,40个循环。根据△Ct=Ct目的基因-Ctβ-actin,△△Ct=△Ct处理组-△Ct对照组和相对表达量=2-△△Ct,计算所检测基因相对表达量,每组数据重复3次,取平均值。引物序列如下:内参基因β-actin上游引物:5′-GCG GAC ATC CGC AAA GAC-3′,下游引物:5′-AAA GGG TGT AAC GCA ACT AA-3′。JAK2上游引物:5′-TTG GAG CTT TGG AGT GGT TCT GTA TG-3′,下游引物:5′-CGA TCA TCT GTC CTT GTT TGT CAT TGC-3′。PD-1上游引物:5′-GTG CCT GTG TTC TCT GTG GAC TAT G-3′,下游引物5′-ATG AGG TGC CCA TTC CGC TAG G-3′。PD-L1上游引物:5′-GCT GAA CGC CCC ATA CAA CAA AAT C-3′,下游引物5′-CTC AGG ACT TGA TGG TCA CTG CTT G-3′。
1.2.5流式细胞术对HEL细胞凋亡检测:收集各个处理组细胞,PBS清洗2遍,应用1×Binding Buffer100μL重悬细胞,分别加入Annexin V和碘化丙啶(PI)各5μL,避光孵育15min,再加入1×Binding Buffer将体系补至500μL,上机检测细胞凋亡情况。
1.2.6流式细胞术对PD-1/PD-L1蛋白表达检测:收集不同处理组1×106细胞,分别取荧光标记的PD-1抗体0.8μL和PD-L1抗体1μL加入,加入后充分混匀,室温避光孵育15min。于室温下避光静置8-10min,离心弃上清。PBS洗涤1次,1mL PBS重悬细胞后上机检测。收集106个细胞,分别检测细胞表面PD-1、PD-L1的表达。
1.2.7流式细胞术对Treg细胞检测:收集不同组外周血单个核细胞加入荧光素标记的单克隆抗体CD3、CD4、CD8、CD25。PBS缓冲液洗涤一次,离心弃上清。加1mL Foxp3 Fixation/permeabilization 工作液,室温避光孵育40min。使用PBS洗涤2次后重悬细胞加入二抗FOXP3,室温避光孵育20min。PBS洗一次后重悬细胞,检测Treg细胞。
1.2.8Caspase 3/7活性检测:测定对硝基苯胺(p-nitroaniline,pNA)标准曲线,将10mM pNA标准品稀释成不同浓度梯度,每一梯度取100μL加入96孔板,测定405nm吸光度OD值,根据测得数据绘制标准曲线。分别收集各处理组约1×106个细胞,加于96孔板中,每组3个复孔,设立空白对照孔和实验样品孔,按100μL反应体系将细胞、Caspase 3/7底物与缓冲液配置成反应液,37℃孵育120min,酶标仪测波长405nm处的吸光值,计算测得Caspase 3/7的活性。
1.2.9Western blot蛋白检测:提取各个不同处理组细胞中的蛋白,根据蛋白定量结果,分装蛋白,将分装好的蛋白置于金属浴中95℃变性5min,配电泳胶,蛋白上样,电泳使蛋白分离,转移至PVDF膜上,1×TBST配5%脱脂奶粉,室温下封闭2h,根据一抗浓度配置溶液,4℃过夜,取出后TBST洗膜6次,5min/次,配二抗,室温下封闭2h,TBST洗3遍,化学发光液混合,应用Alpha Innotech 系统对PVDF膜进行扫描,扫描图像用灰度扫描软件进行灰度分析,取得蛋白条带灰度值,用mTOR蛋白条带灰度值与β-actin蛋白条带灰度值的比值作为其相对灰度,以相对灰度进行统计分析。

本文提出一种基于弹簧连杆机构的工具支撑型工业装配外骨骼机械臂,其核心为平行四边形弹簧连杆机构,它不仅能够支撑工具,还具有稳定工具的功能。该机械臂安装在工业装配外骨骼上,在额定载荷内,无论是有人操纵还是无人操纵,机械臂及其所支撑的工具都能达到平衡。本文结合ADAMS仿真软件,来研究此机械臂的相关性能。
2 结 果
2.1Rapa对HEL细胞活力影响:CCK-8结果显示:随着Rapa浓度增大,HEL细胞增殖抑制率呈剂量依赖性增加,不同终浓度(10nM、50nM、100nM)在72h时对细胞增殖抑制率分别为(33.33±4.6)%、(49.12±3.72)%、(55.16±4.14)%(P<0.05)。见图1。

图1 不同浓度Rapa对HEL细胞增殖抑制率影响
2.2Rapa对HEL细胞迁移的影响:不同浓度各组Rapa干预24h后下室细胞数分别为对照组4.4±0.45×104/mL,10nM组4.1±0.41×104/mL,50nM组3.85±0.41×104/mL,100nM组3.3±0.48×104/mL。100nM组与对照组相比,有统计学差异(t=2.8957,P=0.0443)。
2.3HEL细胞Caspase 3/7活性检测:不同浓度的Rapa作用HEL细胞24h后,与对照组比较,Caspase 3/7活性随药物剂量增加而升高,其中50nM组和100nM组分别与对照组相比,差异有统计学意义(P<0.05)详见表1。
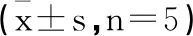
表1 不同浓度Rapa干预24h后HEL细胞Caspase 3/7活性的变化
2.4Rapa对JAK2、PD-1、PD-L1 mRNA相对表达量的影响:应用不同浓度Rapa处理HEL细胞24h后,10nM组、50nM组和100nM组中JAK2 mRNA表达量和PD-L1 mRNA表达量均较对照组降低,且成药物依赖性下降,差异具有统计学意义(P<0.05)。各组中PD-1 mRNA表达量无明显变化(P>0.05)。详见图2,表2。

表2 不同浓度Rapa作用24h后JAK2 PD-1 PD-L1 mRNA相对表达量的变化
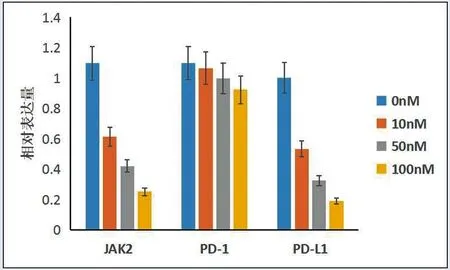
图2 不同浓度Rapa作用24h后JAK2、PD-1、PD-L1 mRNA相对表达量的变化
2.5Rapa对HEL细胞凋亡影响:不同浓度Rapa作用24h后,各组细胞凋亡率为对照组(5.9±0.6)%,10nM组(12.4±0.7)%,50nM组(26.4±0.9)%,100nM组(27.9±0.8)%。与对照组比较,10nM组、50nM组和100nM组细胞凋亡率均升高,差异具有统计学意义(F=602.17,P<0.01),且凋亡率随药物浓度升高而增加,详见图3。
图3 不同浓度Rapa作用24h后对细胞凋亡的影响
2.6Rapa对PD-1、PD-L1蛋白表达的影响:不同浓度Rapa作用24h后,10nM组、50nM组和100nM组PD-L1蛋白表达较对照组明显下降,差异有统计学意义(P<0.01),且随药物浓度增加而减低。PD-1无明显影响(P>0.05)。详见图4,表3。

图4 不同浓度Rapa作用24h后HEL细胞PD-1及PD-L1蛋白表达变化

表3 不同浓度Rapa作用24h后HEL细胞PD-1及PD-L1蛋白表达变化
2.7Rapa对Treg细胞的影响:健康志愿者淋巴细胞与HEL细胞共培养24h后,其Treg细胞较培养前明显增加(均P<0.05),但50nM组和100nM组与对照组相比,Treg细胞增量减低,差异有统计学意义(P<0.01),且成剂量依赖性减低。详见表4。
表4 不同浓度Rapa干预24h后Treg细胞的变化
2.8Rapa对mTOR蛋白影响:Rapa干预24h后,荧光强度对照组0.73±0.037,10nM组0.62±0.035,50nM组0.43±0.02,100nM组0.21±0.011。与对照组相比,10nM组、50nM组和100nM组mTOR蛋白表达水平显著降低(P<0.05),表明Rapa能够剂量依赖性抑制mTOR蛋白表达。详见图5。
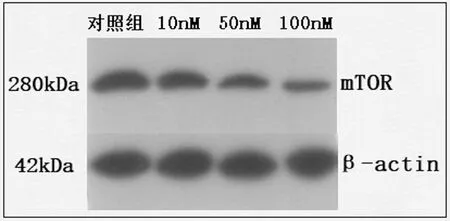
图5 不同浓度Rapa干预24h后mTOR蛋白变化
3 讨 论
半数以上的MPN患者存在JAK2V617突变,该突变可以导致Janus蛋白酪氨酸激酶2(Janus protein-tyrosine kinase,JAK2)自发性磷酸化,继而激活下游信号分子信号传导和转录激活因子(janus kinase-signal transducers and activators of transcription,JAK-STAT)STATs蛋白异常磷酸化,并同质二聚化及易位到细胞核,促进细胞持续增殖,凋亡受抑[3]。
多项研究发现Rapa兼具免疫抑制作用与肿瘤抑制作用。mTOR由mTORC1和mTORC2两部分组成。多项研究表明在各种实体肿瘤及血液系统肿瘤中存在该信号通路的不同程度活化现象。Rapa可抑制mTOR通路表达,进而抑制肿瘤生长。本研究显示,Rapa能够抑制HEL细胞增殖,并促进细胞凋亡,其原因可能与Caspase 3/7活性上调及细胞自噬增强有关。PI3K/AKT/mTOR通路是细胞中重要的信号通路之一,参与了细胞的多种生理病理活动。有学者研究显示JAK2可以模拟生长因子信号,激活PI3K/AKT/mTOR途径,从而抑制细胞自噬[4]。本研究发现Rapa能够干扰HEL细胞JAK2的表达,并与药物浓度相关。表明Rapa可能通过影响mTOR通路降低JAK2表达,并与促进HEL细胞凋亡相关。其机制可能为JAK/STAT和mTOR两通路之间存在功能干扰,即JAK2 V617F突变对mTOR通路存在激活作用,抑制mTOR通路可能对JAK/STAT通路起作用[5]。有研究表明[6]Ruxolitinib和vorinostat(组蛋白去乙酰化酶抑制剂)的联合作用,结果显示二者通过减弱JAK-STAT和AKT信号通路,诱导HEL细胞的凋亡、细胞周期阻滞和抑制HEL细胞集落形成,具有显著的协同效应。故JAK/STAT和mTOR两通路之间的功能串扰,可能成为联合用药治疗MPN的一个依据。
多种肿瘤细胞存在PD-1/PD-L1的过表达,导致Treg细胞活性增强及抗肿瘤T细胞失能,并与不良预后相关[7]。有研究已证实在MPN患者肿瘤细胞中高表达PD-1和PD-L1[8]。正常情况下,PD-1通过其配体 PD-L1发挥免疫调控作用。PD-1/PD-L1信号通路的激活可导致免疫抑制性肿瘤微环境形成,使肿瘤细胞逃避机体免疫监视和杀伤。在多数MF患者中,JAK2的激活可上调PD-1的表达并加速T细胞的耗竭。在应用JAK1/2抑制剂ruxolitinib后,能够导致T淋巴细胞的活化受到明显抑制,且降低了T淋巴细胞PD-1的表达,提示ruxolitinib可通过PD-1通路改善自身免疫环境,提高治疗效果。本研究显示早期HEL细胞表面PD-1及PD-L1均可受Rapa影响而表达下降。Rapa对PD-1和PD-L1的干扰机制尚不清楚,有研究显示结肠癌中激活的AKT/mTOR通路导致肿瘤表面PD-L1高表达,而在应用Rapa后,肿瘤细胞PD-L1的表达下调[9],本研究支持上述研究结论。此外本研究显示健康人Treg细胞比例较低,与HEL细胞共培养后所占比例升高,应用不同浓度的Rapa后,Treg细胞比例剂量依赖性下降。推测Rapa能够通过抑制mTOR信号通路参与调控了MPN患者免疫微环境。
本研究表明,Rapa能够通过抑制mTOR通路串扰JAK/STAT通路及PD-1/PD-L1信号通路进而抑制HEL细胞增殖、迁移和Treg细胞比例,促进细胞凋亡。这为Rapa联合JAK2抑制剂治疗JAK2 V617F阳性骨髓增殖性肿瘤患者提供了理论依据。

