LncRNA CYTOR靶向Wnt/β-catenin通路促进口腔鳞状细胞癌生长的机制研究
米 磊, 苗 辉, 徐 扬, 王永华, 慕彩琴, 徐建华
(陕西省榆林市第一医院口腔科, 陕西 榆林 719000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)作为头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)的主要侵袭形式,其发病率和死亡率已居世界第六位[1]。手术切除和放疗是目前治疗OSCC最有效的两种方法,但治疗效果仍不理想[2]。据癌症数据统计显示,晚期OSCC患者的五年生存率不到50%,而肿瘤的频繁复发和远处转移是导致OSCC相关死亡的主要原因[3]。因此寻找有效的OSCC早期诊断因子,甚至寻找新的治疗靶点来对抗OSCC发展都将具有重要的临床意义。长链非编码RNA(long non-coding RNA,lncRNA)是一类转录长度超过200 nt的且不具备蛋白编码功能的RNA分子[4]。在OSCC中,lncRNAs可作为抑癌基因或促癌基因参与调控OSCC细胞的生长,提示了其在OSCC中异常表达的lncRNAs可能成为诊断和治疗该疾病的重要靶标[5,6]。LncRNA CYTOR已被证实在包括胃癌和胆囊癌在内的多种癌症类型中表达异常,且可以通过调控细胞增殖、迁移和侵袭发挥促癌作用[7]。此外lncRNA CYTOR还可通过海绵miR-3148参与FOX1介导的OSCC化疗耐药。然而,lncRNA CYTOR在OSCC中的表达及具体作用仍需进一步研究。本研究以OSCC细胞为研究对象,通过观察lncRNA CYTOR对OSCC细胞增殖,迁移和侵袭的影响及潜在调控通路,旨在揭示lncRNA CYTOR在OSCC发展过程中的具体作用,以及为OSCC的靶向治疗提供新的思路。
1 材料与方法
1.1材料:人正常口腔角质形成细胞株(NHOK)和OSCC细胞株(Tca8113、CAL27、SCC9和SCC25)购买自美国ATCC;DMEM/F12细胞培养基、10%胎牛血清、1%青霉素-链霉素、0.25%胰蛋白酶、RIPA细胞裂解液和TRIzol试剂购买自美国Gibco公司;Transwell小室(8μm)和Matrigel基质胶购买自美国BD Falcon公司;CCK-8细胞活性检测试剂盒、EdU细胞增殖检测试剂盒和BCA蛋白定量试剂盒购买自上海碧云天生物科技有限公司;cDNA反转录试剂盒Prism ScriptTMRT Reagent kit和PCR荧光定量试剂盒SYBR Green qPCR Master Mix购买自日本Toyobo公司;siRNA-lncRNA CYTOR及其阴性对照siRNA-NC质粒合成自上海汉恒生物公司;一抗PCNA、Ki-67、c-myc、cyclin D1、β-catenin和GAPDH购买自美国Abcam公司;辣根过氧化酶标记的二抗购买自北京中山生物技术公司;PCR引物合成自上海生工有限公司合成;其他常见分子生物学相关试剂与耗材购买自美国Thermo Fisher Scientific公司。
1.2方 法
1.2.1细胞培养:正常口腔细胞(NHOK)和口腔鳞状细胞癌细胞(Tca8113、CAL27、SCC9和SCC25)均用含10%胎牛血清、100U/mL青霉素和100mg/mL链霉素的DMEM/F12细胞培养基进行培养。加湿培养箱条件为95%相对湿度,5%CO2和37℃。对数期生长的细胞被收集起来用于后续实验研究。后续细胞相关实验重复3次,统计结果取平均值。
1.2.2细胞转染:将CYTOR表达水平最高的CAL27细胞作为转染对象。对数期CAL27细胞按照4×105个/孔的密度接种在6孔板中,并随机分为Control组、si-CYTOR组和si-NC组。当CAL27细胞融合度达到80%以上时,利用脂质体3000转染试剂将si-CYTOR和si-NC质粒分别转染到si-CYTOR组细胞和si-NC组细胞,Control组细胞不做任何处理。转染48h后,RT-qPCR用于检测CYTOR表达以验证细胞转染效率。
1.2.3RT-qPCR实验检测细胞lncRNA CYTOR mRNA表达:通过使用TRIzol试剂从转染后的CAL27细胞中提取总RNA。经纯化后,利用cDNA反转录试剂盒Prism ScriptTMRT Reagent kit将纯化的RNA逆转录为cDNA。随后,严格按照PCR荧光定量试剂盒SYBR Green qPCR Master Mix操作说明,在ABI 7300实时PCR检测系统上实施PCR反应。以GAPDH作为内参基因,通过2-△△Ct方法对lncRNA CYTOR基因的相对表达进行统计分析。引物序列如下所示:lncRNA CYTOR引物序列,F:5′-AGAATGAAGGCTGAGGTGTG-3′和R:5′-CAGCGACCATCCAGTCATTTA-5′;GAPDH引物序列,F:5′-GAAGGTGAAGGTCGGAGTC-3′和R:5′-GAAGATGGTGATGGGATTTC-3′。
1.2.4CCK-8、克隆形成和EdU染色实验检测细胞增殖:CCK-8法:将转染后的CAL27细胞按照2×103个/孔的密度接种于96孔板中。在常规培养0、24、48和72和96h加入10μL的CCK-8溶液继续培养2h。用自动酶标仪检测各孔在450nm处的光密度(OD)以表示细胞存活率。克隆形成:将转染后的CAL27细胞按照1×103个/孔的密度接种到6孔板中常规培养2周。培养结束后先用4%甲醇固定细胞,随后用0.1%结晶紫对细胞形成的菌落进行染色。用光学显微镜观察并计数直径大于100μm的细胞集落数。EdU染色:将转染后的CAL27细胞按照2×104个/孔的密度接种在96孔板中常规培养24h。将100μL EdU溶液加入96孔板中与细胞共孵育2h,然后加入固定液继续孵育15min。细胞经PBS洗涤后,加入荧光标记的EdU反应混合物孵育30min。孵育完成后,用激光共聚焦荧光显微镜对染色细胞进行拍照观察。EdU阳性细胞比例(%)=阳性细胞数/总细胞数×100%。
1.2.5Transwell实验检测细胞迁移和侵袭:细胞通过孔径为8μm的Transwell小室进行侵袭。将转染后的CAL27细胞制成1×105个/mL的悬液并将200μL不含胎牛血清的细胞悬液填充在铺满Matrigel基质胶的上室中。下室填充600μL的含10%胎牛血清的细胞悬液。常规孵育24h后,用PBS洗涤细胞3次后,在室温下用4%冷甲醇固定细胞30min,然后用0.1%结晶紫对细胞进行染色处理15min。染色后的细胞在光学显微镜下拍照观察。在细胞迁移试验中,Transwell上室中没有Matrigel涂层,其他步骤与侵袭步骤保持一致。
1.2.6Western blot实验检测PCNA、Ki-67、c-myc、cyclin D1和β-catenin蛋白表达:通过RIPA裂解缓冲液裂解转染后的CAL27细胞后,用BCA蛋白定量分析试剂盒检测CAL27细胞提取蛋白的浓度。随后,蛋白样品经10% SDS-PAGE分离后转移到PVDF膜上。用10%的脱脂奶粉对膜蛋白进行封闭操作1.5h后,与相应的一抗PCNA(1∶2,000;ab18197;Abcam)、Ki-67(1∶1,000;ab15580;Abcam)、c-myc(1∶5,000;ab39688;Abcam)、cyclinD1(1∶5,000;ab15196;Abcam)、β-catenin(1∶5000;ab32572;Abcam)和GAPDH(1∶1,000;ab14247;Abcam)在4℃下过夜孵育,随后再与相应的二抗(1∶2,000;ab6877;Abcam)共孵育4h。用ECL化学发光检测试剂盒检测蛋白条带。收集的蛋白条带用Image J软件进行归一化和量化处理。
1.3统计学分析:采用SPSS22.0软件分析数据。采用t检验或单因素方差(one-way ANOVA)分析结果。P<0.05被认为差异具有统计学意义。
2 结 果
2.1LncRNA CYTOR在正常NHOK细胞和OSCC细胞中的表达:如图1A所示,相比较正常NHOK细胞,CYTOR在OSCC细胞(Tca8113、CAL27、SCC9和SCC25)中的表达显著升高(P<0.01)。其中,CAL27细胞中的CYTOR表达最高,因此CAL27细胞被筛选用于后续实验研究。同时,利用特异性siRNA下调CYTOR的表达。如图1B所示,相比较si-NC组,CYTOR在si-CYTOR组细胞中的表达显著降低(P<0.01),提示了细胞转染成功。上述结果表明CYTOR在OSCC细胞中的异常表达可能对OSCC发生发展产生重要调控作用。
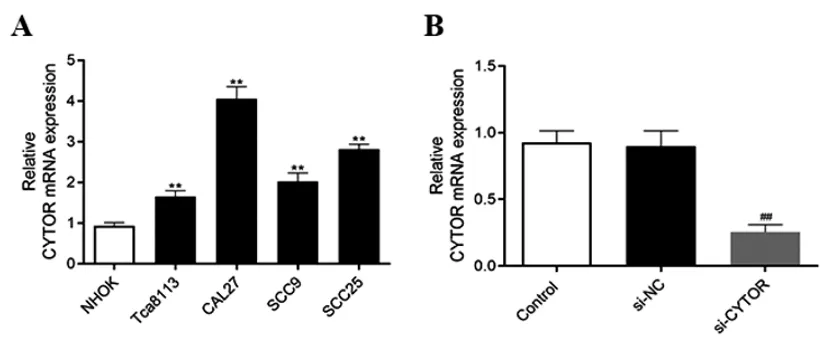
图1 LncRNA CYTOR在正常NHOK细胞和OSCC细胞中的表达
2.2下调lncRNA CYTOR表达对CAL27细胞增殖能力的影响:如图2A所示,相比较si-NC组,si-CYTOR组细胞的细胞活性明显下降。在72h时,si-CYTOR组细胞的活性相比较si-NC组细胞具有显著性差异(P<0.01)。如图2B所示,相比较si-NC组,si-CYTOR组细胞形成的集落数目显著减少(P<0.01)。如图2C所示,相比较si-NC组,si-CYTOR组EdU阳性细胞比例显著减少(P<0.01)。最后,如图2D所示,相比较si-NC组,增殖相关蛋白(PCNA和Ki-67)在si-CYTOR组细胞中的表达显著降低(P<0.01)。上述结果表明抑制CYTOR表达后,CAL27细胞的增殖能力受到明显抑制。

图2 下调lncRNA CYTOR表达对CAL27细胞增殖能力的影响
2.3下调lncRNA CYTOR表达对CAL27细胞迁移和侵袭能力的影响:如图3A所示,相比较si-NC组,si-CYTOR组细胞的迁移能力明显减弱(P<0.01)。同时,如图3B所示,相比较si-NC组,si-CYTOR组细胞的侵袭能力也明显减弱(P<0.01)。上述结果表明,抑制CYTOR表达后,CAL27细胞的迁移和侵袭能力明显下降。
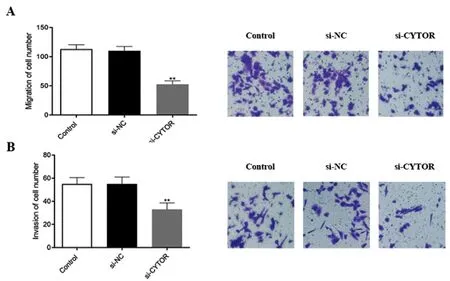
图3 下调lncRNA CYTOR表达对CAL27细胞迁移和侵袭能力的影响
2.4下调lncRNA CYTOR表达对Wnt/β-catenin通路蛋白的影响:如图4所示,相比较si-NC组,si-CYTOR组细胞中的c-myc、cyclin D1和β-catenin蛋白表达显著下降(P<0.01)。综合以上实验结果表明,抑制CYTOR的表达能有效抑制OSCC细胞生长,其机制可能与Wnt/β-catenin通路的阻断有关。

图4 下调lncRNA CYTOR表达对CAL27细胞Wnt/β-catenin通路相关蛋白的影响
3 讨 论
LncRNAs在蛋白编码基因调控中的重要性,尤其是在转录和转录后水平上对肿瘤进展的调控作用已众所周知。在OSCC中,大量的lncRNAs被检测出异常表达,这些差异表达的lncRNAs通常与肿瘤的发生、转移、预后或诊断密切相关,可作为癌基因或抑癌基因存在[8]。因此,不断发现和探讨新的lncRNAs在OSCC中的作用和调控机制对OSCC的诊断和治疗具有重要意义。
本研究首先通过PCR检测了4种OSCC细胞相比较正常口腔细胞内lncRNA CYTOR表达的差异性,结果表明lncRNA CYTOR在OSCC细胞中的表达明显升高,提示了lncRNA CYTOR可能作为原癌基因参与OSCC的发生发展。据报道,lncRNA CYTOR作为一种肿瘤相关的非编码RNA,可以调节各类癌症的病理过程。例如,Wang等[9]研究发现lncRNA CYTOR可以通过与核仁素和KH结合域相互作用,在结直肠癌的发生发展过程中发挥癌基因作用进而促进肿瘤细胞的迁移和侵袭。截至目前,国内尚无研究证明lncRNA CYTOR在OSCC中的作用。因此,为了探究lncRNA CYTOR在OSCC中的具体作用,在实验中选择了表达差异性最大的CAL27细胞用于后续体外细胞研究,同时siRNA用于下调CAL27细胞内的lncRNA CYTOR表达。细胞体外表型功能实验结果表明OSCC细胞的增殖,迁移和侵袭能力在lncRNA CYTOR基因敲除后明显受到抑制。与上述研究结果一致,本研究结果肯定了lncRNA CYTOR在OSCC进展中的促癌作用。lncRNA CYTOR在OSCC中的下游调控通路在本研究中也做了初步探索。在确定lncRNA CYTOR在OSCC中的促癌作用后,进一步检测了Wnt/β-catenin信号通路相关蛋白的表达情况。研究表明抑制lncRNA CYTOR表达能有效下调c-myc、cyclin D1和β-catenin蛋白表达。Wnt/β-catenin信号通路是细胞信号转导过程中的经典途径之一,而β-catenin的磷酸化在这一信号转导过程中起着关键作用。研究表明Wnt蛋白与细胞膜受体的相互作用可以抑制β-catenin的磷酸化,进而导致β-catenin在细胞质中积聚。过度积聚的β-catenin会进入细胞核与TCF/LEF转录因子相互作用,进而激活下游靶基因例如原癌基因c-myc和周期蛋白Cyclin D1等的表达,最终促进肿瘤细胞的恶性转移和过度增殖。目前已有大量研究证实Wnt/β-catenin信号通路的激活与OSCC的发生发展密切相关。综上所述,lncRNA CYTOR能通过激活Wnt/β-catenin信号通路促进OSCC细胞的增殖,迁移和侵袭。
结果表明了lncRNA CYTOR在OSCC发生发展过程中的促癌作用。然而,lncRNA CYTOR在OSCC中发挥作用的下游调控基因还有待进一步研究。

