病人自控静脉镇痛技术在重度带状疱疹神经痛的临床应用
带状疱疹神经痛 (zoster-related neuralgia, ZRN)是指带状疱疹病人在出疹前和出疹时出现且皮疹痊愈后仍存在的神经病理性疼痛
,呈阵发性、闪电样或刀割样疼痛,伴有触诱发痛等特点。部分病人在皮疹愈合后应用一线药物(如普瑞巴林、加巴喷丁)或(和)二线药物(曲马多等)仍不能有效控制疼痛
,严重影响其生活质量
。越来越多的文献报道神经射频、脊髓电刺激等微创介入治疗能有效控制药物疗效欠佳的ZRN
,但病人入院后因各种原因不允许即刻行微创介入治疗,如何有效控制ZRN 病人重度疼痛伴爆发痛 (breakthrough pain,BTP) 是一个临床难题。
病人自控静脉镇痛 (patient controlled intravenous analgesia, PCIA) 是一种经医护人员根据病人疼痛程度和身体情况,预先设置镇痛药物的剂量,再交由病人自我管理的一种疼痛处理技术。在临床上广泛应用于术后镇痛、癌痛等
。而目前国内外对于PCIA 应用于重度ZRN 的相关文献较少,本研究对我科应用PCIA 技术治疗入院后因各种原因不能接受微创介入治疗的重度ZRN 病人进行总结并随访,现报道如下。
方 法
1.一般资料
本研究通过浙江大学医学院附属第一医院伦理委员会审核(IIT20200194A),选取自2019 年1月1 日至2019 年12 月31 日疼痛科收治的22 例经PCIA 技术治疗重度ZRN 病人的临床资料。其中男性15 例,女性7 例;年龄50~87 岁,平均年龄(68.2±8.8)岁;平均体重指数 (body mass index,BMI) 为(22.9±3.1) kg/m
。三叉神经受累6 例,面神经受累1 例,颈神经受累8 例,胸神经受累5 例,腰神经受累2 例;ZRN 病程为(1.1±0.3)月。入组前24 h 病人爆发痛次数为每日(35.1±18.7)次,发作时数字评分法 (numerical rating scale, NRS) 评分(9.1±1.2),静息痛NRS 评分(4.1±1.0);爆发痛发作特点见表1。所有病人均同意接受PCIA 治疗,并签署知情同意书。

纳入标准:①符合ZRN 诊断,且间断性出现爆发痛,伴或者不伴有持续痛、触诱发痛;②常规药物治疗(包括抗病毒药物、加巴喷丁或普瑞巴林、非甾体消炎镇痛药、激素、弱阿片类药物等)治疗至少2 周以上,静息痛NRS 评分≥4,爆发痛次数≥每日5 次,爆发痛NRS 评分≥7;③短期内因各种原因不能接受微创介入治疗。
卢局长点头表示赞许:从案发到现在也不过20小时,就已经基本确定了死者身份与交通工具,你们的效率很高嘛。
排除标准:①不愿接受PCIA 治疗的病人;②年龄过大不能有效沟通者;③既往有阿片类药物过敏、严重的血容量不足、低氧血症等临床医师认为不适宜入组病人。
2. 治疗方案
使用PCIA 等综合治疗前后,使用简明疼痛评估量表及SF-36 量表评估病人情况,可见病人生活质量得到了明显改善(见表5、6)。使用PCIA 期间6 例病人出现阿片类药物引起的不良反应,其中2 例病人出现轻度嗜睡症状,1 例病人出现轻度嗜睡伴恶心症状,另有1 例出现轻度恶心伴头晕症状,2 例病人出现便秘症状,对症处理后上述症状均有不同程度的减轻或消失。
所有资料均取自病人病历资料、门诊和电话随访。记录病人年龄、性别、病程、BMI、受侵犯皮肤部位等一般数据。采用NRS 评分评估疼痛程度,0 为无痛,10 为难以忍受的剧烈疼痛。同时记录PCIA使用前 (T
)、PCIA使用第1天 (T
)、第2天 (T
)、第3 天 (T
)、转换为阿片类药物缓释剂后第1 天 (T
)、停用PCIA 后第1 天(T
)、出院前1 天 (T
)、出院后1 月 (T
)、出院后3 月 (T
) 的爆发痛次数和NRS 评分、静息NRS 评分、24 h 吗啡毫克当量、不良反应等。记录T
、T
、T
、T
时病人疼痛的总体改变印象 (patient global impression of change, PGIC)
。
执教《景阳冈》前,教者布置了一项独特的预习作业:用任意一种方式来概括文章的主要内容,并提供了普通的“六要素”法和创新的小剧本法。截然不同的方法既给学生提供不同水平的选择,又以创新来挑战学生的能力。没想到学生奇招频出:有的列提纲简要概括打虎前后;有的画思维导图明了故事脉络;有的编顺口溜将课文重新“包装”;更有胆量的,模仿章回小说列标题更添古韵。这是名著兴趣之门被打开的表现,这是创新性思维为语文学习“未成曲调先有情”的抵达。
3.数据收集
经过积极治疗,满足微创介入治疗条件后的病人可给予神经射频等微创介入治疗。经过综合治疗后,若病人静息痛和爆发痛NRS 评分≤3 或(和)爆发痛次数≤3 次,同时PCIA 24 h 按压次数≤3 次,直接停用PCIA;若PCIA 仍有背景持续量或者24 h按压次数≥4 次者,先将前1 天持续剂量转换为羟考酮缓释片后,逐渐停持续量,待24 h 按压次数≤3 次停用。
本系统利用STM32作为控制核心器,通过超声波模块,红外感应模块,温度传感器模块,车锁感应开关与其相连,检测判断高温情况下,车里是否有人,当温度超过一定值会发出报警信息,从而避免儿童因父母忘记遗留车上发生危险。一般情况下,车内空调等都是需要人为的去控制调节,同时要点燃发动机进行调节,而本系统的设计只需要进行车内判断有无人存在,进行自主调节,无需人员控制,极大的帮助家长的出行和确保儿童在车内的生命安全。
疼痛缓解人数及PGIC(见表3、4),所有病人疼痛均有缓解,且随时间变化,显效率逐渐上升,PGIC 均有改善。使用PCIA 期间,评估病人疼痛情况及PCIA 阿片类药物用量,将前24 h 病人PCIA使用阿片类药物总量根据等效剂量换算公式换算为口服阿片类缓释剂,其中14 例病人逐渐转换为羟考酮缓释片10~20 mg(口服,每12 h 1 次);另外8 例病人综合治疗后停用PCIA,未转换口服阿片类药物缓释剂。
4. 统计学分析
五是希望水运行业抓住平安交通建设的关键时期,不断提升水上安全保障能力,积极参与国际合作,重视海上风险的防控管理,使装备建设与治理能力相统一,参与国际海事开放合作与强化内部管理相统筹,确保海上人命安全和环境安全,为海洋强国建设提供可靠保障。
结 果
ZRN 属于一个典型的神经病理性疼痛,可表现为多种与疼痛相关的感觉症状和体征,如刺痛、灼烧痛、自发痛、感觉异常、痛觉过敏、痛觉超敏等
。Baron 等
认为不同的疼痛表型,可能涉及不同的机制,需要基于机制的个体化治疗,但目前仍缺乏统一的认识。本研究22 例病人,均表现为重度爆发痛为主的自发痛,平均年龄(68.2±8.8)岁,爆发痛NRS 评分均≥7。
T
至T
时PCIA 应用氢吗啡酮剂量和各个时间点24 h 口服吗啡毫克当量见表2。与T
相比,T
至T
各时间点BTP 次数和NRS 评分、静息NRS评分均显著下降(
< 0.05)。

疼痛缓解指标:显效:总体疼痛减轻50%及以上;有效:总体疼痛减轻30%及以上,但不超过50%;其他:总体疼痛减轻小于30%。同时于T
、T
、T
、T
、T
、T
填写简明疼痛评估量表(brief pain inventory, BPI)和健康状况调查问卷(36-item short form,SF-36)以评估疼痛对病人工作生活和睡眠等影响。
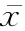


病人入院后在原治疗药物基础上对符合入组标准者签署知情同意书后启动氢吗啡酮 (hydromorphone,HM) PCIA 治疗流程,同时宣教疼痛NRS 评分和镇痛泵使用方法。氢吗啡酮(规格2 mg/ml,批准文号:H20120100,厂家:宜昌人福)。镇痛泵配置为HM 10 mg + 0.9% 氯化钠90 ml(即10 mg HM/100 ml),背景持续量为每小时0 ~0.1 mg HM,自控量每次0.2 mg~0.5 mg HM,锁定时间8~15 min。每4 h评估,12~24 h 根据疼痛控制情况、药物剂量及其相关不良反应调整剂量和参数。若疼痛仍控制不佳,爆发痛NRS 评分≥4 或次数≥5 次则自控量增加25%~30%;静息NRS 评分≥4 则持续量增加前24 h 阿片类药物总量的25%~30%。在3 天以后逐步将PCIA 滴定的阿片类药物剂量换算为羟考酮缓释片,转换方式按阿片类药物等效剂量转换表进行
,若病人应用PCIA 后出现明显不良反应且对症处理后不能好转则停用PCIA。


讨 论
17 例病人满足微创治疗条件后行微创治疗,主要包括外周肉毒素或臭氧注射治疗3 例次、胸腰段背根神经节脉冲射频术9 例次,三叉神经半月神经节脉冲射频3 例次、神经干/支脉冲射频9 例次,半植入式鞘内镇痛装置植入1 例次,短时程脊髓电刺激植入术1 例次;5 例因各种原因未行微创治疗。
那是刚到美国的时候,日子过得很苦闷。白天学英文,晚上就关在酒店看电视。偶尔会去外面学习滑旱冰,为了新片《杀手壕》进行练习。有一次休息,我跟一帮从香港来的朋友去迪士尼,大家一路走一路聊得很开心,这时候我就听到周围有人在讲国语,也是一群人嘻嘻哈哈的,抬头一看,迎面走来的竟然是邓丽君,身边也有好几个朋友一起,有男有女。我们一对看,真是特别意外,我说,怎么你也在这里?她也愣了,当时我们还不熟,身边又都有朋友,简单打了招呼,就先说拜拜了,各走各的,也没留电话。
为控制病人疼痛,本研究将PCIA 技术控制癌痛及术后疼痛的经验应用到ZRN
。与口服药物相比,PCIA 由病人自控,可实时给药、按需给药,且减少口服给药延迟,适用于病人镇痛剂量变化的需求以及昼夜变化的镇痛需求;对于爆发痛频发的病人,病人参与镇痛,减少了医务人员操作,减轻病人的心理负担
。
本研究使用药物氢吗啡酮 (HM),HM 属于阿片类受体激动剂。研究发现,HM 血浆浓度稳定,且镇痛强度约为吗啡的5~10 倍,其代谢不产生吗啡-6-葡糖苷酸,与吗啡相比,减少肾毒性
。另外,HM 通过血脑屏障的消除半衰期是18~38 分钟,低于吗啡的1.6~4.8 小时,故HM 呼吸抑制发生率更低
。Hanna 等
的一项随机双盲研究提示口服氢吗啡酮与口服吗啡治疗癌痛病人的不良反应发生率相近,不良反应中恶心占 35.3%,便秘占32.4%,呕吐占 22.1%。本研究22 例病人中出现不良反应嗜睡3 例(13.6%)、恶心呕吐2 例(9.1%)、便秘2 例(9.1%)、头晕1 例(4.5%),显著低于文献报道。比较PCIA 治疗前后病人爆发痛NRS 评分、静息痛NRS 评分、爆发痛次数均下降,差异有统计学意义(
< 0.05)。本研究的结果证实使用HM-PCIA治疗ZRN 是安全、有效的。
综上所述,PCIA 可快速缓解重度ZRN 病人的疼痛,提高病人的生活质量,且无严重不良反应发生,对于爆发痛严重或(和)疼痛剧烈的病人可作为微创介入治疗前的过渡,是一种值得考虑的治疗方式。但本研究尚存在一定的局限性,属于回顾性分析,尚未对其长远疗效进行观察,早期应用PCIA 是否能减少带状疱疹后神经痛的发生尚需进一步探索,此外本研究为单中心研究,临床样本较少、缺乏对照组,研究结果仍需多中心、前瞻性、大样本随机对照试验进一步验证。
利益冲突声明:作者声明本文无利益冲突。
[1] 中国医师协会皮肤科医师分会带状疱疹专家共识工作组. 带状疱疹中国专家共识[J]. 中华皮肤科杂志,2018, 51(6):403-408.
[2] Finnerup NB, Attal N, Haroutounian S,
. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis[J]. Lancet Neurol, 2015,14(2):162-173.
[3] Gross GE, Eisert L, Doerr HW,
. S2k guidelines for the diagnosis and treatment of herpes zoster and postherpetic neuralgia[J]. J Dtsch Dermatol Ges, 2020,18(1):55-78.
[4] 带状疱疹后神经痛诊疗共识编写专家组. 带状疱疹后神经痛诊疗中国专家共识[J]. 中国疼痛医学杂志,2016, 22(3):161-167.
[5] Madariaga MM, Villegas EF, Jimenez L A,
. Evaluation of quality of life and satisfaction of patients with neuropathic pain and breakthrough pain: economic impact based on quality of Life[J]. Pain Res Treat, 2018,2018:5394021.
[6] Jeon YH. Herpes zoster and postherpetic neuralgia:Practical consideration for prevention and treatment[J].Korean J Pain, 2015, 28(3):177-184.
[7] 刘畅, 樊碧发, 谢广伦. 自控镇痛技术在癌痛治疗中的应用[J]. 中华医学杂志, 2020, 100(37):2954-2957.
[8] 中华医学会麻醉学分会智能化病人自控镇痛管理专家共识工作小组. 智能化病人自控镇痛管理专家共识[J]. 中华麻醉学杂志, 2018, 38(10):1161-1165.
[9] Swarm RA, Paice JA, Anghelescu DL,
. Adult cancer pain, Version 3.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw,2019, 17(8):977-1007.
[10] 裴倩, 倪家骧, 郭险峰, 等. 不同频率高频重复经颅磁刺激治疗带状疱疹后神经痛的效果[J]. 中国康复理论与实践, 2019, 25(5):579-585.
[11] Colloca L, Ludman T, Bouhassira D,
. Neuropathic pain[J]. Nat Rev Dis Primers, 2017, 3:17002.
[12] Baron R, Maier C, Attal N,
. Peripheral neuropathic pain: a mechanism-related organizing principle based on sensory profiles[J]. Pain, 2017, 158(2):261-272.
[13] Peng Z, Zhang Y, Guo J,
. Patient-controlled intravenous analgesia for advanced cancer patients with pain: a retrospective series study[J]. Pain Res Manag,2018, 2018:7323581.
[14] Yang Y, Wu J, Li H,
. Prospective investigation of intravenous patient-controlled analgesia with hydromorphone or sufentanil: impact on mood, opioid adverse effects, and recovery[J]. BMC Anesthesiol, 2018,18(1):37.
[15] Sousa AM, de Santana NJ, Guimaraes GM,
. Safety profile of intravenous patient-controlled analgesia for breakthrough pain in cancer patients: a case series study[J]. Support Care Cancer, 2014, 22(3):795-801.
[16] Vandenbossche J, Richarz U, Richards HM. Repeat-dose steady-state pharmacokinetic evaluation of once-daily hydromorphone extended-release (OROS(®) hydromorphone ER) in patients with chronic pain[J]. J Pain Res,2012, 5:523-533.
[17] Felden L, Walter C, Harder S,
. Comparative clinical effects of hydromorphone and morphine: a meta-analysis[J]. Br J Anaesth, 2011, 107(3):319-328.
[18] Hanna M, Thipphawong J. A randomized, double-blind comparison of OROS (R) hydromorphone and controlled-release morphine for the control of chronic cancer pain[J]. BMC Palliat Care, 2008, 7:17.

