背根神经节P2X3R 和TRPV1 介导CFA 致炎性痛大鼠不同时期痛行为*
疼痛是临床最常见的症状,已被列为第五大生命指征
。疼痛通常由特定疾病或损伤引起,几乎所有成年人都经历过疼痛
,世界卫生组织已经将慢性疼痛列为一种疾病。新近流行病学调查结果表明,约1/3 的人经历过慢性疼痛,老年人发病率呈年龄递增趋势
。在我国,疼痛门诊中30%~40%的病人因患有慢性疼痛而就诊。炎性痛是目前临床上最为常见的病理性疼痛之一,严重干扰着人类的生活和工作,在美国每年有1.16 亿人罹患过炎性疼痛
。炎性痛伴随痛觉过敏(对伤害性刺激的反应增强)或痛觉异常(由正常无害刺激触发疼痛)现象,主要通过服用非甾体消炎镇痛药和糖皮质激素等药物治疗,然而这类药物具有多靶点特性,服用后常伴发胃肠道功能障碍、呼吸抑制、药物成瘾、慢性毒性等不良反应
。因此,明确介导炎性痛的关键分子靶点,对于精准防治炎性痛具有重要意义。研究表明背根神经节中多种离子通道的激活参与了外周痛觉敏化的形成
。DRG 神经元上表达的TRPV1 和P2X3R 作为感受外界伤害性刺激的主要受体,被认为与疼痛密切相关
,抑制DRG 中P2X3R 和TRPV1 表达可有效缓解炎性疼痛
。深入研究炎性痛大鼠不同时期健患侧痛行为变化及其外周P2X3R 和TRPV1 表达差异,有助于进一步明确介导炎性痛的关键分子靶点和干预时间节点。
方 法
1. 实验材料
实验动物:雄性Specific Pathogen Free 级健康SD 大鼠60 只,6 周龄,体重200 g,由浙江中医药大学实验动物中心提供[SYXK(浙)2018-0012]。本实验所有操作均符合浙江中医药大学实验动物管理与伦理委员会实验伦理学要求(伦理审批号:IACUC-20190715-09)。
一段视频回顾了安道麦16年发展的里程碑。在不到两年的时间里,安道麦完成了和沙隆达的合并,国际领先的制剂中心、研发中心相继投入使用。在中国的业务省份扩大到28个,新上市产品18个,直接交易客户超过700之众,公司披露2017年报表,全球销售突破220亿元,中国区同比增长41.6%,实现历史最佳业绩。视频中一张张合作伙伴与安道麦员工一起活跃在田间地头的照片引发了现场强烈共鸣。
实验仪器:
Frey hairs test 触觉纤维丝、游标卡尺、足底热辐射测痛仪(37370,意大利UGO BASILE);超声波粉碎机(JY92-2,中国宁波新芝);电泳-转印系统(美国BioRad);凝胶成像系统(Fluor Chem R,美国Protein Simple)。
实验试剂和耗材:完全弗氏佐剂(F5881,美国Sigma);P2X3R(APR016,美国Alomone);TRPV1(ACC030,美国Alomone);GAPDH(3683,美国CST);山羊抗兔IgG H&L(ab6721,美国Abcam);BCA 试剂盒(P0010,中国碧云天);ECL 试剂盒(P0018,中国碧云天)。
2. 实验方法
通过多年技术攻关与工业生产实践,进一步掌握了降低抛渣含铅的工艺过程控制参数,提高铅冶炼有价金属的回收率和直收率,降低作业成本,削减重金属排放量,公司已实现抛渣(水淬渣)含铅由2.19%降至0.44%,含锌由5.70%降至2.88%,按年产生抛渣(水淬渣)30 000 t/a计,年削减抛渣(水淬渣)含铅525 t/a、含锌846 t/a,具有较好的环境、经济效益,为公司持续健康发展提供工艺技术保障。
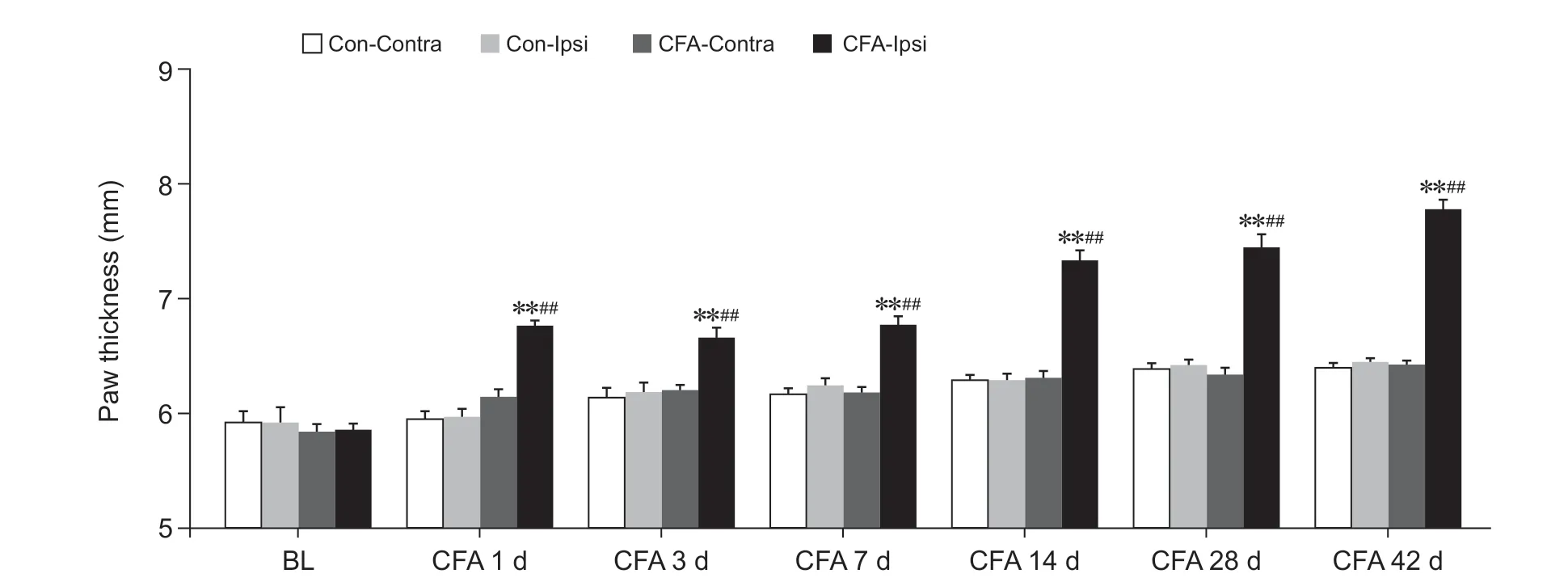
检测大鼠健患侧不同时间点足跖厚度变化评估足跖局部炎症水肿状态。如图2 所示,两组大鼠健患侧基线 (BL) 足跖厚度并无差异。与同期Con-Ipsi组相比,CFA 大鼠患侧足跖厚度于造模后各时间点均显著增厚(
< 0.01);且CFA 大鼠造模后各时间点患侧足跖厚度均显著高于CFA 大鼠健侧足跖(
<0.01);两组大鼠健侧足跖厚度于造模后各时间点无明显差异。
3. 指标检测
为使得生成的图形更加具有随机性,在线段与角度绘制时,以当前生长点方向加上或者减去随机值实现,不仅能够实现平滑侧根的目的,也实现了角度变化的随机性,使得生成图形更加逼真、自然。
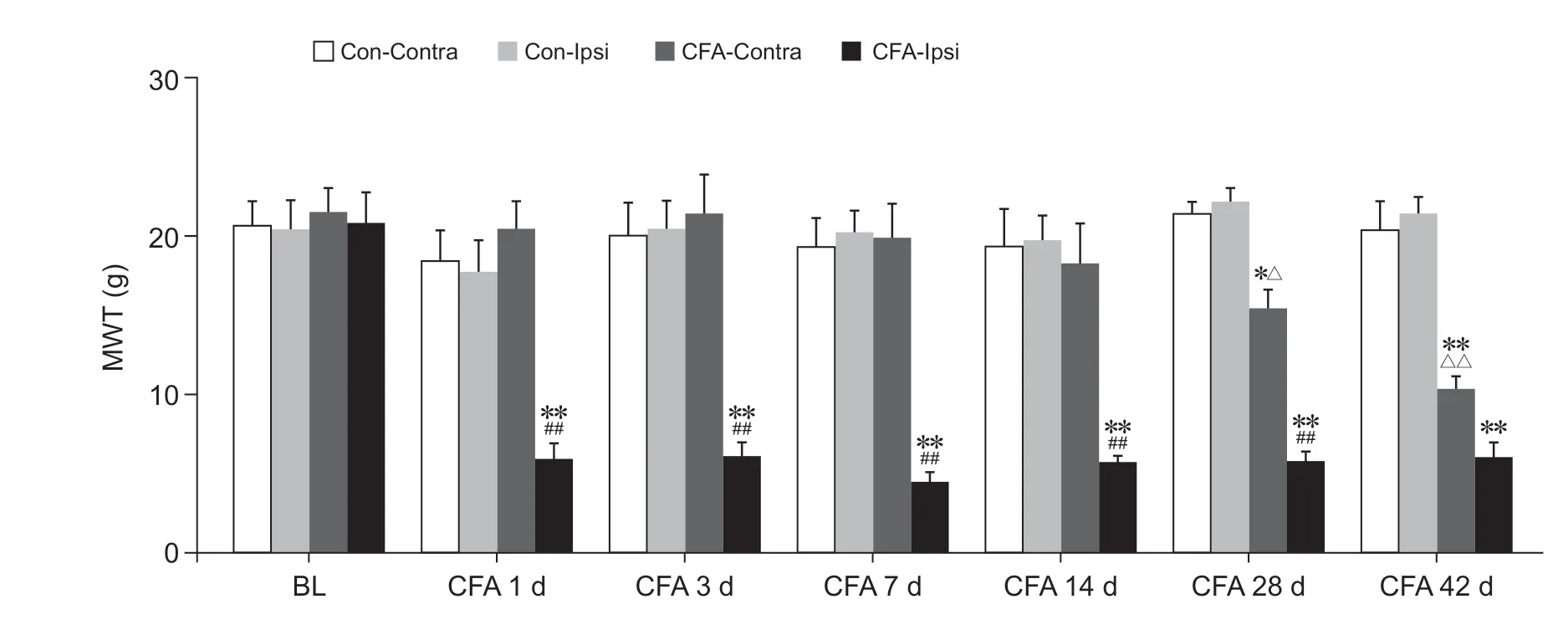
检测大鼠健患侧不同时间点足跖MWT 判定机械痛觉异常。如图4 所示,两组大鼠健患侧基础MWT 无显著差异。CFA 大鼠患侧足跖MWT 造模后各时间点均显著低于同期Con-Ipsi 组(
< 0.01);与CFA-Contra 组相比,CFA 大鼠患侧足跖MWT 于造模后1、3、7、14 天和28 天时均显著下降(
< 0.01),于造模后42 天时无明显差异;造模后28 天和42 天时,CFA 大鼠健侧足跖MWT 显著低于同期Con-Contra组与Con-Ipsi 组(
< 0.05 或
< 0.01)。
以10批护肝剂制剂指纹图谱中39个共有峰的相对峰面积为变量,运用SPSS 19.0数据统计分析软件对其进行系统聚类分析,选用组间联接聚类方法,采用欧式距离度量标准,计算样品的相似性程度,聚类结果见图3。结果显示,10批护肝剂制剂分为4类,其中样品编号2聚为一类,样品编号6、10聚为一类,样品编号4、5、8聚为一类,样品编号3、9、7、1聚为一类。结果表明护肝剂质量较为均一、稳定,不同批次间的一致性较强,为护肝剂制剂疗效的稳定提供了保证。
(2)热缩足反射潜伏期 (TWL):待实验大鼠适应环境3 天后再进行痛行为学检测。将实验组各大鼠分别置于不同的透明箱中,环境温度需维持在25±2℃内。待大鼠停止梳理毛发或舔足后,将足底热辐射测痛仪上的“十”字图案对准大鼠后足足底中央,分别用热辐射光照射大鼠左右两侧后足足底中央。开始照射时,仪器开始自动计时;大鼠出现抬腿后,仪器停止自动计时,记录的时间为大鼠的TWL。共记录5 次时间值,每次至少间隔5 min,取中位数及其前后两个数值的均值为最终热痛阈值。为了避免大鼠足跖皮肤灼伤,设置照射最长时间为20 s,最高温度为35℃。
(3)机械刺激缩足反射阈值 (MWT):待实验大鼠适应环境3 天后再进行痛行为学检测。测量时,放置大鼠方法同前。但透明箱安装于铁丝网上,方便暴露大鼠足底以供检测。从4 g 刺激强度开始,使用不同力量的
Frey 丝(0.4、0.6、1、2、4、6、8、15、26 g)垂直刺激大鼠两侧后跖足底中部,施加压力至
Frey 丝轻微弯曲“S”形并持续5 s,若大鼠出现缩腿或舔足反应则为阳性反应,记为“X”并给予相邻小一级力度的刺激;当该力度的
Frey纤维刺激不能引起阳性反应时,则记为“O”并给予相邻大一级力度刺激,每次刺激间隔30 s。当出现第1 次阳性反应后,再继续刺激4 次,记录下反应序列,按照Chaplan 等方法计算MWT
。
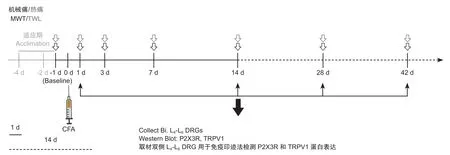
主要检测实验大鼠不同时间点足跖部厚度、TWL 和MWT 及各组大鼠双侧L
-L
DRG 中P2X3R和TRPV1 蛋白表达情况;具体检测时间点见实验流程图(见图1)。
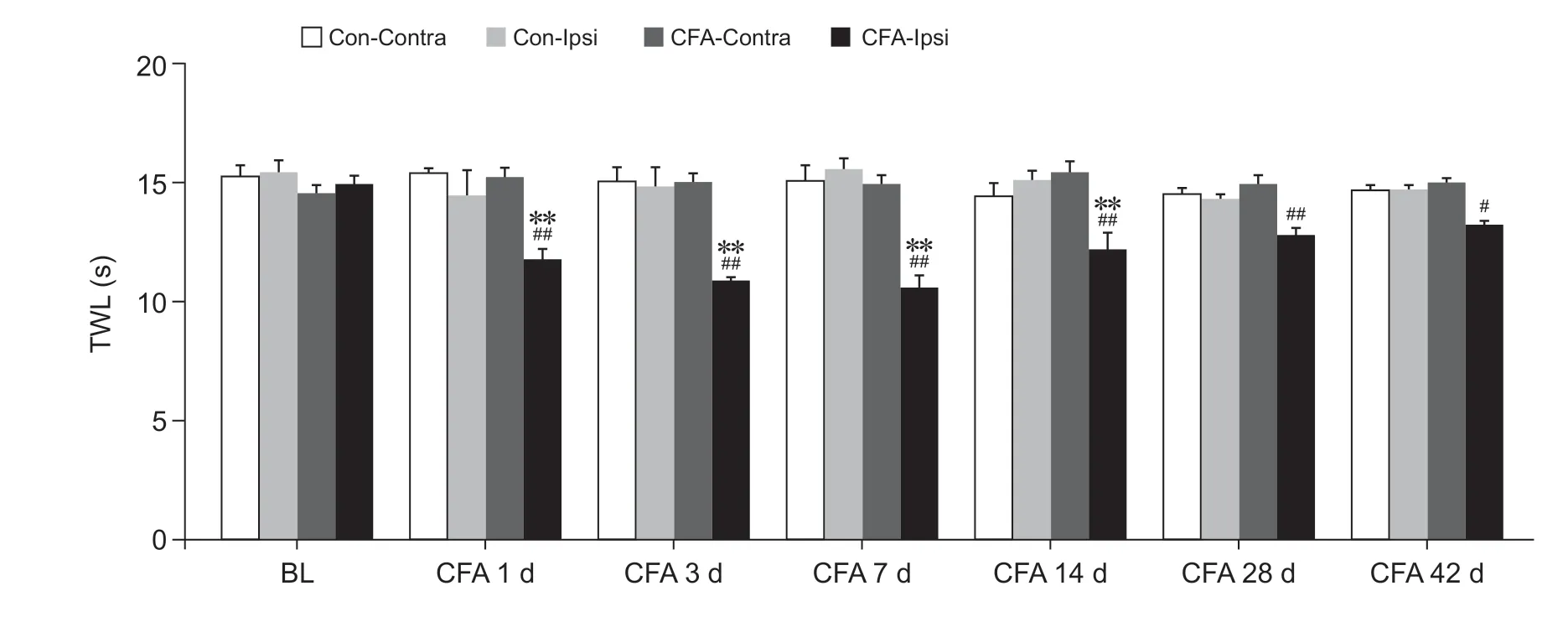
检测大鼠健患侧不同时间点足跖TWL 判定热痛觉过敏。如图3 所示,两组大鼠健患侧基础TWL无显著差异。与同期Con-Ipsi 组相比,CFA 大鼠患侧足跖TWL 于造模后1、3、7 天和14 天四个时间点均显著降低(
< 0.01),造模后28、42 天未出现统计学差异;与CFA-Contra 组相比,CFA 大鼠患侧足跖TWL于造模后各时间点均显著下降(
< 0.05或
< 0.01);两组大鼠健侧足跖TWL 于造模后各时间点无明显差异。
4. 图像和统计学分析
使用Image J 软件计算条带的灰度值,均一化处理目的与内参条带的比值作为最终统计数据。采用Graphpad 8.0 软件进行统计分析。所有计量数据均采用均数±标准误 (
±
)表示。足趾厚度和行为学数据采用Two-way ANOVA 分析,免疫印迹结果多组间比较采用One-way ANOVA 分析,两组组间采用独立样本
检验。
< 0.05 认为差异有统计学意义。
结 果
1.各组大鼠健患侧足跖厚度变化
炎性痛模型制备:炎性痛组内每只大鼠于左后足足底皮下注射 CFA 原液每只100 μl,建立炎性疼痛模型。
有学者在《解放区发展民办小学的历史考察》中对解放战争时期小学教育进行了一定的研究。解放区在革命战争激烈的环境里,掀起了发展民办小学的热潮。解放区的民办小学是在 “民办公助”方针的指引下发展起来的。这个方针的提出和当时解放区正在进行的小学教育改革分不开。民办小学的发展加快了在解放区普及小学教育的步伐,体现了普及教育中的群众路线。
2.各组大鼠健患侧TWL 变化
(4)Western Blot 蛋白检测:每组随机选择6只大鼠双侧L
-L
DRG,检测P2X3R 和TRPV1 蛋白表达情况。于CFA 造模后1 天、14 天、28 天、42 天检测完MWT、TWL、足跖部厚度后进行取材。用3%戊巴比妥钠(0.15 ml/100 g)腹腔注射麻醉大鼠,开胸暴露心脏,经左心室、升主动脉快速灌注4℃预冷的生理盐水,快速取出双侧L
-L
DRGs,置入-80℃冰箱中保存。将实验大鼠双侧L
-L
DRG裂解后提取总蛋白,测定蛋白浓度后进行蛋白变性。根据指标分子量选用8%分离胶、5%浓缩胶进行电泳,电泳后转印至甲醇激活的PVDF 膜。使用5%脱脂奶粉封闭1 h 后,分别使用1X TBST 稀释后兔抗P2X3R (1:1000)、兔 抗TRPV1 (1:1000),4 ℃孵育过夜。随后加入二抗,室温摇动孵育2 h。使用ECL 发光试剂盒显色拍片。
3.各组大鼠健患侧MWT 变化
(1)足跖部厚度 (paw thickness):实验大鼠均处于室温25℃且安静的环境中,固定大鼠的腿部使其充分暴露足跖部,使用游标卡尺分别连续读取3次大鼠健侧和患侧足跖部厚度(足背高点与足底的垂直高度),取3 次测量值均值为该足跖部厚度。
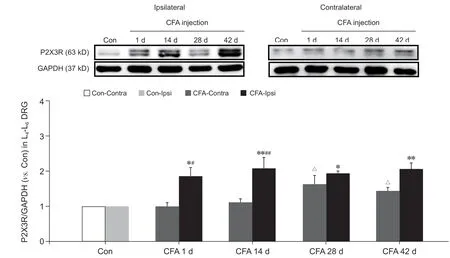
4.各组大鼠健患侧L4-L6 DRG 中P2X3R 蛋白表达情况
如图5 所示,与Con-Ipsi 组相比,CFA 大鼠患侧L
-L
DRG 中P2X3R 蛋白表达于造模后1、14、28、42 天四个时间点均明显增加(
< 0.05 或
< 0.01);造模后1 天和14 天时CFA 大鼠患侧P2X3R 蛋白表达明显高于同期CFA-Contra 组(
< 0.05 或
<0.01),造模后28 天和42 天时与同期CFA-Contra组无明显差异;与Con-Contra 组相比,CFA 大鼠健侧P2X3R 蛋白表达于造模后1 天、14 天无明显差异,但于造模后28 天、42 天时表达明显增多(
< 0.05)。
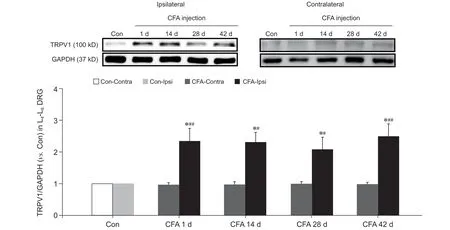
5. 各组大鼠健患侧L4-L6 DRG 中TRPV1 蛋白表达情况
如图6 所示,与Con-Ipsi 组相比,CFA 大鼠患侧L
-L
DRG 中TRPV1 蛋白表达于造模后各时间点均明显增加(
< 0.05);造模后各时间点CFA 大鼠患侧TRPV1 蛋白表达明显高于同期CFA-Contra 组(
<0.05 或
< 0.01),造模后28 天时与同期CFA-Contra 组无明显差异;与Con-Contra 组相比,CFA 大鼠健侧TRPV1 蛋白表达各时间点均无明显变化。
分组:除对照组 (Control, Con group) 外,炎性痛大鼠均行炎性痛造模处理。Con 组仅于相同足跖位置注射相同剂量0.9%氯化钠溶液。所有实验大鼠按随机数字表法分为对照组(Con group,
= 12)和炎性痛 (CFA) 组(inflammatory pain group,
= 48),其中炎性痛大鼠按照造模后4 个不同时间点分批取材,即CFA 1 天(炎性痛早期,
= 12),CFA 14 天(
= 12)、CFA 28 天(
= 12)、CFA 42 天(
= 12),后3 个时间点为炎性痛晚期;Con 大鼠于造模后42 天取材。各组大鼠一半用于检测机械刺激缩足反射阈值 (mechanical withdrawal threshold, MWT)、一半用于检测热缩足反射潜伏期 (thermal withdrawal latency, TWL) 。
讨 论
炎性痛是常见的病理性疼痛之一,主要表现为机械痛觉异常和热痛觉过敏等痛行为改变
。本研究动态观察了CFA 大鼠在炎性痛不同时期健患侧足跖痛行为差异,首次观测到CFA 造模后第42 天;并进一步研究炎性痛不同时期DRG 中P2X3R 和TRPV1 在介导健患侧痛行为中的作用差异,初步揭示CFA 致炎性痛大鼠健患侧足跖痛行为表现存在时间差异,痛相关受体P2X3R 和TRPV1 介导痛行为角色有所不同。
本研究较系统观察了造模后1 天至42 天期间CFA 大鼠健患侧足跖炎症和痛行为变化情况。CFA大鼠造模后各时间点患侧足跖厚度均明显增厚,提示CFA 大鼠患侧足跖局部炎症在较长时间内持续存在。既往研究报道
,CFA 足底注射后足跖肿胀在2~3 周内持续存在,而本研究结果提示CFA 大鼠患侧足跖肿胀可至少持续6 周。实验中还观察到CFA 大鼠患侧足跖TWL 于造模后1 天开始下降并维持较低水平,炎性痛后期有所回升。已有研究与本研究结果类似,也观察到热痛觉过敏恢复现象,然而恢复时间稍有不同
。如Cui 等
研究结果显示CFA 足底注射后引起的热痛觉过敏在31 天恢复;Zaratin 等
研究报道CFA 足底皮内注射诱导的单关节炎模型中,热痛觉过敏在21 天恢复。本研究还观察到CFA 大鼠患侧MWT 于各时间点均显著降低,提示CFA 诱发的患侧机械痛觉异常可在炎性痛早期和晚期持续存在。既往大部分炎性痛相关研究通常仅观察到CFA 造模后14 至21 天
,本研究观察至造模后6 周,更全面地呈现了炎性痛大鼠的长时程痛行为特征。CFA 诱导的痛行为特征在不同研究中有所差异,可能与其造模所用药物的成分以及注射剂量的不同有关。本研究采用大鼠左足底皮下注射100 μl CFA 原液(1 mg 结核分枝杆菌溶于0.85 ml 石蜡油和0.15 ml 甘露醇单油酸酯混合物),Cui 等
注射100 μl CFA 原液与无菌生理盐水等比例稀释混合物进行造模;Zaratin 等
则采用150 μl 以0.1%丁酸分枝杆菌为主要成分的CFA原液进行造模。研究还观察到CFA 大鼠于造模后28 天健侧足跖出现机械痛觉异常,表明CFA 大鼠在炎性痛后期出现机械镜像痛。与本研究结果相似,既往研究报道也在神经病理性疼痛、炎性痛模型中观察到机械镜像痛痛现象
。然而CFA 大鼠健侧足跖TWL与同期Con-Contra组相比无明显差异,仍高于自身患侧足跖(见图3)。高永静等
研究表明,SD 大鼠足底注射CFA 3 h 后即出现机械镜像痛,未诱发出镜像热痛觉过敏;Raghavendra 等
和Nagakura 等
也观察到此类现象,但机械镜像痛出现的时间分别为CFA 造模14 天和10 天。据此,推测CFA 致炎性痛可诱发机械镜像痛而非镜像热痛觉过敏,机械镜像痛在炎性痛早期和晚期均有报道,有待进一步研究明确。
P2X3R 和TRPV1 均是介导炎症性疼痛的关键靶点
。有研究表明,足底CFA 注射可使DRG 中小伤害性神经元中P2X3R 表达显著增多
;足跖或DRG 注射P2X3R 拮抗剂可有效拮抗炎性痛
。siRNA 转染、药理学下调或抑制DRG 神经元TRPV1表达和激活可有效缓解炎性痛
。为进一步揭示P2X3R 和TRPV1 在CFA 致炎性痛不同时期中的作用差异,本研究观察到CFA 大鼠于造模后各时点患侧DRG 中P2X3R、TRPV1 蛋白表达明显多于Con-Ipsi 组(见图5);健侧DRG 中仅P2X3R 蛋白于造模后28 天和42 天时表达明显增多(见图5),而健侧TRPV1 蛋白表达无变化(见图6)。以上结果表明,P2X3R 而非TRPV1 介导CFA 大鼠机械镜像痛的产生,但健侧DRG 中P2X3R 表达增多的内在机制尚不清楚。既往初步研究表明,抑制脊髓P2X3R 表达可缓解蜂毒诱导的镜像痛
,患侧肌肉注射P2X3R 拮抗剂A-317491 可有效缓解CFA 致咬肌炎症大鼠的机械镜像痛
。鞘内注射P2X3R 拮抗剂是否可以缓解CFA 大鼠双侧足跖机械痛觉异常尚未有相关报道。考虑到鞘内注射存在药物扩散和脊髓腔内脑脊液回流现象,不能完全排除P2X3R抑制剂扩散至对侧DRG 和脊髓背角的可能。目前本课题组正在探索单侧DRG 注射技术,相关研究结果后续将进一步予以报道。关于镜像痛的发生机制仍不清楚,有研究认为疼痛信号可通过激活患侧胶质细胞传递至健侧,增强健侧神经元的兴奋性从而诱发镜像痛;抑制脊髓和DRG 中胶质细胞活化则可缓解镜像痛
。在脊神经结扎模型中,患侧DRG 中TNF-α 分泌增加并通过脑脊液向健侧扩散,健侧DRG 中的卫星神经胶质细胞 (satellite glial cell,SGC) 被TNF-α 激活,激活的SGC 释放神经生长因子以增强伤害感受器兴奋性,从而诱导镜像痛
。Krajewski 等
的研究结果显示,在CFA 诱导的炎性疼痛模型中,双侧DRG中TNF-α表达均显著升高。Jin 等
认为TNF-α 诱导的机械痛觉异常可能由P2X3R 介导,TNF-α 可以使感觉神经元上P2X3R迅速致敏诱发疼痛。此外, CFA 大鼠患侧足跖热痛觉过敏于造模后28 天有所回升,但患侧DRG 中TRPV1 蛋白表达仍处于较高水平。究其原因,认为DRG 中TRPV1 不仅参与热痛觉过敏过程,还介导机械痛觉异常的产生
。与本研究结果相似,Xiao 等
研究观察到,CFA 诱导的热痛觉过敏在造模后14 天恢复,但患侧DRG 中TRPV1 蛋白表达在造模后28 天仍高于空白对照组;在TRPV1 敲除小鼠中CFA 或辣椒素诱导的热痛觉过敏和机械痛觉异常均得到有效缓解
。P2X3R 与TRPV1 之间存在相互作用,两者可以相互促进对方的表达进而介导疼痛
。
综上所述,CFA 诱导的炎性痛大鼠模型中,患侧机械痛觉异常可至少维持42 天,患侧热痛觉过敏同步出现,但于炎性痛后期恢复,同时造模后28天出现机械镜像痛。CFA 大鼠患侧足跖外周痛敏化发生和维持,与患侧DRG 中P2X3R 和TRPV1 蛋白表达增加有关,而机械镜像痛的产生可能与DRG中的P2X3R 有关。背根神经元P2X3R 或可成为深入研究炎性痛后期镜像痛的突破点。但本研究仅通过检测P2X3R 和TRPV1 的蛋白表达变化探索其在炎性痛维持和发生中的作用,缺乏药理学干预等方法验证,本课题组正在开展相关实验,通过干预P2X3R 和TRPV1 表达进一步探究其对炎性痛大鼠痛行为的影响。
加点准则Cpof(·)选择在可行性概率最大的地方添加试验点,选取可行试验点的效率非常高。基于两目标约束应对策略和加点准则ISCbi的代理优化算法(称为EI-PoF算法)的具体流程如图1所示。
利益冲突声明:作者声明本文无利益冲突。
[1] Rogers MP, Kuo PC. Pain as the fifth vital sign[J]. J Am Coll Surgeons, 2020, 231(5):601-602.
[2] Tracey I, Bushnell MC. How neuroimaging studies have challenged us to rethink: is chronic pain a disease?[J]. Pain, 2009, 10(11):1113-1120.
[3] Yong JZ, Ting JZ, Xiao GY,
. A survey of chronic pain in China [J]. Libyan J Med, 2020, 15(1):1730550.
[4] Rasu RS, Vouthy K, Crowl AN,
. Cost of pain medication to treat adult patients with nonmalignant chronic pain in the United States[J]. J Manag Care Spec Pharm, 2014, 20(9):921-928.
[5] Baral P, Udit S, Chiu IM. Pain and immunity:implications for host defence[J]. Nat Rev Immunol,2019, 19(7):433-447.
[6] Matsuda M, Huh Y, Ji RR. Roles of inflammation,neurogenic inflammation, and neuroinflammation in pain [J]. J Anesth, 2019, 33(1):131-139.
[7] Teixeira JM, Bobinski F, Parada CA,
. P2X3 and P2X2/3 receptors play a crucial role in articular hyperalgesia development through inflammatory mechanisms in the knee joint experimental synovitis[J]. Mol Neurobiol, 2017,54(8):6174-6186.
[8] Honda K, Shinoda M, Kondo M,
. Sensitization of TRPV1 and TRPA1 via peripheral mGluR5 signaling contributes to thermal and mechanical hypersensitivity[J]. Pain, 2017, 158(9):1754-1764.
[9] 杜俊英, 房军帆, 项璇儿,等. 基于TRPV1 和P2X3交互作用的大鼠外周痛感觉调控机制[J]. 中国实验动物学报, 2019, 27(4):485-492.
[10] 寿升芸, 魏骏骏, 何晓芬, 等. 低频电针对2 型糖尿病神经痛大鼠DRG P2X3 受体的抑制作用[J]. 中国实验动物学报, 2017, 25(1):54-59.
[11] Liu Y, Du J, Fang J,
. Electroacupuncture inhibits the interaction between peripheral TRPV1 and P2X3 in rats with diあerent pathological pain[J]. Physiol Res,2021, 70(4):635-647.
[12] Wang Y, Wang RR, Sun W,
. Analgesic eあect of dl-THP on inflammatory pain mediated by suppressing spinal TRPV1 and P2X3 receptors in rats[J]. Front Biosci-Landmrk, 2021, 26(5):1-10.
[13] Cook AD, Christensen AD, Tewari D,
. Immune cytokines and their receptors in inflammatory pain[J].Trends Immunol, 2018, 39(3):240-255.
[14] Baniasadi M, Manaheji H, Maghsoudi N,
. Microglial-induced apoptosis is potentially responsible for hyperalgesia variations during CFA-induced inflammation[J]. Inflammopharmacology, 2020, 28(2):475-485.
[15] Nasseri B, Zaringhalam J, Daniali S,
. Thymulin treatment attenuates inflammatory pain by modulating spinal cellular and molecular signaling pathways[J]. Int Immunopharmacol, 2019, 70:225-234.
[16] Cui WQ, Sun WS, Xu F,
. Spinal serotonin 1A receptor contributes to the analgesia of acupoint catgut embedding by inhibiting phosphorylation of the N-Methyl-d-Aspartate receptor GluN
subunit in complete Freund's adjuvant-induced inflammatory pain in rats[J]. J Pain, 2019, 20(1): 16.e1-16.e16.
[17] Zaratin P, Angelici O, Clarke GD,
. NK3 receptor blockade prevents hyperalgesia and the associated spinal cord substance P release in monoarthritic rats[J].Neuropharmacology, 2000, 39(1):141-149.
[18] Wang JY, Gao YH, Qiao LN,
. Repeated electroacupuncture treatment attenuated hyperalgesia through suppression of spinal glial activation in chronic neuropathic pain rats[J]. BMC Complement Altern Med, 2018, 18(1):74.
[19] Gao YJ, Xu ZZ, Liu YC,
. The c-Jun N-terminal kinase 1 (JNK1) in spinal astrocytes is required for the maintenance of bilateral mechanical allodynia under a persistent inflammatory pain condition[J]. Pain, 2010,148(2):309-319.
[20] Nagakura Y, Okada M, Kohara A,
. Allodynia and hyperalgesia in adjuvant-induced arthritic rats: time course of progression and efficacy of analgesics[J]. J Pharmacol Exp Ther, 2003, 306(2):490-497.
[21] Nuñez-Badinez P, Sepúlveda H, Diaz E,
. Variable transcriptional responsiveness of the P2X3 receptor gene during CFA-induced inflammatory hyperalgesia[J]. J Cell Biochem, 2018, 119(5):3922-3935.
[22] Raghavendra V, Tanga FY, Deleo JA. Complete Freunds adjuvant-induced peripheral inflammation evokes glial activation and proinflammatory cytokine expression in the CNS[J]. Eur J Neurosci, 2004, 20(2):467-473.
[23] Shimizu K, Guo W, Wang H,
. Differential involvement of trigeminal transition zone and laminated subnucleus caudalis in orofacial deep and cutaneous hyperalgesia: the eあects of interleukin-10 and glial inhibitors[J]. Mol Pain, 2009, 5:75.
[24] Xiang H, Liu Z, Wang F,
. Primary sensory neuron-specific interference of TRPV1 signaling by AAV-encoded TRPV1 peptide aptamer attenuates neuropathic pain[J]. Mol Pain, 2017, 13:1744806917717040.
[25] Jiang Q, Li WX, Sun JR,
. Inhibitory eあect of estrogen receptor beta on P2X3 receptors during inflammation in rats[J]. Purinerg Signal, 2017, 13(1):105-117.
[26] Warwick CA, Shutov LP, Shepherd AJ,
. Mechanisms underlying mechanical sensitization induced by complement C5a: the roles of macrophages, TRPV1,and calcitonin gene-related peptide receptors[J]. Pain,2019, 160(3): 702-711.
[27] Wang Y, Wang RR, Sun W,
. Analgesic eあect of dl-THP on inflammatory pain mediated by suppressing spinal TRPV1 and P2X3 receptors in rats[J]. Front Biosci-Landmrk, 2021, 26(5):1-10.
[28] Tariba Kneževićp, Vukman R, Antonić R,
. The role of P2X3 receptors in bilateral masseter muscle allodynia in rats[J]. Croat Med J, 2016, 57(6):530-539.
[29] Ohara PT, Vit JP, Bhargava A,
. Evidence for a role of connexin 43 in trigeminal pain using RNA interference in vivo[J]. J Neurophysiol, 2008, 100(6):3064-3073.
[30] Huang XZ, Tu WF, Peng J,
. Eあect of preemptive local injection of ropivocaine with dexmedetomidine on mirror pain in rats and its mechanism[J]. Asian Pac J Trop Med, 2015, 8(10):836-840.
[31] Inglis JJ, Nissim A, Lees MD,
. The differential contribution of tumour necrosis factor to thermal and mechanical hyperalgesia during chronic inflammation[J]. Arthritis Res Ther, 2005, 7(4):R807-816.
[32] Krajewski JL. P2X3-containing receptors as targets for the treatment of chronic pain[J]. Neurotherapeutics,2020, 17(3):826-838.
[33] Jin Y, Wei S, Liu TT,
. Acute p38-mediated enhancement of P2X3 receptor currents by TNF-α in rat dorsal root ganglion neurons[J]. J Inflamm Res, 2021,14:2841-2850.
[34] 周开升, 赵光海, 南伟, 等. TRPV1 通道在病理性疼痛中的研究进展[J]. 中国疼痛医学杂志, 2021,27(11):841-850.
[35] Hu M, Doyle AD, Yamada KM,
. Visualization of trigeminal ganglion sensory neuronal signaling regulated by CDK5[J]. Cell Rep, 2022, 38(10):110458.
[36] Xiao X, Zhao XT, Xu LC,
. SHP-1 dephosphorylates TRPV1 in dorsal root ganglion neurons and alleviates CFA-induced inflammatory pain in rats[J]. Pain,2015, 156(4):597-608.
[37] Cavanaugh DJ, Chesler AT, Jackson AC,
. TRPV1 reporter mice reveal highly restricted brain distribution and functional expression in arteriolar smooth muscle cells[J]. J Neurosci, 2011, 31(13):5067-5077.
[38] Lu KW, Hsu CK, Hsieh CL,
. Probing the eあects and mechanisms of electroacupuncture at ipsilateral or contralateral ST36-ST37 acupoints on CFA-induced inflammatory pain[J]. Sci Rep-UK, 2016, 6:22123.

