基于血药浓度监测普瑞巴林治疗带状疱疹后神经痛的临床观察 *
带状疱疹后神经痛 (postherpetic neuralgia, PHN)是指带状疱疹 (herpes zoster, HZ) 皮疹愈合后持续1个月以上的疼痛。是带状疱疹最常见的后遗症,多发生于高龄、免疫功能低下的病人,严重影响病人生活质量
。目前主要采用钙离子通道调节剂及射频等微创介入方式进行治疗。既往研究
显示,尽管单独使用钙离子调节剂,或采用药物与射频联合治疗,可有效缓解部分PHN 病人的症状,但仍有一些病人疼痛难以有效控制或不良反应无法耐受,需要不断的调整治疗方案
。
血药浓度测定是临床上调整治疗方案重要的指导工具,尤其是测定治疗的基线稳态浓度和调整治疗后的浓度变化
。普瑞巴林为新型钙离子通道调节剂,血药浓度变化呈线性,具有良好的可预测性
,是治疗PHN 的一线药物。但其血药浓度的研究和应用目前主要集中在抗惊厥治疗
。对于普瑞巴林血药浓度测定在神经病理性疼痛诊疗中的运用,目前尚未见报道。本研究通过观察一组PHN 病人实际治疗过程中的效果与血药浓度的变化,探讨普瑞巴林血药浓度监测在神经病理性疼痛诊疗中的作用。
方 法
1.一般资料
本研究通过中日友好医院医学伦理委员会审核(2019-171-K117),选 取2018 年12 月 至2020 年1 月就诊于中日友好医院疼痛科,符合入选标准的PHN病人149 例纳入本研究。
纳入标准:参照《带状疱疹后神经痛诊疗中国专家共识》
:①年龄 > 18 岁;②符合PHN 的诊断标准,病程在皮疹愈合后3 个月以内;③疼痛分布区域符合神经解剖特点;④疼痛为持续或反复发作的瘙痒性、灼烧性、针刺样、刀割样、电击样或搏动样疼痛;⑤病变部位皮肤感觉异常(如蚁行感、紧束感等);⑥未使用过钙离子通道调节剂。
排除标准:①合并严重心脑血管疾病、血液系统疾病、恶性肿瘤、肝肾等重要脏器功能障碍者;②体重< 40 kg,或> 90 kg 者;③妊娠期妇女;④局部皮肤过敏或有其他严重皮肤疾病者;⑤合并重大精神疾病、认知障碍等无法配合者;⑥对本研究所使用药物过敏。
2. 治疗方法(见图1)
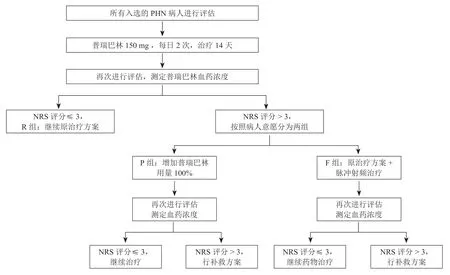
所有入组病人首先采用数字评分法 (numerical rating scale, NRS) 评分进行疼痛量化评分,记录年龄、病程及累计部位等指标。
本研究纳入的头部PHN病人为三叉神经支配区域疼痛。其脉冲射频治疗
病人取平卧位,肩部垫薄枕头,头部稍后仰,标记穿刺点为嘴角旁开2.5 cm。C 形臂X 线透视定位,局部麻醉后穿刺至卵圆孔,经电生理测试无误后(测试采用50 Hz、0.2 V 刺激,能诱发相应神经支配区域异感)。使用射频疼痛治疗仪(Cosman G4 射频仪,波士顿科学,美国),给予脉冲射频治疗。脉冲射频参数频率2 Hz,脉宽20 ms,维持温度42℃,持续600 s。治疗14 天后,再次进行疼痛量化评估,记录药物不良反应,测定普瑞巴林的血药浓度。
第二阶段治疗:根据NRS 评分情况将病人分为三组:将NRS 评分≤3 的病人归入常规药物组(R组,66 例);NRS 评分 > 3 的病人(83 例)按照病人意愿分为两组:增强药物组(P 组,37 例)和射频治疗组(F 组,46 例)。R 组病人继续原治疗方案2 周后,开始逐步停药。P 组将普瑞巴林治疗量增加100%(每日2 次,每次300 mg);F 组在原治疗方案的基础上,行选择性神经根脉冲射频。
另外,tPA和纤溶酶原都有结合纤维蛋白的特性。在tPA特异性溶栓的过程中,纤维蛋白具有双重功能,既参与激活纤溶酶原又作为提供形成纤溶酶的最终底物。tPA诱导裂解纤维蛋白血凝块的过程可分为缓慢相和快速相。在缓慢相中,单链tPA在完整的纤维蛋白表面激活纤溶酶原变为纤溶酶;在快速相中,纤维蛋白部分被纤溶酶降解并暴露出更多的可以结合纤溶酶原和tPA的位点,同时纤溶酶将单链tPA裂解为活性更高的双链tPA,又有纤溶酶原不断被激活产生纤溶酶。这样,tPA和纤溶酶原及纤维蛋白形成1个环状三元复合物,使溶栓效应以正反馈形式扩大[2,29]。
尽管现阶段临床治疗慢性心力衰竭这类疾病已经取得了较大进展,并且在患者住院治疗期间也可以通过优质的护理缩短患者的康复时间以及降低患者住院费用,但是在患者出院后的护理工作却相对空白,进而导致患者再住院率也越来越高。延续性护理模式作为一种新型的护理模式,将其与中医辨证相结合,然后应用到慢性心力衰竭出院患者护理过程当中,通过中医疗法进行辨证,然后从饮食、心理、行为、康复护理等多个方面进行干预。研究结果表明,应用延续护理模式联合中医辨证护理的观察组患者的,其心理状态评分、不良事件发生率以及再住院情况均优于采用常规护理干预的对照组,组间对比,差异有统计学意义(P<0.05)。
由于农民环保意识不强、秸秆回收成本较高、政府财政资金支持不足以及相关产业发展滞后等原因,秸秆焚烧难以禁止。要从根本上解决秸秆禁烧难的问题,必须坚持“疏堵结合、以疏为主”的思路。
与传统都是使用定价的估算方法,很多电力单位并不重视工程量清单计价方法的运用。以至于在实际运用的过程中,执行力非常的弱。导致这种情况出现的原因非常的多,其一,工程量清单计价的方法比较复杂,它涉及到整个工程的各方面支出。大多数电力单位为了方便可能不顾及出现的突发情况,过于简单的使用定价估算方法。其二,部分电力单位过度重视基础设施的建设而根本不重视其中的造价估算问题,而且他们本身也不擅长于这方面的操作,就很难形成严谨的工作流程,自然也就无法很好的执行相关事宜。
第一阶段治疗:所有病人给予口服普瑞巴林(乐瑞卡,辉瑞,美国)150 mg,每日2 次。治疗14 天后,进行疼痛量化评估,记录药物不良反应,同时测定普瑞巴林的血药浓度。
补救措施:经过两个阶段治疗后,NRS 评分仍无法达到3 以下,口服曲马多100 mg,q12 h 予以补救;所有病人在治疗过程中出现无法耐受的不良反应时,予以更换治疗药物。
本研究主要终点为疼痛量化评分(NRS 评分≤3),次要终点为补救措施的使用情况。如治疗过程中病人出现无法耐受的不良反应,则立刻退出研究。
据石林测定的年代与黔桂地区25万年来气候冷暖波动规律对比,目前贵州所见之石林当主要形成于11.3kaB.P.,129.3kaB.P.及242.5kaB.P.三个年龄值之间的两次冰期—间冰期气候旋回中。石林中倒塌的石柱、石柱顶部的“漂来石”以及岩块构建天然桥等冰雪作用的遗迹,当主要形成于晚大理冰期(约为40ka-11.3ka)。两次冰期—间冰期旋回中的冷暖过渡阶段,是地表地下径流由弱到强急剧变化的阶段,其强烈的冲刷有力促进了土下石林向地表石林的转化。石柱表面,特别是剑状石林石柱表面尖棱状、刃脊状的竖向溶痕,当主要形成于晚更新世后期及全新世以来的亚热带气候环境。
3.评价指标
(4)统计所有病人药物治疗或微创介入治疗的不良反应。
(三)第三人干扰婚姻关系的行为使无过错配偶的人格利益被侵害。台湾民法学者王泽鉴认为“婚姻者,系男女双方以终身共同生活为目的而组成特别结合关系,夫妻当事人一方对于婚姻关系之圆满,寓有人格利益。因此,干扰他人婚姻关系者,不但侵害了被害人之身份或亲属权、而且也侵害了被害人之人格利益、实无疑问。”
(2)记录所有病人各个时间点的疼痛NRS 评分及治疗过程中的不良反应。采用NRS 评分
评估疼痛强度,0 分为无痛,1~3 分为轻度疼痛,4~6分为中度疼痛,7~10 分为重度疼痛。
(3)普瑞巴林血药浓度测定
:采用超高效液相色谱-串联质谱法 (HPLC-MS/MS) 进行血药浓度的分析。高效液相色谱法具有优越的定性与定量功能,专属性强,灵敏度高。
(1)收集所有病人的基本信息,包括性别、年龄、带状疱疹的部位、患病时间等。
脉冲射频:颈段、胸段和腰段病人均按疼痛范围确认目标神经根,通过C 形臂X 线透视定位,找到目标神经根相对应的椎体节段。局部麻醉下穿刺至椎间孔外口处。经造影剂、电生理测试无误后(运动测试采用2 Hz、0.3~0.5 V 刺激,能诱发相应神经根支配区域肌肉抽动;感觉测试采用50 Hz、0.3~0.5 V 刺激,能诱发相应神经根支配区域异感),使用射频疼痛治疗仪(Cosman G4 射频仪,波士顿科学,美国),给予脉冲射频治疗。脉冲射频参数频率2 Hz,脉宽20 ms,维持温度42℃,持续600 s。
4.统计学分析
结 果
1.一般资料
收集149 例PHN 病人资料,未出现因无法耐受的不良反应退出研究的病人。所有病人的体重在(44~87) kg 之间,平均65.9 kg,呈正态分布。病人年龄、体重、性别、病程及患病部位见表1。
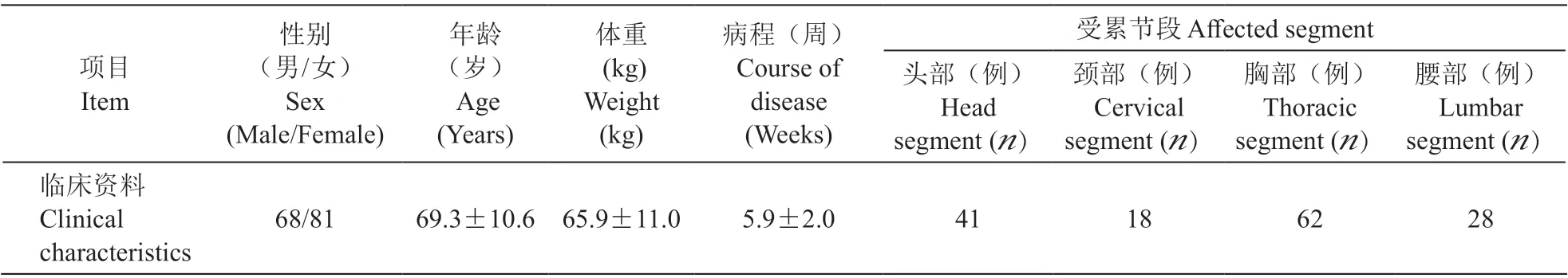
2. 病人治疗情况分析
羊膜腔穿刺适宜孕16~20周的孕妇。有些孕妇或家属可能会对羊膜腔穿刺术的安全性有疑虑,但是据统计,此项技术造成的流产率仅为0.5%。除羊膜腔穿刺术外,进行产前诊断的技术还有绒毛活检、胎儿脐静脉穿刺、胎儿镜检查等。
3. 病人治疗过程中各时间点的普瑞巴林血药浓度
本研究中194 例病人接受第一阶段治疗后,进行NRS 评分并测定普瑞巴林血药浓度。NRS 评分 > 3病人的普瑞巴林血药浓度为 (2252.33±1308.91) μg/L,明显低于NRS 评分≤3 病人的血药浓度(
< 0.01,见表3)。在治疗后NRS 评分≤3 的病人中,R 组和P 组普瑞巴林血药浓度高于F 组病人(
< 0.05)。P 组病人的血药浓度较第一阶段治疗后有明显的提升(
< 0.05),但仍低于R 组,二者之间比较差异无统计学意义(
> 0.05,见表3)。
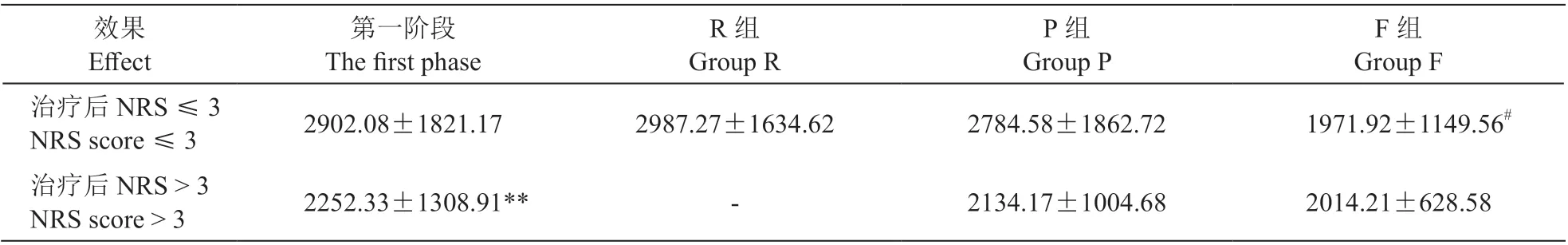
4.各组病人NRS 评分与普瑞巴林血药浓度
经过第一阶段治疗,NRS 评分> 3 的病人的平均NRS 评分为4.95±0.77,普瑞巴林的血药浓度为(2252.33±1308.91) μg/L。进入第二阶段,出于对增加剂量后不良反应的考虑,有46 例病人选择进入F 组,其余37 例病人进入P 组。治疗后,P组和F 组的NRS 评分明显降低,分别为2.81±0.52和2.68±0.74 (
< 0.05),但二者之间无显著性差异(
> 0.05,见表4)。P 组总体的普瑞巴林血药浓度上升至 (2759.55±1810.88) μg/L,明显高于治疗前及F 组(
< 0.05),F 组的血药浓度无明显变化(
> 0.05)。
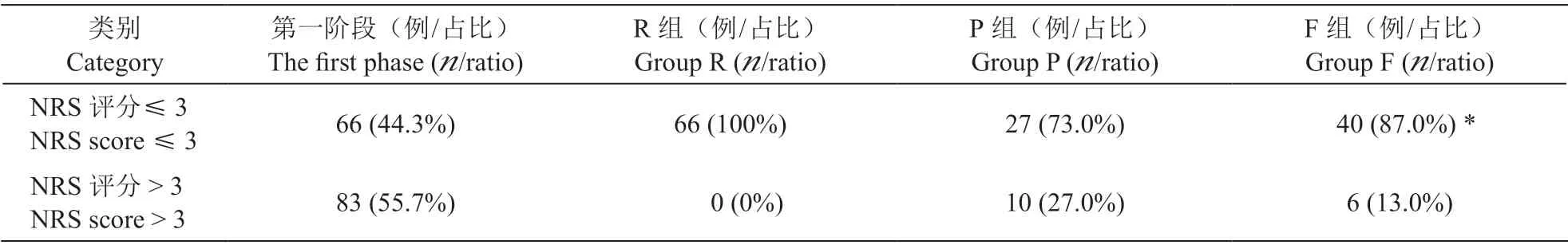
治疗前病人NRS 评分为6.81±1.12,经过第一阶段治疗后,NRS 评分降至3.85±1.27 (
< 0.01)。其中,NRS 评分≤3 的病人68 例,NRS 评分 > 3的病人83 例。第二阶段治疗后,P 组病人NRS 评分降至2.81±0.52。其中,NRS 评分< 3 的病人27例,占所有入组病人的73.0%,F 组NRS 评分降至2.68±0.74。其中,NRS 评分< 3 的病人40 例,占所有入组病人的87.0%,明显高于P 组(
< 0.05,见表2)。最终共有16 例病人NRS 评分> 3 分(P组10 例;F 组6 例),给予口服曲马多100 mg,q12 h 予以补救,占所有入组病人总数的10.7%。

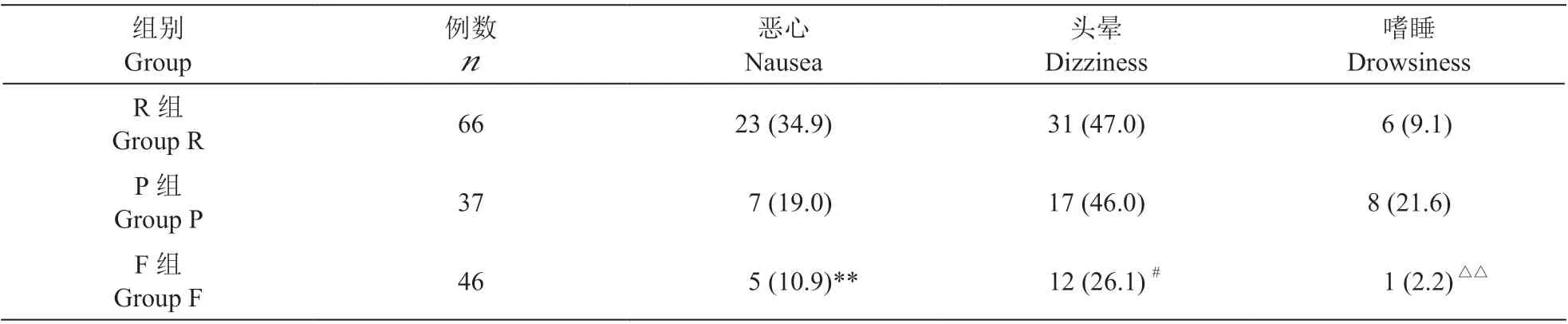
5. 不良反应
纳入病人出现的不良反应主要为恶心、头晕和嗜睡,未出现围手术期的并发症及无法耐受的不良反应。三组出现各种不良反应共计69 例病人,其中R 组34人 次(51.5%);P 组19 人 次(51.4%);F 组12 人 次(26.1%)。与R 组相比,F 组的恶心和头晕发生率更低;与P 组相比,F 组嗜睡的发生率更低(见表5)。
西雅图通过收集并分析从市区建筑物管理系统中得来的众多数据集,通过预测分析,找出哪里可以减少能源使用,或者根本不需要使用能源。项目的目标是将该地区的电力消耗减少25%。
讨 论
带状疱疹后神经痛(PHN)是带状疱疹最主要的并发症,属于典型的神经病理性疼痛。其发病机制复杂,包含中枢机制和外周机制,涉及神经源性炎症、神经兴奋性增高、神经可塑性的变化和交感神经系统异常等多种病理生理变化
。目前,临床上多采用离子通道药物、脉冲射频等方法单独或联合治疗PHN
。在本研究中,观察了一组PHN 病人的实际治疗过程,结果显示入组病人经过第一阶段14 天的药物治疗,NRS 评分下降40%。其中,44%的病人疼痛NRS 评分降至3 以下。说明普瑞巴林可以有效降低PHN,其机制可能是通过减少Ca
内流,减少兴奋性神经递质的释放,达到抑制神经元兴奋性,进而发挥控制神经病理性疼痛的作用
。这与既往的多项随机对照研究相一致
。第二阶段,将NRS 评分> 3 的病人按照病人的意愿归入P 组和F 组进行治疗。结果显示P 组通过增加药物剂量至每日600 mg,使73.0%的病人NRS 评分降至3 以下;F 组则使87.1%的病人疼痛明显缓解(NRS 评分 < 3),表明无论是增加普瑞巴林的治疗量,还是使用脉冲射频与普瑞巴林的联合治疗,均可以提升PHN 的治疗效果。脉冲射频治疗的机制
可能是高能脉冲电流及其产生的场效应,刺激了DRG 细胞,干扰了神经信号通路,引起神经突触的膜电位改变,从而影响了突触信号传导,逆转了突触传导异常增强的效应,达到减轻PHN 引起疼痛的目的,也降低了药物的使用量。
在本研究中,全程使用了普瑞巴林进行治疗,同时监测了病人的血药浓度。普瑞巴林作为治疗PHN 的一线治疗药物,具有口服生物利用度与剂量及给药次数无关,血药浓度-时间曲线与给药模式无关
,高度的可预测性及线性药代动力学等特征
,本研究验证了这一结果。无论是第一阶段,还是P 组第二阶段的治疗,随着给药剂量的提升,血药浓度也随之提升,治疗的效果明显增加,显示出较明确的血药浓度-效果的关系。既往的研究
提出,普瑞巴林吸收迅速,入血后蛋白结合率低,具有较低的个体变异性,且血药浓度-效果的关系不明确,存在上限效应
,但本研究展示了不同的研究结果。在第一阶段采用每日300 mg 普瑞巴林治疗后,进行了血药浓度测定,显示治疗效果较好(NRS 评分 ≤3)的病人,其血药浓度明显高于治疗效果欠佳病人(NRS 评分 > 3)。这可能与病人的年龄、体重及肾脏的排泄功能有关
。老年病人的肾功能降低,会导致剂量-血药浓度曲线出现变化,降低浓度-效应关系
。另外,普瑞巴林在临床治疗过程中,可能因多种因素的影响,导致血药浓度偏低,从而影响治疗效果。第二阶段P 组病人的治疗也证实了这一点:通过增加普瑞巴林治疗剂量,提高病人的血药浓度,提升治疗效果,显示正常治疗所需血药浓度与治疗效果之间确切的因果关系。这也与多项临床研究
相一致,即普瑞巴林在PHN 的治疗中具有良好的疗效。但使用单一药物治疗时,治疗效果仍有较大的差异,需要不断调整治疗方案改善治疗效果。
既往的研究表明,普瑞巴林不受肝脏代谢的影响,不诱导或抑制肝酶,也不参与药代动力学药物相互作用
,治疗剂量的稳态血药浓度范围为18~52 μmol/L (2.8~8.2 μg/ml)
。这些数据主要来自于健康受试者或癫痫病人的研究。针对PHN等神经病理性疼痛治疗的普瑞巴林血药浓度的研究未见报道。本研究在第一阶段治疗中,观察了口服普瑞巴林每日300 mg 病人的血药浓度,所有NRS评分≤3 病人的平均血药浓度为2.90 μg/ml,与其他研究中测得的稳态血药浓度相一致
。而NRS评分> 3 病人的血药浓度平均为2.25 μg/ml,明显低于正常范围的稳态浓度。因此,在本研究的第二阶段我们针对镇痛效果欠佳的病人,采用增加普瑞巴林的用药剂量或联合脉冲射频进行治疗。当普瑞巴林的用量提升至每日600 mg 后,血药浓度上升至2.8 μg/ml,疼痛缓解率明显提升。但不良反应率也随之增高,提示不良反应与血药浓度可能存在一定的相关性。整个治疗过程的不良反应主要是头晕、恶心和嗜睡,其发生率分别为R 组51.5%;P 组51.4%;F 组26.1%,均为轻度至中度。这一结果与其他研究相一致
。而采用联合治疗的数据显示,多靶点联合治疗,虽然测得的普瑞巴林血药浓度最低,但87.0%的病人治疗后NRS 评分降至3 以下,说明联合治疗可获得良好的疗效,尤其是针对血药浓度远低于正常稳态血药浓度的病人
。联合治疗组未出现围手术期并发症,普瑞巴林不良反应也较少,病人治疗体验明显提升。
综上所述,普瑞巴林的血药浓度与PHN 的治疗效果呈现一定的相关性。在血药浓度偏低的状态下,与脉冲射频联用可提高PHN 的治疗效果,降低不良反应的发生,改善就医体验。
本研究纳入的病人为皮疹愈合后3 个月内的病人,对于病程更长的病人治疗的观察需要在后续的观察中探讨。另外,本研究是通过PHN 病例真实诊疗过程数据的分析,探讨普瑞巴林血药浓度监测对临床诊疗的作用。虽然发现治疗效果与普瑞巴林血药浓度之间具有一定的联系,但受限于病例数量较少及干扰因素。普瑞巴林血药浓度与效果之间的对应关系及影响因素将在今后的药效学研究中进一步探讨。
利益冲突声明:作者声明本文无利益冲突。
[1] 张媛婧,樊碧发,刘星,等. 细银质针导热松解联合臭氧注射与神经根脉冲射频治疗带状疱疹后神经痛的疗效比较[J]. 中国疼痛医学杂志, 2021, 27(3):196-201.
[2] Van Hecke O, Austin SK, Khan RA,
. Neuropathic pain in the general population: a systematic review of epidemiological studies[J]. Pain, 2014, 155(4):654-662.
[3] Jonathan Kopel, Gregory LB. Eあectiveness of pregabalin as a secondary treatment for neuropathic pain from postherpetic neuralgia[J]. Proc (Bayl Univ Med Cent),2020, 33(3):469-470.
[4] Wan CF, Song T. Eきcacy of pulsed radiofrequency or short-term spinal cord stimulation for acute/subacute zoster-related pain: a randomized, double-blinded, controlled trial[J]. Pain Physician, 2021, 24(3):215-222.
[5] Michael K, Martin K, Yury V,
. Herpes zoster and postherpetic neuralgia surveillance using structured electronic data[J]. Mayo Clin Proc, 2011, 86(12):1146-1153.
[6] Johannessen SI, Tomson T. Pharmacokinetic variability of newer antiepileptic drugs when is monitoring needed? [J]. Clin Pharmacokinet, 2006, 45(11):1061-1075.
[7] Bockbrader HN, Hunt T, Strand J,
. Pregabalin pharmacokinetics and safety in healthy volunteers:results from two phase 1 studies[J]. Neurology, 2000,54(3):421.
[8] Min KL, Ryu JY, Chang MJ. Development and clinical applications of the dried blood spot method for therapeutic drug monitoring of anti-epileptic drugs[J]. Basic Clin Pharmacol Toxicol, 2019, 125(3):215-236.
[9] 带状疱疹后神经痛诊疗共识编写专家组. 带状疱疹后神经痛诊疗中国专家共识[J]. 中国疼痛医学杂志,2016, 22(3):161-167.
[10] 苗羽, 刘波涛, 王海宁, 等. 超声引导下颈神经根脉冲射频治疗带状疱疹神经痛的临床研究[J]. 中国疼痛医学杂志, 2021, 27(2):127-132.
[11] 代静, 高乐虹, 彭方达, 等. 超高效液相色谱-串联质谱法同时测定血清中12 种抗癫痫药物[J]. 色谱,2020, 38(8):900-905.
[12] 刘劲洲, 蒋宗滨. 电压门控离子通道与带状疱疹后神经痛[J]. 中国疼痛医学杂志, 2021, 27(3):208-211.
[13] 《中华医学杂志》社皮肤科慢病能力提升项目专家组, 中国医师协会疼痛科医师分会, 国家远程医疗与互联网医学中心皮肤科专委会. 带状疱疹相关性疼痛全程管理专家共识[J]. 中华皮肤科杂志, 2021,54(10):841-846.
[14] Finnerup NB, Attal N, Haroutounian S,
. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis[J]. Lancet Neurol, 2015,14(2):162-173.
[15] Sommer M, Bachmann CG, Liebetanz KM,
. Pregabalin in restless legs syndrome with and without neuropathic pain[J]. Acta Neurol Scand, 2007, 115(5):347-350.
[16] Moon DE, Lee DI, Lee SC,
. Efficacy and tolerability of pregabalin using a flexible, optimized dose schedule in korean patients with peripheral neuropathic pain: a 10-week, randomized, double-blind, placebo-controlled, multicenter study[J]. Clin Ther, 2010,32(14):2370-2385.
[17] Freynhagen R, Strojek K, Griesing T,
. Eきcacy of pregabalin in neuropathic pain evaluated in a 12-week,randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens[J].Pain, 2005, 115(3):254-263.
[18] Erdine S, Bilir A, Cosman ER,
. Ultrastructural changes in axons following exposure to pulsed radiofrequency fields[J]. Pain Pract, 2009, 9(6):407-417.
[19] Ben-Menachem E. Pregabalin pharmacology and its relevance to clinical practice[J]. Epilepsia, 2004,45(6):13-18.
[20] Brodie MJ. Pregabalin as adjunctive therapy for partial seizures[J]. Epilepsia, 2004, 45(6):19-27.
[21] Bockbrader HN, Hunt T, Strand J,
. Pregabalin pharmacokinetics and safety in healthy volunteers: results from two phase I studies[J]. Neurology, 2000, 54(3):421.
[22] Sindrup SH, Holbech JV, Bach FW,
. The impact of serum drug concentration on the efficacy of imipramine, pregabalin, and their combination in painful polyneuropathy[J]. Clini J Pain, 2017, 33(12):1047-1052.
[23] Wang YF, Chen YT, Tsai CW,
. Persistence of pregabalin treatment in Taiwan: a nation-wide population-based study[J]. J Headache Pain, 2020, 21(1):54.
[24] Edward JR, Edward LP, Christine WA,
. Pharmacokinetics of pregabalin in subjects with various degrees of renal function[J]. J Clin Pharmacol, 2003, 43(3):277-283.
[25] Ogawa S, Satoh J, Arakawa A,
. Pregabalin treatment for peripheral neuropathic pain: a review of safety data from randomized controlled trials conducted in Japan and in the west[J]. Drug Saf, 2012, 35(10):793-806.
[26] Cecilie JL, Philip NP. Drug interactions involving the new second- and third-generation antiepileptic drugs[J].Expert Rev Neurother, 2010, 10(1):119-140.
[27] Berry D, Millington C. Analysis of pregabalin at therapeutic concentrations in human plasma/serum by reversed-phased HPLC[J]. Ther Drug Monit, 2005, 27(4):451-456.
[28] Shery J, Anroop BN. An updated overview on therapeutic drug monitoring of recent antiepileptic drugs[J].Drugs R D, 2016, 16(4):303-316.
[29] Søren HS, Jakob VH, Flemming WB,
. The impact of serum drug concentration on the eきcacy of imipramine, pregabalin, and their combination in painful polyneuropathy[J]. Clin J Pain, 2017, 33(12):1047-1052.
[30] Régis F, Isabelle S, Emmanuelle G,
. Adverse drug reactions to gabapentin and pregabalin: a review of the French pharmacovigilance database[J]. Drug Saf, 2013,36(1):55-62.
[31] James EF, Rachel HF. Pregabalin[J]. Drugs, 2005,65(1):111-118.

