视黄酸通过GSK-3β 对大鼠缺氧缺血性脑损伤后海马神经干细胞增殖的调节作用
李思雨 ,赵 敏 ,杨茂玲 ,肖 农 ,江 伟
(1.重庆医科大学附属儿童医院康复科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地,重庆 400014;2.儿科学重庆市重点实验室 认知发育与学习记忆障碍转化医学重庆市重点实验室,重庆 400014)
缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿常见的中枢神经系统疾病,严重时易导致神经系统后遗症,甚至死亡。目前临床治疗手段主要有支持治疗、亚低温治疗、高压氧治疗、药物治疗和间充质干细胞移植等[1]。但是上述治疗方法有效性低,预后不良率较高,因此如何改善HIBD 损伤后神经功能的修复及寻找有效的神经保护疗法一直是儿科医学研究的重点和热点[1-2]。研究[3]显示:在模拟的HIBD 动物模型中,损伤后的神经干细胞和祖细胞能促进自我修复和功能恢复。作为体内重要营养元素之一的维生素A也是研究HIBD 损伤后修复机制的热点。视黄酸(retinoic acid,RA)是维生素A 的活性代谢产物,主要通过其核受体发挥广泛的生物学功能。研究[4-6]显示:啮齿动物的神经认知功能受到体内RA 水平的影响;神经细胞的增殖再生与Wnt 和RA 等信号通路有关。视黄酸核受体α(retinoic acid receptor alpha,RARα)是RA 受体在脑中表达的优势受体[7],并且RARα 在大鼠HIBD 后的学习和记忆功能恢复过程中发挥重要作用[8-9]。糖原合酶激酶3β(glycogen synthase kinase 3β,GSK-3β)是一种广泛表达于中枢神经系统的丝/苏氨酸蛋白激酶,参与调控细胞内糖代谢、细胞增殖分化和凋亡等生理过程。海马组织中GSK-3β 的激活在损伤成年海马神经新生过程中起重要作用[10]。G1/S-特异性周期蛋白D1(G1/S-specific cyclin-D1,CyclinD1)是参与调控细胞周期的核心蛋白,可以作为检测细胞增殖程度的指标。CyclinD1 基因表达增加时能够促进神经干细胞的增殖[11]。本课题组前期研究[12]显示:适当浓度(1~5 μmol·L-1)RA 处理氧糖剥夺(oxygen and glucose deprivation,OGD)损伤后的PC12 细胞可以增加RAR α、GSK-3β 和CyclinD1 mRNA 及蛋白表达水平,进而促进细胞增殖。因此本研究在大鼠海马神经干细胞中探讨不同浓度RA 对细胞增殖的影响以及RA 对RARα、GSK-3β 和CyclinD1 表达的影响,并且进一步探讨RA 可能的作用机制,为预防和治疗脑损伤提供新的理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF 级健康Sprague-Dawley(SD)孕鼠(孕16~18 d),购于重庆医科大学实验动物中心,实验动物使用许可证号:SYXK(渝)2018-0003。DMEM 培养基、DMEM/F12 培养基和胎牛血清购自美国Gibco 公司,M199 培养基购自美国Hyclone 公司,Rat FGF-basic 和Rat EGF 购自美国PeproTech 公司,RA(全反式视黄酸)购自美国Sigma 公司,CHIR99021 购自美国Cayman 公司,RARα 和Nestin一抗购自美国Abcam 公司,CyclinD1、GSK-3β 和β-actin 购自美国Cell Signaling Technology 公 司,RNA 提取试剂盒购自美国Bioteck 公司,cDNA 合成试剂盒(RR047A)和SYBR-Green Real-time PCR(RR820A)试剂购自日本TaKaRa 公 司,BCA 蛋白定量试剂盒、全蛋白提取试剂盒和SDSPAGE 凝胶配制试剂盒购自南京凯基生物技术有限公司,CCK-8 细胞增殖检测试剂盒购自日本同仁公司。CO2细胞培养箱、三气细胞培养箱和紫外分光光度仪购自美国Thermo 公司,荧光显微摄像系统购自日本Nicon 公司,逆转录系统、实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)系统、凝胶电泳系统、电转系统和成像系统购自美国Bio-Rad 公司。
1.2 原代海马神经干细胞的分离和培养麻醉孕鼠,75%乙醇消毒,在无菌条件下取出SD 大鼠胎鼠,分离颅骨及硬脑膜,去除间脑、小脑、脑膜和血管,取海马组织置于含1%双抗+10%胎牛血清的DMEM/F12 培养基中,剪碎脑组织,轻吹打数次,200 目细胞筛过滤,1 500 r·min-1离心5 min,加入适量培养基,混匀,接种于10 cm 培养皿中,置于37 ℃、5% CO2孵箱中培养,第2 天DMEM/F12 培养基+20 mg·L-1EGF+20 mg·L-1bFGF+1%双抗+2% B27 混合培养基全量换液,第3~4 天进行半量换液,第5 天进行RA 干预,第6 天进行抑制剂CHIR99021 干预及OGD 损伤。
1.3 原代海马神经干细胞OGD 损伤将培养的神经干细胞接种于6 孔细胞培养板中,在缺氧前24 h分别以0、0.5、1.0、5.0、10.0 和50.0 μmol·L-1RA 进行干预并分组,对照组未进行OGD 损伤和试剂干预。给予无糖M199 培养基并在三气细胞培养箱中给予95% N2+5% O2混合气培养2 h,模拟缺血缺氧,进行OGD 建模。在缺氧前2 h 加入相应体积GSK-3β 抑制剂CHIR99021。
1.4 原代海马神经干细胞的鉴定将生长良好的神经干细胞接种到多聚赖氨酸包被过的盖玻片上,将盖玻片置于24 孔细胞培养板中,加入培养液,37 ℃、5% CO2条件下培养12 h,细胞贴壁后吸出培养液,PBS 缓冲液冲洗,4% 多聚甲醛固定30 min 后PBS 缓冲液冲洗,0.3% Triton X-100 的PBS 缓冲液37 ℃孵育10 min 后PBS 缓冲液冲洗,10%山羊血清室温封闭30 min,加入Nestin 抗体100 μL(1∶200),湿盒4 ℃过夜。PBS 缓冲液冲洗,加入二抗(1∶200),37 ℃避光孵育40 min。PBS 缓冲液冲洗,避光晾干。荧光封片剂封片。暗室荧光显微镜下观察。
1.5 原代海马神经干细胞OGD 损伤后CCK8 法检测细胞增殖活性按照CCK8 细胞增殖检测试剂盒说明书进行操作。预先使用多聚赖氨酸溶液包被96 孔细胞培养板,ddH2O 洗涤3 次备用,将干预后的各实验组原代神经干细胞加入96 孔细胞培养板中(每孔100 μL),每孔约含10 000 个细胞。分别在OGD 损伤后12、24、48 和72 h 提前向每孔加入10 μL CCK-8 溶液,37 ℃孵育4 h 后,使用酶标仪测定在450 nm 处的吸光度(A)值。RA 干预后,以A 值表示细胞增殖活性。采用GraphPad Prism 5.0 绘制各组细胞随时间变化的增殖曲线;GSK-3β 抑制剂CHIR99021 干预后,按公式计算各组细胞增殖率。细胞增殖率=(实验孔A 值-空白孔A 值)/(对照孔A 值-空白孔A 值)×100%。
1.6 RT-qPCR 法检测原代海马神经干细胞中RARα、GSK-3β 和CyclinD1 mRNA 表达水平复糖复氧24 h 后提取原代神经干细胞总RNA 并测定RNA 浓度。将mRNA 分2 步逆转录为cDNA。逆转录反应条件:37 ℃、15 min,85 ℃、5 s,4 ℃保存。将逆转录后的cDNA 行RT-qPCR 法检测,试剂使用SYBR®Premix Ex Taq™Ⅱ,总反应体系为25 μL,所有操作均在冰上进行。PCR 循环条件:95 ℃变性10 min;95 ℃、15 s,60 ℃、60 s,45 个循环;72 ℃、30 s。计算公式:以GAPDH 作为对照,阈值(Ct)为参数,采用2-ΔΔCt法计算mRNA相对表达水平,ΔΔCt=实验组(Ct 目的基因-Ct 内参)-对照组(Ct 目的基因-Ct 内参)。引物合成由生工生物工程(上海)股份有限公司完成。引物名称及序列 :GAPDH 上游引物 5'-CTGGAGAAACCTGCCAAGTATG-3',下游引物5'-GGTGGAAGAATGGGAGTTGCT-3';RARα上游引物5'-GACTCCGCTTTGGAATGG-3',下游引物 5'-ACTGCTGCTCTGGGTCTCG-3';GSK-3β 上游引物 5'-CATCCTTATCCCTCCTCACGCT-3',下游引物5'-TATTGGTCTGTCCACGGTCTCC-3';CyclinD1 上游引物 5'-TTCATCGAACACTTCCTCTCCA-3',下游引物5'-GAGGGTGGGTTGGAAATGAA-3'。
1.7 Western blotting 法检测原代海马神经干细胞中RARα、GSK-3β 和CyclinD1 蛋白表达量复糖复氧24 h 后提取原代神经干细胞全蛋白并检测蛋白浓度。各组取等量蛋白进行SDS-PAGE 凝胶电泳、转膜和封闭。一抗RARα、GSK-3β、CyclinD1 和β-actin,4 ℃孵育过夜。次日TBST 洗涤4 次,每次5 min,加二抗室温孵育1 h,TBST 洗涤4 次,每次5 min。用化学发光法处理后使用蛋白成像系统拍照。样品均以β-actin 为对照。
1.8 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组细胞增殖率,细胞中RARα、GSK-3β 和CyclinD1 mRNA 表达水平均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 免疫荧光鉴定大鼠原代海马神经干细胞大鼠原代海马神经干细胞在培养第3~4 天逐渐由单个细胞聚集成细胞团,细胞团成圆形或椭圆形,在显微镜下可以观察到有的细胞团中间有小黑点(图1A),可能的原因是细胞团体积过大导致中心细胞营养不良。采用Nestin 抗体鉴定原代海马神经干细胞,绿色为其荧光色,通过免疫荧光鉴定,可以发现几乎所有的原代海马神经干细胞表达为绿色荧光(图1B 和1C),表明提取的大鼠原代海马神经干细胞纯度较高。

图1 大鼠原代海马神经干细胞形态表现和鉴定(免疫荧光,×200)Fig.1 Morphology and identification of primary hippocampal neural stem cells of rats(Immunofluorescence,×200)
2.2 RA 干预后的各组大鼠原代海马神经干细胞增殖活性OGD 损伤后细胞增殖检测结果显示:5.0 μmol·L-1RA 干预组在OGD 后各时间点细胞增殖活性最高(P<0.05),而50.0 μmol·L-1RA 干预组在OGD 后各时间点细胞增殖活性最低(P<0.05),且1.0 和5.0 μmol·L-1RA 干预组在OGD 后各时间点细胞增殖活性均高于单纯OGD 组(P<0.05)。见图2。

图2 各组细胞增殖活性Fig.2 Cell proliferation activities in various groups
2.3 RA 干预后各组细胞中RARα、CyclinD1 和GSK-3β mRNA 表达水平及蛋白表达量与OGD组比较,1.0、5.0 和10.0 μmol·L-1RA 干预组细胞中RARα 和GSK-3β mRNA 表达水平明显升高(P<0.05),5.0和10.0 μmol·L-1RA 干预组细胞中CyclinD1 mRNA 表达水平明显升高(P<0.05)。与对照组比较,OGD 组细胞中RARα、GSK-3β 和CyclinD1 蛋白表达量降低;与OGD 组比较,1.0、5.0 和10.0 μmol·L-1RA 干预组细胞中RARα 和GSK-3β 蛋白表达量升高。见图3。

图3 RA 干预后各组细胞中RARα、GSK-3β 和CyclinD1 mRNA 表达水平(A)和蛋白表达电泳图(B)Fig.3 Expression levels of RAR α,GSK-3 β and CyclinD1 mRNA(A) and electrophoregram of expressions of proteins(B)in cells in various groups after RA intervention
2.4 GSK-3β 抑制剂CHIR99021 干预后各组细胞增殖率在OGD 后24 h 检测不同浓度的GSK-3β抑制剂CHIR99021 对原代海马神经干细胞的干预结果,图4A 显 示20 μmol·L-1CHIR99021 干预组细胞增殖率明显低于OGD 组(P<0.01),表明CHIR99021 抑制细胞增殖的有效浓度为20 μmol·L-1。图4B 显示5.0 μmol·L-1RA 干预组细胞增殖率明显高于单纯OGD 组(P<0.01),而5.0 μmol·L-1RA+20 μmol·L-1CHIR99021 干 预组细胞增殖率明显低于5.0 μmol·L-1RA 干预组(P<0.01),表明加入GSK-3β 抑制剂CHIR99021后,5.0 μmol·L-1RA 促进OGD 后神经干细胞最优增殖的作用受到抑制。

图4 各组细胞增殖率Fig.4 Cell proliferation rates in various groups
2.5 抑制剂CHIR99021 干预后各组细胞中RARα、GSK-3β 和CyclinD1 mRNA 表达水平及蛋白表达量与5.0 μmol·L-1RA 干预组比较,0 和0.5 μmol·L-1RA+20 μmol·L-1CHIR99021 干 预组细胞中RARα、GSK-3β 和CyclinD1 mRNA 表达水平均明显降低(P<0.01),5.0 和50.0 μmol·L-1RA+20 μ mol·L-1CHIR99021 干预组细胞中GSK-3β 和CyclinD1 mRNA 表达水平均明显降低(P<0.01)。与5.0 μmol·L-1RA 干预组比较,0~50.0 μmol·L-1RA+20 μmol·L-1CHIR99021干预组细胞中GSK-3β 和CyclinD1 蛋白表达量降低,RARα蛋白表达量变化不明显。表明加入GSK-3β抑制剂CHIR99021后,适宜浓度(5.0 μmol·L-1)RA激活GSK-3β 和CyclinD1 的表达受到抑制,进而抑制细胞增殖。见图5。
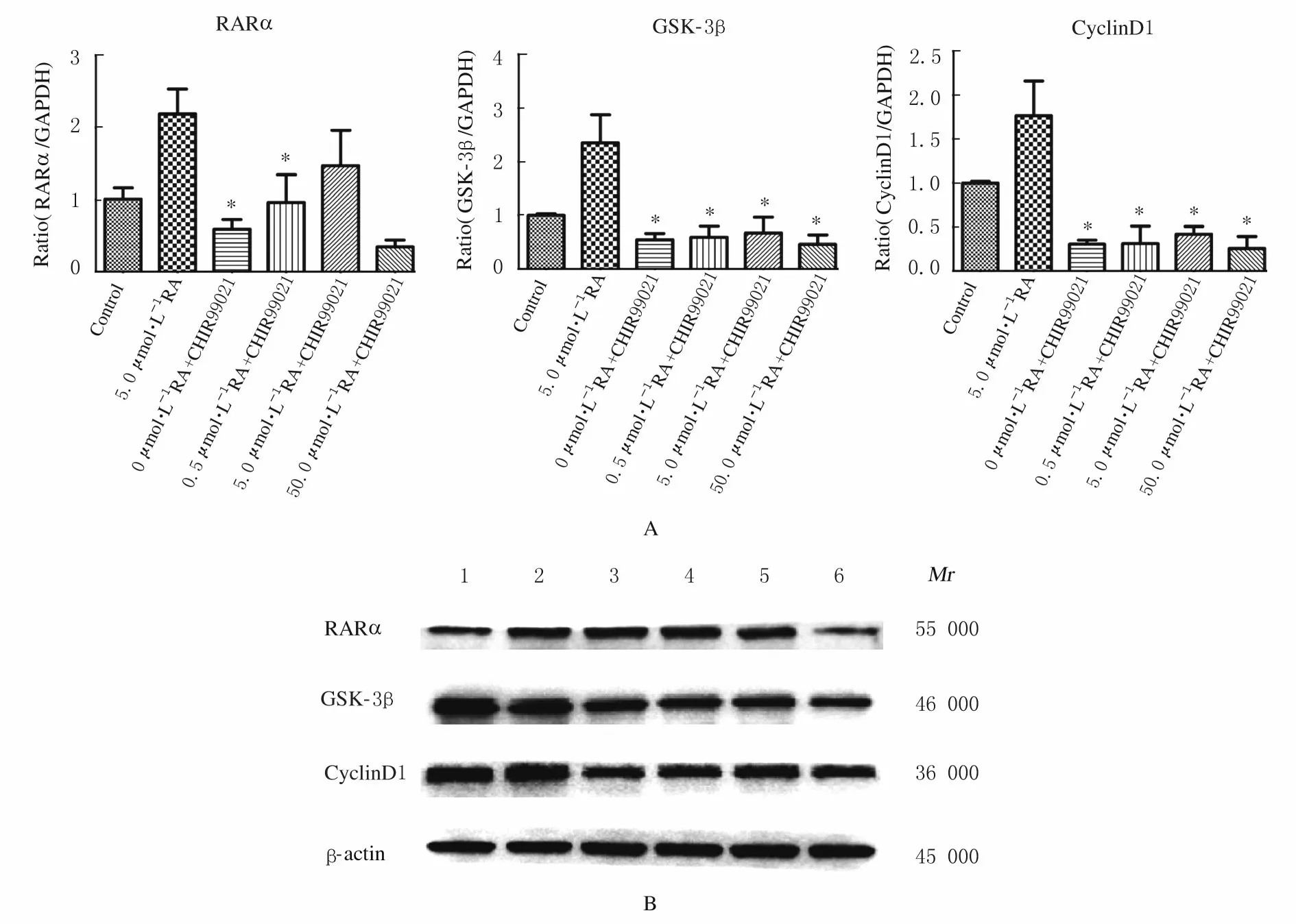
图5 CHIR99021 干预后各组细胞中RARα、GSK-3β 和CyclinD1 mRNA 表达水平(A)和蛋白表达电泳图(B)Fig.5 Expression levels of RARα,GSK-3β and CyclinD1 mRNA(A) and electrophoregram of expressions of proteins(B)in cells in various groups after CHIR99021 intervention
3 讨论
近年来新生儿脑病患病率逐年升高,且致残率和死亡率较高。因此,明确HIBD 的发病机制及修复机制,探索治疗的新方法非常必要。促进神经细胞增殖再生是治疗中枢神经系统损伤最有效的方法。目前已通过体外OGD 损伤培养的PC12 细胞,模拟体内神经细胞的缺氧缺血损伤,研究[12]结果显示:OGD 损伤可抑制PC12 细胞增殖能力,适宜浓度RA 可促进PC12 细胞增殖。随着维生素A 在疾病的应用研究日益增多,维生素A 有望成为HIBD 损伤后神经保护及治疗的新手段。
维生素A 是一种脂溶性维生素,主要通过其活性代谢产物RA 在体内发挥作用。RA 作为一种重要的信号分子具有广泛的生物学作用,通过RAR/RXR 异源二聚体或RXR/RXR 同源二聚体,与RA反应原件(RARE)结合直接或间接调控靶基因的转录和翻译,可以调控多种组织和细胞的形态发生、增殖、生长发育和代谢等[13]。RA 在神经系统的发育中起着至关重要作用,可以调节神经细胞的凋亡、增殖和分化,神经轴突的生长和连接及神经管前后轴的形成等功能[14-15]。RA 信号过高或过低都会促进缺氧缺血性损伤诱导的细胞凋亡[16]。RA对损伤引起的神经元凋亡具有保护作用[17]。因此,可以推测凋亡的双向调节取决于RA 浓度。但是,RA 浓度对神经干细胞增殖是否也具有双向调节作用尚无相关报道。本研究采用不同浓度RA 干预OGD 损伤后的海马神经干细胞,CCK8 法检测结果表明:OGD 后1.0~5.0 μmol·L-1RA 干预海马神经干细胞有助于细胞增殖,而50.0 μmol·L-1RA 干预导致细胞活性下降,可能高剂量的RA 具有细胞毒性或者抑制细胞增殖。本研究结合细胞中RARα、GSK-3β 和CyclinD1 mRNA 和蛋白表达结果显示:1.0~10.0 μmol·L-1RA 可有效促进OGD损伤后神经干细胞增殖,且5.0 μmol·L-1RA 干预具有最佳细胞增殖效果,过高或过低浓度均可抑制OGD 损伤后神经干细胞增殖,表明RA 在缺氧缺血损伤的神经干细胞模型中存在适宜浓度治疗窗(1.0~10.0 μmol·L-1)。因此,维持体内适宜水平的RA 对HIBD 后神经修复具有良好的促进作用。
RARα 是RA 的优势表达受体[7]。前期研究[12]结果显示:已发现RA 可通过RARα 调控PC12 细胞增殖。研究[10,18-19]表明:GSK-3β 信号通路参与损伤成年海马神经新生过程、脑卒中及缺氧缺血脑损伤后的神经保护作用。因此目前越来越多的研究选择GSK-3β 作为多种神经疾病的治疗靶点。CyclinD1 的主要功能是调控细胞增殖。已有体外实验研究[20-21]表明:敲除CyclinD1 基因可抑制海马齿状回中神经干细胞的增殖,并诱导NSCs 凋亡。而增加CyclinD1 基因表达时能够促进神经干细胞和星形胶质细胞等神经细胞的增殖[11,22]。本研究结果显示:与OGD 组比较,在5 μmol·L-1RA 干预下RARα、GSK-3β 和CyclinD1 的表达明显升高。这一结果与本课题组前期在PC12 细胞中的研究结果[12]一致,提示适宜浓度RA 通过RARα 促进神经细胞增殖的机制与GSK-3β 和CyclinD1 有关。
尽管已有组织学实验[23]显示:RA 可以促进HIBD 损伤后新生鼠脑中内源性神经干细胞的增殖,但是RA 参与神经修复的作用机制仍不清楚。为了进一步探讨RA 的作用机制,本研究选择5.0 μmol·L-1RA 进行后续实验,使用GSK-3β 抑制剂CHIR99021抑制GSK-3β活性。加入20 μmol·L-1CHIR99021 处理RA 干预后的海马神经干细胞,细胞增殖检测结果显示:加入CHIR99021 处理后,适宜浓度(5.0 μmol·L-1)RA 促进OGD 损伤后海马神经干细胞增殖的作用受到明显抑制,细胞增殖活性降低,适宜浓度(5.0 μmol·L-1)RA 干预下GSK-3β 和CyclinD1 表达也受到抑制,再次验证了适宜浓度RA 影响神经干细胞增殖的机制与RARα、GSK-3β 和CyclinD1 有关,并且抑制GSK-3β 活 性后,其下游CyclinD1 的转录受到明显抑制。以上结果揭示了GSK-3β 信号是RA 调节OGD 后海马神经干细胞增殖的重要信号。
综上所述,本研究证明了RA 可促进缺氧后的神经干细胞增殖,且存在适宜浓度治疗窗(1.0~10.0 μmol·L-1),推测RA 的作用机制可能主要通过激活GSK-3β 来调节下游CyclinD1 的转录,从而促进神经干细胞增殖。因此,适当剂量的维生素A可以作为HIBD 损伤后的临床干预方法。

