肉桂醛抗菌粘接剂的制备及其抗菌性能评价
王 晗,田子璐,朱轩言,杨宇斌,朱 松
(吉林大学口腔医院修复科,吉林 长春 130021)
光固化复合树脂因其具有良好的美观性、生物相容性以及力学性能,已成为临床应用最广泛的牙体充填修复材料[1]。继发龋是更换复合树脂修复体的最常见原因(43%)[2]。为防止继发龋的发生,对粘接剂进行改性,赋予其抗菌、抗蛋白质吸附和促矿化等功能[3-5],是一种行之有效的方法。其中,具有抗菌功能的粘接剂可以抑制粘接界面生物膜的生长,直接消除继发龋发生的生物因素,大量的研究[6-9]已经证明此种方法的有效性。目前研究开发的抗菌粘接剂,根据其作用机制的不同,分为释放型抗菌粘接剂和非释放型抗菌粘接剂[10],前者以纳米银等金属离子、金属氧化物、抗生素类和氯己定等小分子抗菌剂为代表,非释放型抗菌剂以季铵盐化合物和三氯生衍生物等抗菌单体为代表。但上述抗菌剂存在易改变粘接剂的颜色、生物安全性低和可能诱导细菌产生耐药性等缺点。
肉桂醛(cinnamaldehyde)是肉桂树皮精油的主要成分,也是肉桂药理作用的主要来源,作为一种小分子有机化合物,其分子结构包括苯环、双键和醛基官能团,性状为淡黄色的黏稠油状液体[11]。作为一种天然的广谱抗菌剂,因其优越的抗菌性能和较高的生物安全性,已被广泛应用于食品添加剂、食品包装和化妆品防腐等领域,对导致人类传染病、食品或化妆品降解的革兰阳性细菌和革兰阴性细菌均有较强的抗菌活性[12]。但目前肉桂醛在口腔医学领域的应用,仍以肉桂精油的形式添加在牙膏和漱口水等口腔护理产品中的方式为主,尚无将肉桂醛从肉桂精油中分离并应用于牙本质粘接剂的研究。
本实验选取肉桂醛这一天然抗菌剂,首先检测其抗菌性能,然后将其按一定比例加入现有的商品牙本质粘接剂中,测定粘接剂的抗菌性能,同时探讨肉桂醛的加入对粘接剂的体外细胞毒性和粘接强度的影响,以确定含肉桂醛的抗菌粘接剂是否能够满足临床应用需求,以期减少继发龋的发生,延长复合树脂充填修复体的使用寿命。
1 材料与方法
1.1 细胞、主要试剂和仪器
变异链球菌(S.mutanUA159)(美国ATCC公司),小鼠成纤维细胞(吉林省牙发育及颌骨重塑与再生重点实验室提供),人离体牙(吉林大学口腔医院提供)。肉桂醛(分析标准品>99.5%,上海阿拉丁生化科技股份有限公司),牙本质粘接剂Single Bond 2(SB2)和复合树脂Z350(美国3M 公司),脑心浸液肉汤培养基(brain-heartinfusion,BHI)和脑心浸液琼脂培养基(青岛高科园海博生物技术有限公司),活/死细菌荧光试剂盒(美国Molecular Probes 公司),H-DMEM 高糖培养基和磷酸盐缓冲液(phosphate buffered saline,PBS)(南京建成生物有限公司),MTT 试剂(美国Sigma 公司),胎牛血清和胰蛋白酶(美国Gbico公司),格鲁玛酸蚀剂37%磷酸凝胶(德国Heraeus Kulzer GmbH 公司)。细胞培养瓶、6 孔细胞培养板和96 孔细胞培养板(美国Costar 公司),高级超净台(型号BLB-1300,苏州苏净安泰空气技术有限公司),高速离心机(美国Beckman coulter 公司),倒置显微镜(日本Olympus 公司),CO2恒温细胞培养箱(日本Sanyo 公司),冰箱(型号BCD-221TMCV,海尔集团),酶标仪(型号BL340,美国Biotech 公司),37 ℃恒温孵育箱(型号SLI-1200,日本Sanyo 公司),厌氧培养罐,可见光分光光度计(型号LAMBDA 25,美国Perkin Elmer公司),speedmixer 高速混合机(美国Hauschild 公司),万能试验机(型号AG-X plus,日本Shimadzu公司),蓝光光固化灯(型号SLC-VIIIA,桂林维润医疗科技有限公司)。
1.2 肉桂醛最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)测定
1.2.1 肉桂醛溶液配制 肉桂醛标准品40 mg 加入200 μL 无水乙醇溶解,4 ℃密封保存备用。
1.2.2 细菌培养 将冻干变异链球菌菌株复苏并接种于BHI 琼脂平板,孵箱37 ℃厌氧培养48 h,形态学及生化实验鉴定为纯培养物后,将其接种于BHI 琼脂平板传至第3 代。用接种环挑取单个菌落接种于4 mL BHI 液体培养基中,厌氧环境下培养24 h 后,用移液枪吹打均匀后取2 mL 菌悬液进行比浊,根据比浊结果将剩余的2 mL 菌悬液浓度稀释至1×106CFU·mL-1,备用。
1.2.3 微量肉汤稀释法测定肉桂醛的MIC 和MBC 将120 μL 肉桂醛无水乙醇溶液加入3 mL BHI 液体培养基中,得到药物浓度为8 000 mg·L-1的第一组药物,二倍稀释法依次稀释为8 000、4 000、2 000、1 000、500、250 和125 mg·L-1,另将120 μL 无水乙醇加入3 mL BHI 溶液中,作为溶剂对照组。
取96 孔细胞培养板,每孔加入100 μL 菌液,而后各孔依次加入100 μL 药物,并设置BHI 培养基对照组、溶剂对照组和细菌生长对照组。孵箱37 ℃厌氧培养24 h,取出后,肉眼观察细菌生长情况,并用酶联免疫检测仪于600 nm 波长处测定吸光度(A)值,选择无细菌生长的药物浓度最低组为MIC,单位为mg·L-1。在1/2 MIC 组及以上的各孔取10 μL 液体,涂布于BHI 琼脂平板上,37 ℃厌氧培养48 h,观察无菌落生长的最低药物浓度即为MBC,单位为mg·L-1。
1.3 肉桂醛抗菌粘接剂的抗菌性能检测
1.3.1 肉桂醛抗菌粘接剂的制备 分别以质量分数2%、4%、6% 和8% 的肉桂醛与商品粘接剂SB2 混合,对照组为未加入肉桂醛的SB2。使用speedmixer 高速混合机进行混合,3 000 r·min-1混合20 s,避光保存。将配置好的抗菌性粘接剂置于长方形聚四氟乙烯模具(长度2 cm,宽度1 cm)中,为防止氧阻聚层,表面覆盖聚乙烯薄膜,光照固化,每个点照射20 s,重叠照射。将制备的长方形试样在超净台内,紫外光消毒杀菌2 h,待用。
1.3.2 细菌黏附实验 将消毒后的试件(n=5)放入已灭菌处理的离心管中,加入2.5 mL 菌液没过试件,孵箱37 ℃厌氧培养48 h 后取出,用PBS缓冲液轻轻冲洗去除杂质及表面未黏附的细菌,然后转移至新的离心管中,每管加入5 mL PBS 缓冲液,超声震荡10 min,吹打均匀,梯度稀释100 倍,取50 μL 涂布于BHI 琼脂平板,孵箱37 ℃厌氧培养48 h 后取出,行菌落计数并计算抗菌率(%)。抗菌率计算公式:抗菌率=(B-A)/B×100%,A 为实验组试件平均回收菌落数(cfu),B 为对照组试件平均回收菌落数(cfu)。
1.3.3 活/死细菌染色实验 细菌的培养如“1.3.2”,PBS 缓冲液冲洗过的试件转移至6 孔细胞培养板中,采用活/死细菌荧光试剂盒进行染色。在荧光显微镜下,活细菌染色后会产生绿色荧光;细胞膜受损的细菌则会被含碘的试剂染色,产生红色荧光;而接近或重叠的活/死细菌会显示出橙和黄色。
1.4 体外细胞毒性实验
1.4.1 浸提液制备和处理 将配置好的抗菌性粘接剂置于长方形聚四氟乙烯模具(长度2 cm,宽度1.5 cm)中,为防止氧阻聚层,表面覆盖聚乙烯薄膜,光照固化,每个点照射20 s,重叠照射。将制备的长方形试样在超净台内,紫外光消毒杀菌2 h,每个试件用2 mL 含10%胎牛血清的高糖细胞培养基37 ℃浸提24 h,过滤除菌,4 ℃密封保存备用。
1.4.2 MTT 实验 选择小鼠成纤维细胞(L929)作为实验用细胞检测粘接剂细胞毒性,37 ℃CO2恒温细胞培养箱(5% CO2、95%湿度)中培养至对数生长期铺于96 孔细胞培养板,每孔2 000 个细胞,每组6 个复孔,另设细胞生长对照组。浸提液用含10%胎牛血清的培养基分别稀释1 000、2 000和4 000 倍,培养24 h 后弃去原培养液,实验组每孔加入200 μL 粘接剂浸提液,细胞生长对照组更换200 μ L 细胞培养液,继续培养24 h。每孔加入20 μL MTT 溶液,孵育4 h 后弃去浸提液,每孔加入150 μL 二甲基亚砜(DMSO),震荡后用酶联免疫检测仪于540 nm 波长处测定A 值。计算细胞生存率(cell viability,%),并获得对应的细胞毒性等级。体外细胞毒评价等级标准:0 级(细胞生存率≥100%),1 级(75%≤细胞生存率<100%),2 级(50%≤细胞生存率<75%),3 级(25%≤细胞生存率<50%),4 级(0%<细胞生存率<25%),5 级(细胞生存率=0)。细胞生存率计算公式:细胞生存率=实验组A 值/对照组A 值×100%。
1.5 即刻粘接强度测试
1.5.1 离体牙的保存和处理 选择微拉伸试验检测粘接剂的粘接强度。收集完整的12 颗新鲜离体牙,由吉林大学口腔医院提供,患者签署知情同意书。离体牙浸泡于0.5%氯铵T 溶液中4 ℃保存备用。采用慢速锯将离体牙的冠部牙釉质磨除,暴露牙本质,分别用180 目、360 目和600 目的砂纸在流水状态下打磨15 s,模拟玷污层。
1.5.2 微拉伸试件的制备 按照粘接剂SB2 的使用说明书进行操作:37%磷酸凝胶酸蚀15 s,冲洗10 s,涂布粘接剂15 s,轻吹5 s,光照固化10 s。粘接剂固化后分层堆砌复合树脂Z350,每层2 mm,光照40 s 固化,堆砌2 层。将制备的微拉伸离体牙试样浸泡于37 ℃去离子水中24 h,采用慢速锯沿牙体长轴,垂直于粘接界面将其切割成截面积为1 mm × 1 mm 的长条状试样,每颗牙留取界面中间部位的4 个试样。
1.5.3 微拉伸强度检测 使用万能试验机进行微拉伸强度测试,拉伸速率设置为1 mm·min-1,微拉伸强度(单位为MPa)计算公式:微拉伸强度=断裂点最大载荷(Fmax,单位为N)/断裂点截面面积(mm2)。
1.6 统计学分析
采用SPSS 22.0 统计软件进行统计学分析。试件平均回收菌落数和粘接剂微拉伸强度均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Tukey 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 肉桂醛的MIC 和MBC
肉桂醛浓度上升至250 mg·L-1时细菌未生长,选取此浓度作为肉桂醛的MIC。取细菌生长对照组,1/2 MIC即125 mg·L-1及以上各组涂板,对照组和125 mg·L-1组平板上细菌生长,而250 mg·L-1及以上肉桂醛组细菌未生长,250 mg·L-1为肉桂醛的MBC。
2.2 肉桂醛抗菌粘接剂的抗菌性能
2.2.1 各组粘接剂表面黏附细菌菌落计数和粘接剂抗菌率 各组粘接剂表面黏附细菌菌落计数以及抗菌率见表1。与对照组比较,质量分数2%、4%、6%和8%肉桂醛组菌落计数明显降低(P<0.05);与质量分数2%肉桂醛组比较,质量分数4%、6%和8%肉桂醛组菌落计数明显降低(P<0.05);4%、6%和8%肉桂醛组菌落计数抗菌率均高于99%,表明粘接剂具有明显的抗菌效果。
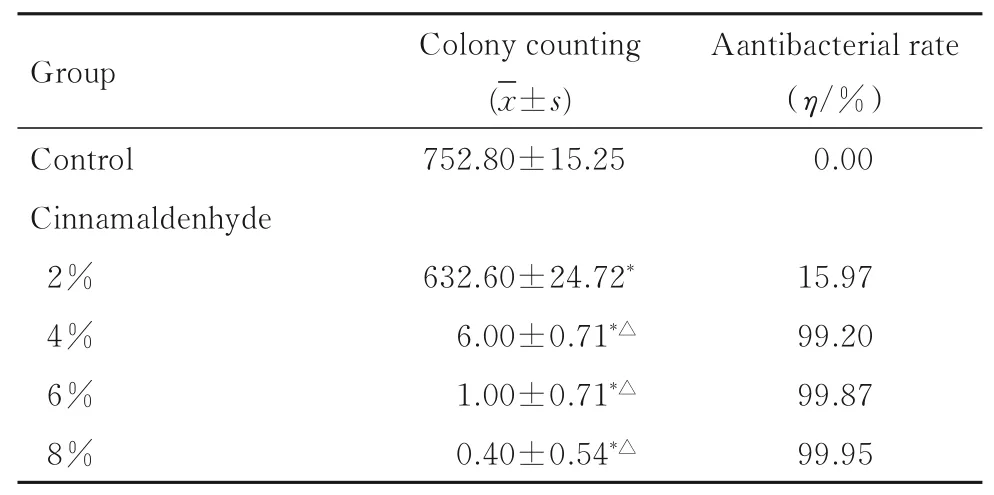
表1 各组粘接剂菌落计数和抗菌率Tab.1 Colony counting and antibacterials rates of adhesive in various groups(n=5)
2.2.2 试件表面活/死细菌染色形态 各组的活/死细菌染色实验结果显示:随着粘接剂中肉桂醛含量的逐渐升高,试件表面黏附的细菌总量明显减少,且细菌染色逐渐由绿色变为橙色和红色,表明活菌数量明显降低。见图1。
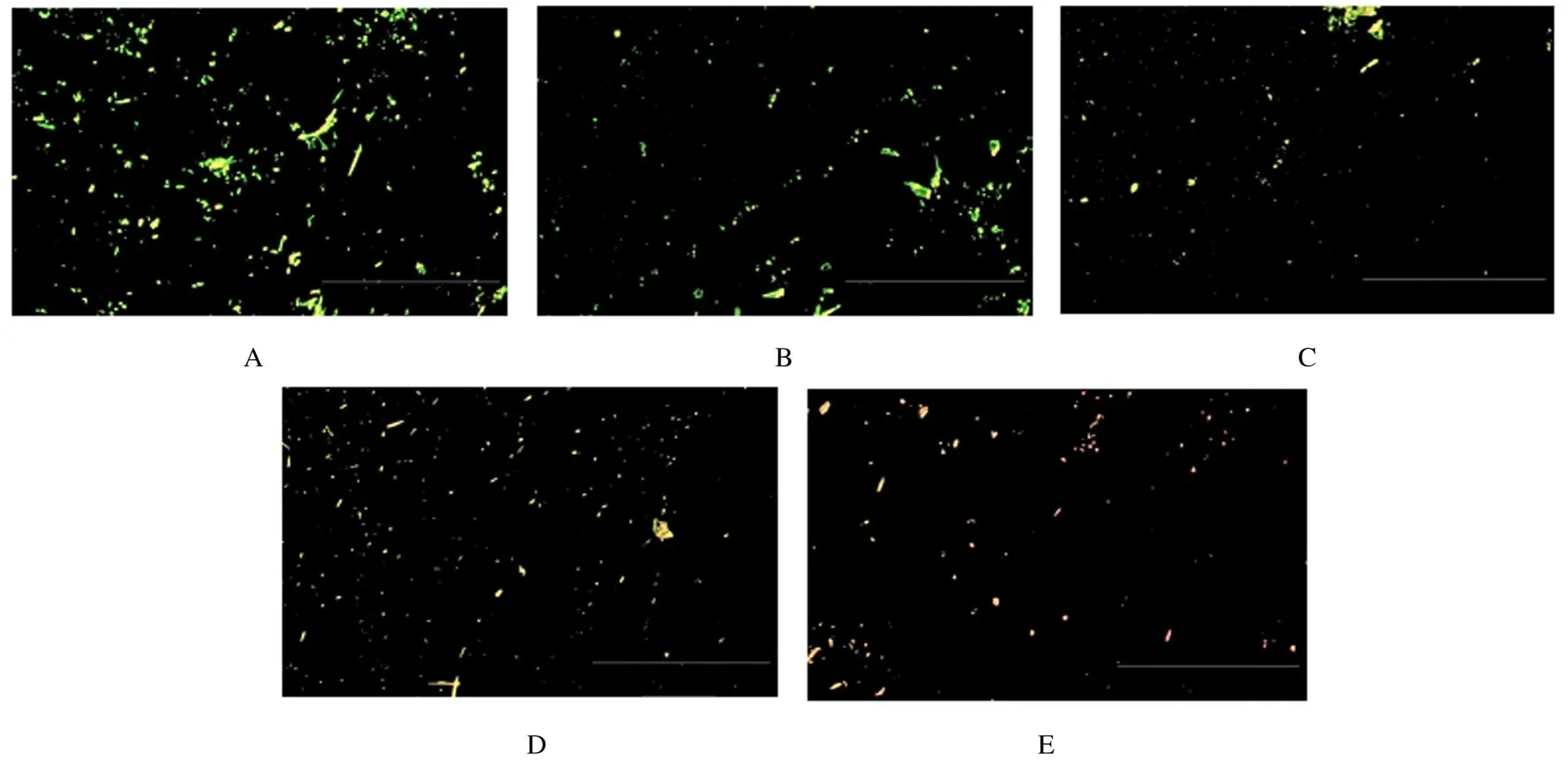
图1 试件表面活/死细菌染色形态图(Bar=100 μm)Fig.1 Morphology of live/dead bacterial staining on surface of specimens(Bar=100 μm)
2.3 各组肉桂醛抗菌粘接剂体外细胞毒性实验
各组肉桂醛粘接剂体外细胞毒性实验结果以细胞毒性等级表示。与对照组比较,相同稀释倍数下抗菌粘接剂细胞毒性等级均无明显变化。见表2。
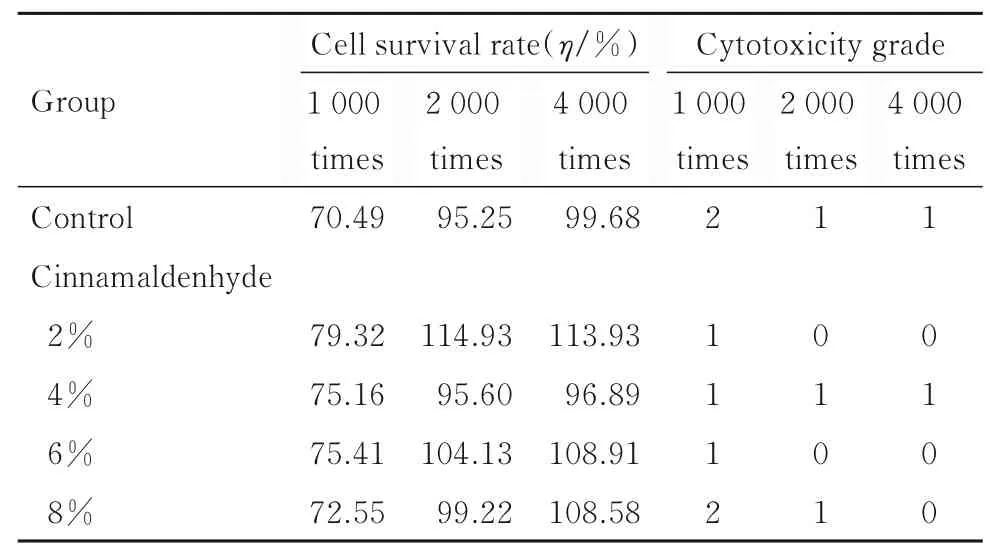
表2 各组粘接剂细胞生存率和细胞毒性等级Tab.2 Cell survival rates and cytotoxicity grades of adhesives in various groups
2.4 各组抗菌粘接剂微拉伸强度
微拉伸实验,与对照组(29.09 MPa±9.55 MPa)比较,质量分数4%、6%和8%肉桂醛组的微拉伸强度[(26.55 MPa±3.63 MPa)、(27.89 MPa±5.92 MPa)和(20.33 MPa±2.35 MPa)]差 异无统计学意义(P>0.05)。
3 讨论
为预防继发龋的发生,在牙本质粘接剂中加入抗菌剂的尝试已被证实其有效性,其中可光固化的季铵盐类单体已应用于商品粘接剂中[13]。被选择的抗菌剂除考虑抗菌性能外,其细胞毒性、是否容易诱导细菌产生耐药性、是否影响粘接剂单体聚合及粘接体系的粘接性能均是需要考虑的因素。
目前文献报道的抗菌剂,常见的包括银离子、金属氧化物[14]、抗生素[8]、抗菌肽[1]、氯己定、三氯生及衍生物、壳聚糖[7]和季铵盐化合物等多种类型,抗菌剂添加方式包括直接添加和载体负载等[15]。银离子类在应用中常采用纳米银的形式,抗菌性较强,可持续作用,但由于其重金属离子的属性,会导致粘接剂颜色变黑,影响修复美观效果,细胞毒性也较强;季铵盐化合物为接触性抗菌剂,抗菌性能与其碳链长度有关联,因其结构中含有双键,可与粘接剂单体聚合发挥持久抗菌作用,对粘接剂的粘接性能影响也较小,因而受到广泛关注[13],但细菌对季铵盐化合物易产生耐药性,长期应用的效果尚待研究;氯己定[6]和三氯生[16]等小分子抗菌剂,抗菌性能优良,所需添加比例不高,但也存在生物安全性和细菌耐药性等方面的不足。
本实验选择的抗菌剂肉桂醛,作为食品和化妆品中常用的防腐剂,具有较高的生物安全性,美国食品药品管理局(Food and Drug Administration,FDA)将肉桂醛认定为安全性添加剂[17]。我国《食品安全国家标准食品添加剂使用标准》(GB2760-2014)中也将肉桂醛批准为可在食品中使用的天然防腐剂[18]。肉桂醛作为肉桂精油的主要有效成分,对革兰阳性菌和革兰阴性菌均具有较强的广谱抗菌作用,包括大肠杆菌[19]、金黄色葡萄球菌、铜绿假单胞菌、伤寒沙门氏菌、肺炎克雷伯氏菌、嗜肺军团菌、变形杆菌和李斯特菌等[12]。肉桂醛对口腔内的常见菌及致病菌,如变异链球菌、远缘链球菌、牙龈卟啉单胞菌和嗜酸乳杆菌等也具有较强的抗菌性能[20]。
对肉桂醛抗菌作用机制的相关研究[17]显示:肉桂醛可抑制细菌细胞壁生物合成、膜功能和特异性酶活性,是其具有抗菌活性的主要原因:致死浓度肉桂醛会破坏细胞膜;较高但亚致死浓度肉桂醛为ATP 酶抑制剂;极低浓度的肉桂醛可以抑制参与细胞因子相互作用的酶。肉桂醛能够渗透进入细菌细胞内部,与细菌DNA 发生相互作用,影响DNA 的正常合成[21],而且能够改变细菌内部的离子平衡(Ca2+、K+和H+等),从而导致细菌死亡[22]。
本研究以MIC 和MBC 作为观察指标,检测肉桂醛对变异链球菌的抗菌性能。MIC 指的是肉眼不能看到细菌生长的最小药物浓度,MBC 定义为药物能杀灭99.9%细菌的最低浓度[23],二者能够反映药物的抗菌活性。本研究中,MIC 对变异链球菌的MIC 为250 mg·L-1,MBC 与MIC 相同。与其他抗菌剂比较,氟化钠对变异链球菌的MIC 为125 mg·L-1,MBC 为250 mg·L-1;氯己定对变异链球菌的MIC为30 mg·L-1,MBC为240 mg·L-1[24];而其他植物天然抗菌剂的MIC 和MBC 一般均高于肉桂醛,如茶树精油对变异链球菌的MIC 为0.125%(体积分数),MBC 为0.25%(体积分数)[25];咖啡提取物对变异链球菌 的MIC 为62.5 g·L-1,MBC 为125 g·L-1[26];红色蜂胶提取物对变异链球菌 的MIC为293 mg·L-1,MBC为1 172 mg·L-1[27]。与常见的天然抗菌剂比较,肉桂醛的抗菌效果十分明显;肉桂醛与口腔医学领域常用的防龋抗菌剂氟化钠和氯己定的抗菌性能相近或略低。
抗菌粘接剂的制备,采用高速搅拌机将肉桂醛与粘接剂均匀混合的物理混合方式。因商品粘接剂具有稳定的特性,且已广泛应用于临床,因此选择全酸蚀粘接剂SB2 作为原料和对照组。肉桂醛分子结构中所含双键与粘接剂单体中的酯双键性质不同,理论上二者不能发生聚合反应。前期研究结果[7,28]显示:能产生有效抗菌作用的三氯生壳聚糖在粘接剂中添加的质量分数为5%,抗菌单体甲基丙烯酰乙基十六烷基二甲基氯化铵在粘接剂中的有效浓度为3%(质量分数)。本实验中,细菌黏附实验菌落计数和抗菌率的结果均表明:在肉桂醛的质量分数为4%或以上时,抗菌率超过99%,即粘接剂有显著的抗菌效果。活/死细菌染色实验检测结果也显示:随着粘接剂中肉桂醛含量的逐渐升高,试件表面黏附的细菌总量以及活菌数量均明显降低,粘接剂对于细菌的黏附和材料表面黏附细菌的存活都有较强的抑制作用。
因MTT 法具有操作比较简单,良好的重复性,灵敏度相对较高,检测时间短,且经济适用性好等诸多优点,故将其应用于体外细胞毒性实验。在生物安全性检测方面,国内外学者对MTT 法的检测结果认可度较高。作为原材料的商品粘接剂本身有一定的细胞毒性,可能由部分粘接剂单体未固化导致。本实验采用GONG 等[29]的粘接剂细胞毒性检测方法,因对照组SB2 是在临床中已广泛应用的商品粘接剂,故以SB2 的体外细胞毒性为标准,判定肉桂醛的加入是否影响粘接剂的体外细胞毒性等级。本实验中,将肉桂醛加入商品粘接剂后,各组细胞生存率均高于70%,毒性等级低于2 级,与商品粘接剂SB2 比较,体外细胞毒性并未提高,甚至在稀释倍数较大的情况下对L929 细胞的生长发挥一定的促进作用。
粘接性能是牙本质粘接剂的基本性能,对粘接剂的改性,应以不降低其粘接强度为前提。微拉伸实验是检测牙本质粘接剂微拉伸性能最常用也是最直观的实验方法,但实验过程中需要用到人离体牙,且操作步骤复杂。本次抗菌实验中,已经筛选出2%肉桂醛组的抗菌效果不够理想,故在本实验中将其去掉。本研究结果显示:肉桂醛的加入,在为粘接剂提供抗菌性能的前提下未对其微拉伸强度产生明显不利影响。从粘接强度的实验结果推断,肉桂醛的加入对粘接剂的光敏感性以及双键转化率影响不明显,对以上表征的定量分析有待后续实验验证。
综上所述,为抑制树脂直接充填修复后继发龋的发生,本研究在检测了抗菌剂肉桂醛抗菌性能的基础上,将其引入牙本质粘接系统,制备了含肉桂醛的抗菌粘接剂,并进行了抗菌性能、体外细胞毒性和粘接性能的检测,实验结果表明:肉桂醛在粘接剂中的质量分数达4%时,能够发挥明显的抗菌作用,同时体外细胞毒性和粘接性能无明显降低。考虑到抗菌剂比例的升高有可能对粘接剂的粘接性能和体外细胞毒性等方面产生影响,应在保证粘接剂抗菌性能的基础上,尽量降低抗菌剂的比例,因此,本实验选择质量分数4%作为肉桂醛的最佳添加比例。本实验的研究结果为抗菌牙本质粘接剂的研究提供了新思路。

