miR-762 通过靶向调控NCOR1 表达对人舌鳞状细胞癌细胞增殖和凋亡的影响
唐乃高,郑根建
(海南医学院第一附属医院口腔科,海南 海口 570100)
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是最常见的头颈部恶性肿瘤之一,由于舌体复杂的淋巴网络和肌肉结构,其具有复发和转移率高,预后差,生存率低的特点[1-2]。寻找TSCC 进展中的重要调控分子,对指导其早期诊断及靶向治疗具有重要意义。微小RNA(miRNA)是一类长度为20~25 个核苷酸的非编码RNA 分子,可作为肿瘤抑癌或致癌因子调控肿瘤细胞生长、增殖、分化和凋亡等过程[3]。既往研究[4-7]显示:miR-762 在卵巢癌、头颈部鳞状细胞癌、乳腺癌和胰腺癌等组织中高表达,且与患者不良预后相关;同时也有研究者在口腔鳞状细胞癌小鼠模型的肿瘤组织中发现miR-762 高表达[8],然而miR-762 在人TSCC 组织中表达情况及其对TSCC发展的影响目前还未见报道。核受体辅助抑制因子1(nuclear receptor corepressor 1,NCOR1)是近些年发现的与肿瘤有关的因子,在前列腺癌[9]、非小细胞肺癌[10]和胃肠道间质瘤[11]等肿瘤组织中低表达,并作为肿瘤抑制因子发挥作用,然而NCOR1 在TSCC 组织中的表达及作用依然未知。为此,本研究通过检测TSCC 组织中miR-762 和NCOR1 的表达水平并分析两者表达水平的相关性,进一步以体外培养的TSCC 细胞株为研究对象,探讨miR-762 与NCOR1 的靶向关系以及对TSCC 细胞增殖和凋亡的影响,为TSCC 临床诊断和治疗提供新的分子标志物和靶点。
1 材料与方法
1.1 组织来源收集2016 年9 月—2019 年1 月于本院诊治的TSCC 患者癌组织及其癌旁正常组织48 例(距离肿瘤边缘≥2 cm),TNM 分期:Ⅰ期8 例、Ⅱ期10 例、Ⅲ期16 例和Ⅳ期14 例,其中男性28 例,女性20 例,年龄为15~72 岁,中位年龄44 岁,所有患者均经病理组织学确诊,且术前均未接受放化疗,均签署知情同意书。
1.2 细胞、主要试剂和仪器人正常舌上皮细胞Hacat 及人舌TSCC 细胞Tca-8113、CAL-27、SCC-15 和SCC-9 购自美国典型培养物保藏中心;miR-762 inhibitor 及其阴性对照 inhibitor-NC(scramble 序列)和NCOR1 干扰质粒(si-NCOR1)及其阴性对照质粒(si-NC)均由上海吉玛制药技术有限公司设计合成,LipofectamineTM2000 购自美国Invitrogen 公司,胎牛血清、MTT 检测试剂盒、EdU 细胞增殖检测试剂盒和细胞凋亡检测试剂盒购自上海碧云天生物研究所,双荧光素酶检测试剂盒购自美国Promega 公司,实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR )试剂盒和反转录试剂盒购自日本TaKaRa 公司,NCOR1、活化半胱氨酸天冬氨酸蛋白酶3(cleaved-Caspase-3)、B 细胞淋巴瘤2(B-cell lymphoma 2,Bcl-2)、Bcl-2 相 关X 蛋 白(Bcl-2 associated X protein,Bax)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购于美国Cell Signaling Technology公司;蛋白电泳转移系统购于美国Bio-Rad 公司,PCR 扩增仪购于美国ABI 公司,全自动酶标仪购于法国巴德斯公司。
1.3 细胞培养所有细胞复苏后按照说明书培养于含10%胎牛血清的培养基中,在37 ℃、5% CO2的细胞培养箱内培养,待细胞生长至80%~90%时进行传代,选择对数生长期的细胞用于实验研究。
1.4 细胞感染和分组处理取对数生长期的CAL-27 细胞接种于6 孔细胞培养板中,待细胞融合度达到70% 时,采用LipofectamineTM2000 将miR-762 inhibitor 及其阴性对照inhibitor-NC 分别或同时与si-NCOR1 及其阴性对照质粒si-NC 转染至CAL-27 细胞中,分别命名为inhibitor-NC 组、miR-762 inhibitor 组、si-NC 组、si-NCOR1 组 和miR-762 inhibitor+si-NCOR1 组,另取不做任何处理的CAL-27 细胞作为空白对照组,孵育6 h 后更换新鲜培养基继续培养,收集转染48 h 的细胞,采用RT-qPCR 和Western blotting 法检测细胞转染效率。
1.5 荧光素酶报告实验验证miR-762 与NCOR1 的靶向调控关系利用TargetScan 软件(http://www.targetscan.org/vert_71/)预 测miR-762 在NCOR1 3'-UTR 区域是否存在结合位点。构建NCOR1 野生型(WT)和突变型(MUT)荧光素酶报告基因质粒,将其分别与miR-762 mimic 或miR-NC 共转染至293T 细胞中。转染48 h 后,根据双荧光素酶报告基因试剂盒说明书进行测定,以萤火虫荧光素酶活性和肾荧光素酶活性比值表示荧光素酶的相对活性。
1.6 RT-qPCR 法检测组织和细胞中miR-762 和NCOR1 mRNA 表达水平收集癌组织、癌旁组织及各细胞样本,采用Trizol 法提取各样本的总RNA,紫外分光光度计测定总RNA 浓度。取2 μg总RNA 采用逆转录试剂盒合成cDNA,以cDNA为模板进行qRT-PCR 扩增。miR-762:正向引物5'-ACACGGGGCUGGGGCCGGGGCCGAGCGCCTC-3',反向引物 5'-CTCAGGGGCUGGGGCCGGGGCCGAGCCAGA-3';NCOR1:正向引物5'-CCCAGCAACGAGAGGAATCA-3',反向引物 5'-GTCCATGGGAGGAGGCTTGT-3';U6:正向引物5'-CTCGCTTCGGCAGCACA-3',反向引物 5'-AACGCTTCACGAATTTGCGT-3';GAPDH:正向引物5'-GTATCGTGGAAGGACTCATGAC-3',反向引物5'-ACCACCTTCTTGATGTCATCAT-3'。反应条件:95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,共40个循环。以U6或GAPDH 为内参,采用2-△△Ct法计算组织和细胞中miR-762 及NCOR1 mRNA 表达水平。
1.7 Western blotting 法检测各组细胞中NCOR1 cleaved-Caspase-3、Bax 和Bcl-2 蛋白表达水平收集各细胞样本,加入适量裂解液于冰上充分裂解,4 ℃条件下12 000 r·min-1离心20 min,弃上清,采用考马斯亮蓝法测定蛋白浓度。取等量蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,并将蛋白转移至聚偏二氟乙烯膜上,5%脱脂牛奶室温封闭30 min,分别加入NCOR1、cleaved-Caspase-3、Bax、Bcl-2 和GAPDH 抗 体(1∶1 000),4 ℃孵育过夜。次日,洗膜后加入HRP 标记的二抗,室温孵育1 h,洗膜,滴加化学发光试剂,于暗室中显影分析。以GAPDH 为内参计算目标蛋白相对表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.8 MTT 法检测各组细胞增殖活性取转染后各组细胞,调整细胞浓度为每孔2×103个细胞,接种于96 孔细胞培养板,置于37 ℃、5% CO2培养箱中分别培养12、24、48 和72 h,弃培养液,每孔加入20 μL MTT 溶液,37 ℃避光继续培养4 h,然后吸掉上清,每孔加入150 μL DMSO 溶解液,置摇床上低速振荡10 min,使结晶物充分溶解,采用酶标仪检测490 nm 波长处各孔的吸光度(A)值,以A(490)值表示细胞增殖活性。
1.9 EdU 法检测各组细胞EdU 染色阳性细胞率取转染后各组细胞,分别接种于24 孔细胞培养板,48 h 后加入含50 μmol EdU的培养基孵育12 h,弃掉培养液,PBS 缓冲液漂洗3 次,室温下用冰甲醇固定细胞15 min,按照EdU 试剂盒说明书进行染色,最后置于荧光显微镜下观察,每孔随机选择3 个视野,并计算EdU 染色阳性细胞率。EdU 染色阳性细胞率=EdU 染色阳性细胞总数目/总细胞数目×100%。
1.10 流式细胞术检测各组细胞凋亡率取转染后的细胞,接种于6 孔细胞培养板中培养48 h 后收集细胞,4 ℃条件下1 000 r·min-1离心5 min,弃上清,PBS 缓冲液洗涤3 次,重悬细胞后加入5 μL Annexin Ⅴ和10 μ L 碘化丙啶,室温避光孵育20 min,采用流式细胞术检测各组细胞凋亡率。
1.11 统计学分析采用SPSS 20.0 软件进行统计学分析。各组细胞增殖活性,组织和细胞中miR-762 和NCOR1 mRNA 表达水平,EdU 染色阳性细胞率,NCOR1、cleaved-Caspase-3、Bax 和Bcl-2蛋白表达水平和细胞凋亡率均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以α=0.05 为检验水准。
2 结果
2.1 TSCC 组织和癌旁正常组织中miR-762 及NCOR1 mRNA 表达水平以及两者表达水平的相关性与癌旁正常组织比较,TSCC 组织中miR-762表达水平明显升高(P<0.01),NCOR1 mRNA 表达水平明显降低(P<0.01)。Pearson 相关性分析结果显示:TSCC 患者癌组织中miR-762 和NCOR1 mRNA 表达水平呈负相关关系(r=-0.711,P=0.003)。见图1。

图1 TSCC 组织及癌旁正常组织中miR-762 和NCOR1 mRNA 表达水平Fig.1 Expression levels of miR-762 and NCOR1 mRNA in TSCC and paracancerous normal tissues
2.2 TSCC 细胞中miR-762 和NCOR1 mRNA 及蛋白表达水平与人正常舌上皮细胞Hacat 比较,人TSCC 细胞Tca-8113、CAL-27、SCC-15 和SCC-9 中miR-762 表达水平明显升高(P<0.01),NCOR1 mRNA 和蛋白表达水平明显降低(P<0.01)。选择CAL-27 细胞进行后续实验。见图2 和表1。
表1 TSCC 细胞中miR-762 和NCOR1 mRNA 及蛋白表达水平Tab.1 Expression levels of miR-762 and NCOR1 mRNA and proteins in TSCC cells(n=3,)

表1 TSCC 细胞中miR-762 和NCOR1 mRNA 及蛋白表达水平Tab.1 Expression levels of miR-762 and NCOR1 mRNA and proteins in TSCC cells(n=3,)
*P<0.01 compared with Hacat cells.
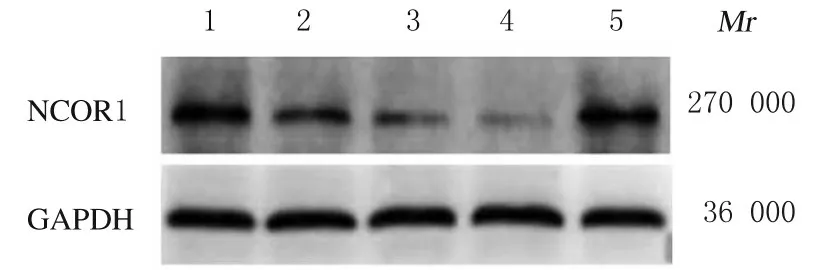
图2 Western blotting 法检测各种细胞中NCOR1 蛋白表达电泳图Fig.2 Electrophoregram of expressions of NCOR1 proteins in various cells detected by Western blotting method
2.3 转染miR-762 inhibitor 后CAL-27 细胞中miR-762 和NCOR1 mRNA 及蛋白表达水平与空白对照组和inhibitor-NC组比较,miR-762 inhibitor组细胞中miR-762 表达水平明显降低(P<0.01),NCOR1 mRNA 和蛋白表达水平明显升高(P<0.01)。见图3 和表2。
表2 转染miR-762 inhibitor后各组CAL-27细胞中miR-762和NCOR1 mRNA 及蛋白表达水平Tab.2 Expression levels of miR-762 and NCOR1 mRNA and protein in CAL-27 cells after transfected with miR-762 inhibitor(n=3,)

表2 转染miR-762 inhibitor后各组CAL-27细胞中miR-762和NCOR1 mRNA 及蛋白表达水平Tab.2 Expression levels of miR-762 and NCOR1 mRNA and protein in CAL-27 cells after transfected with miR-762 inhibitor(n=3,)
*P<0.01 compared with blank control group;△P<0.01 compared with inhibitor-NC group.
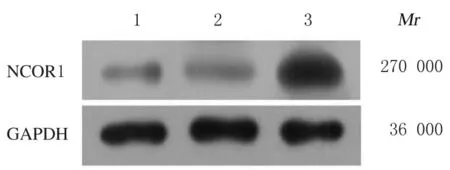
图3 Western blotting 法检测转染miR-762 inhibitor后各组CAL-27 细胞中NCOR1 蛋白表达电泳图Fig.3 Electrophoregram of expressions of NCOR1 protein in CAL-27 cells after transfected with miR-762 inhibitor in various groups detected by Western blotting method
2.4 荧光素酶报告实验检测miR-762 与NCOR1 的靶向调控关系TargetScan 软件检测结果显示:miR-762 在NCOR1 基因3'-UTR 区域存在靶向结合位点,见图4。荧光素酶报告基因实验结果显示:野生型细胞中转染mimic-NC 后荧光素酶活性(1.00±0.05)高于转染miR-762 mimic(0.30±0.05)(P<0.01)。而突变型细胞中转染mimic-NC 后(0.99±0.02)和miR-762 mimic 后(1.02±0.04)荧光素酶活性比较差异无统计学意义(P>0.05)。提示NCOR1 是miR-762 的靶基因。
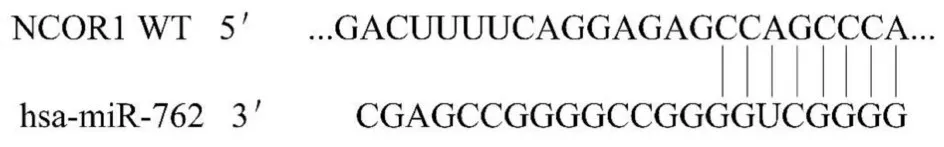
图4 miR-762 与NCOR1 的靶向结合位点Fig.4 Targeted binding sites of miR-762 and NCOR1
2.5 转染si-NCOR1 后CAL-27 细胞中NCOR1 mRNA 和蛋白表达水平与空白对照组和si-NC 组比较,si-NCOR1 组细胞中NCOR1 mRNA 和蛋白表达水平明显降低(P<0.01)。见图5 和表3。
表3 各组CAL-27 细胞中NCOR1 mRNA 和蛋白表达水平Tab.3 Expression levels of NCOR1 mRNA and protein in CAL-27 cells in various groups(n=3,)
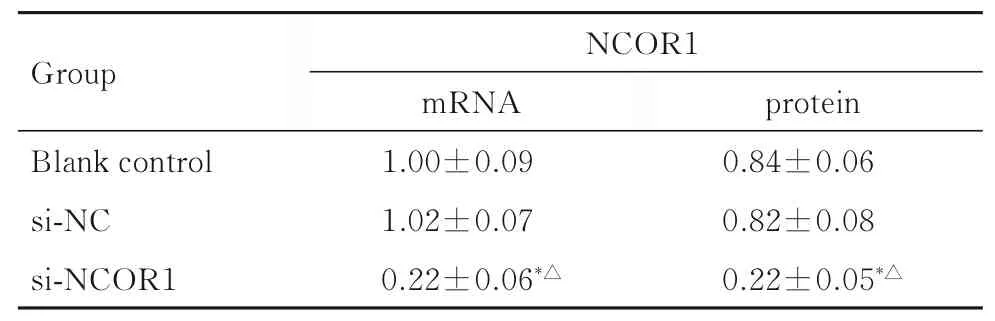
表3 各组CAL-27 细胞中NCOR1 mRNA 和蛋白表达水平Tab.3 Expression levels of NCOR1 mRNA and protein in CAL-27 cells in various groups(n=3,)
*P<0.01 compared with blank control group;△P<0.01 compared with si-NC group.

图5 Western blotting 法检测各组CAL-27 细胞中NCOR1 蛋白表达电泳图Fig.5 Electrophoregram of expressions of NCOR1 protein in CAL-27 cells in various groups detected by Western blotting method
2.6 各组细胞增殖活性和EdU 染色阳性细胞率空白对照组、inhibitor-NC、miR-762 inhibitor、si-NC、si-NCOR1 和miR-762 inhibitor+si-NCOR1组EdU 染色阳性细胞率分别为(44.23±3.05)%、(45.60±5.25)%、(26.29±3.26)%、(46.94±5.20)%、(64.33±3.18)%和(37.47±6.11)%,与空白对照组和inhibitor-NC 组比较,miR-762 inhibitor 组细胞增殖活性和EdU 染色阳性细胞率明显降低(P<0.01);与空白对照组和si-NC 组比较,si-NCOR1 组细胞增殖活性和EdU 染色阳性细胞率明显升高(P<0.01);与miR-762 inhibitor 组比较,miR-762 inhibitor+si-NCOR1 组细胞增殖活性和EdU 染色阳性细胞率明显升高(P<0.01)。见表4 和图6。
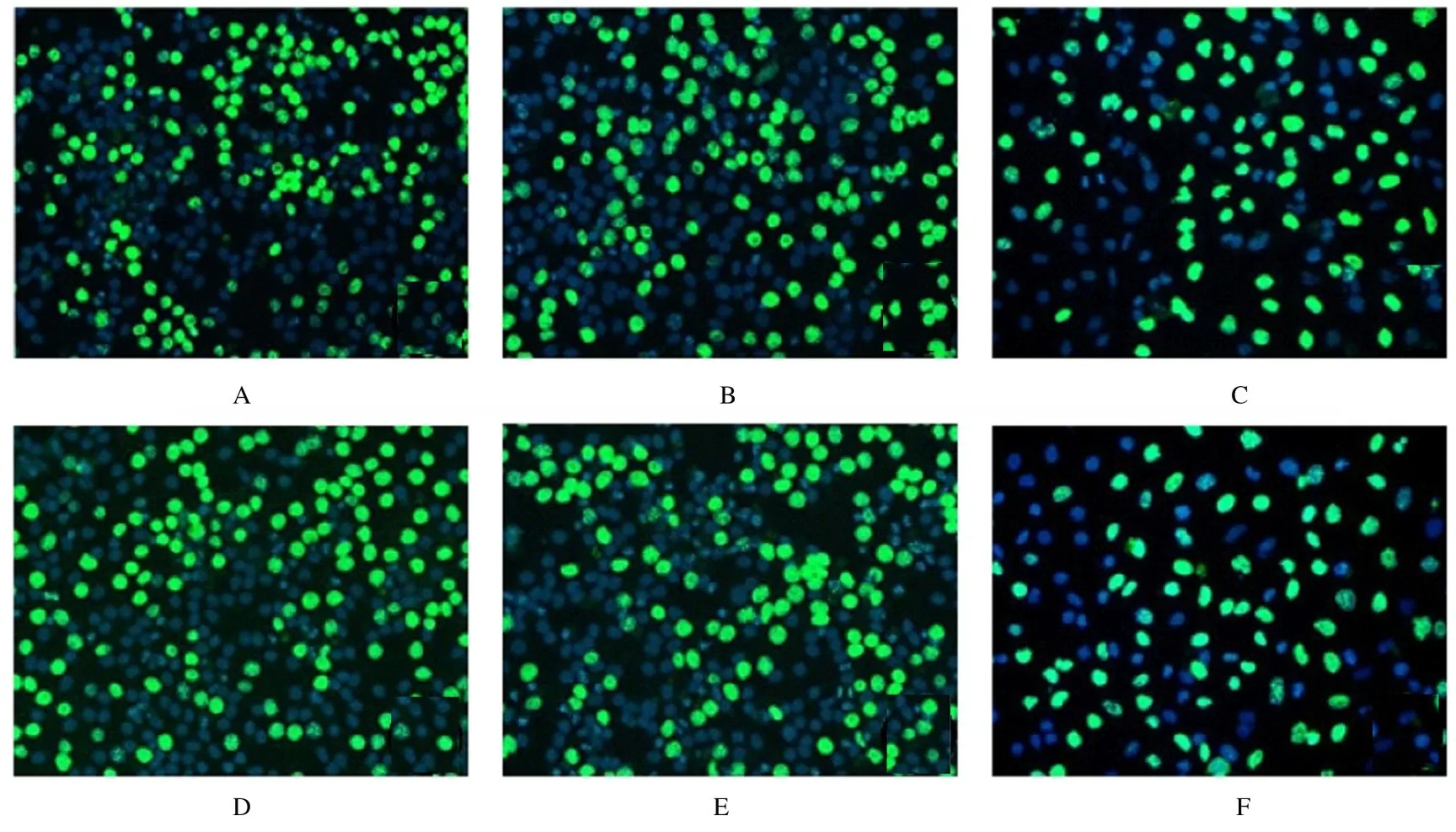
图6 各组细胞EdU 染色结果(×200)Fig.6 Results of EdU staining of cells in various groups (×200)
表4 各组细胞增殖活性Tab.4 Proliferation activities of cells in various groups(n=3,)

表4 各组细胞增殖活性Tab.4 Proliferation activities of cells in various groups(n=3,)
*P<0.01 compared with blank control group;△P<0.01 compared with inhibitor-NC group;#P<0.01 compared with si-NC group;▲P<0.01 compared with miR-762 inhibitor group.
2.7 各组细胞中cleaved-Caspase-3、Bax 和Bcl-2蛋白表达水平及各组细胞凋亡率空白对照组、inhibitor-NC 组、miR-762 inhibitor 组、si-NC 组、si-NCOR1 组 和miR-762 inhibitor+si-NCOR1 组细胞凋亡率分别为(3.15±0.42)%、(3.22±0.36)%、(72.09±3.37)%、(3.55±0.36)%、(1.23±0.10)%和(58.05±4.32)%。与空白对照组和inhibitor-NC 组比较,miR-762 inhibitor 组细胞凋亡率明显升高(P<0.01);细胞中cleaved-Caspase-3 和Bax 蛋白表达水平明显升高(P<0.01),Bcl-2 蛋白表达水平明显降低(P<0.01);与空白对照组和si-NC 组比较,si-NCOR1 组细胞凋亡率明显降低(P<0.01),细胞中cleaved-Caspase-3 和Bax 蛋白表达水平明显降低(P<0.01),Bcl-2 蛋白表达水平明显升高(P<0.01);与miR-762 inhibitor 组比较,miR-762 inhibitor+si-NCOR1 组细胞凋亡率明显降低(P<0.01),细胞内cleaved-Caspase-3 和Bax 蛋白表达水平明显降低(P<0.01),Bcl-2 蛋白表达水平明显升高(P<0.01)。见图7、图8 和表5。
表5 各组细胞中cleaved-Caspase-3、Bax 和Bcl-2 蛋白表达水平Tab.5 Expression levels of cleaved-Caspase-3,Bax and Bcl-2 proteins in cells in various groups(n=3,)

表5 各组细胞中cleaved-Caspase-3、Bax 和Bcl-2 蛋白表达水平Tab.5 Expression levels of cleaved-Caspase-3,Bax and Bcl-2 proteins in cells in various groups(n=3,)
*P<0.01 compared with blank control group;△P<0.01 compared with inhibitor-NC group;#P<0.01 compared with si-NC group;▲P<0.01 compared with miR-762 inhibitor group.
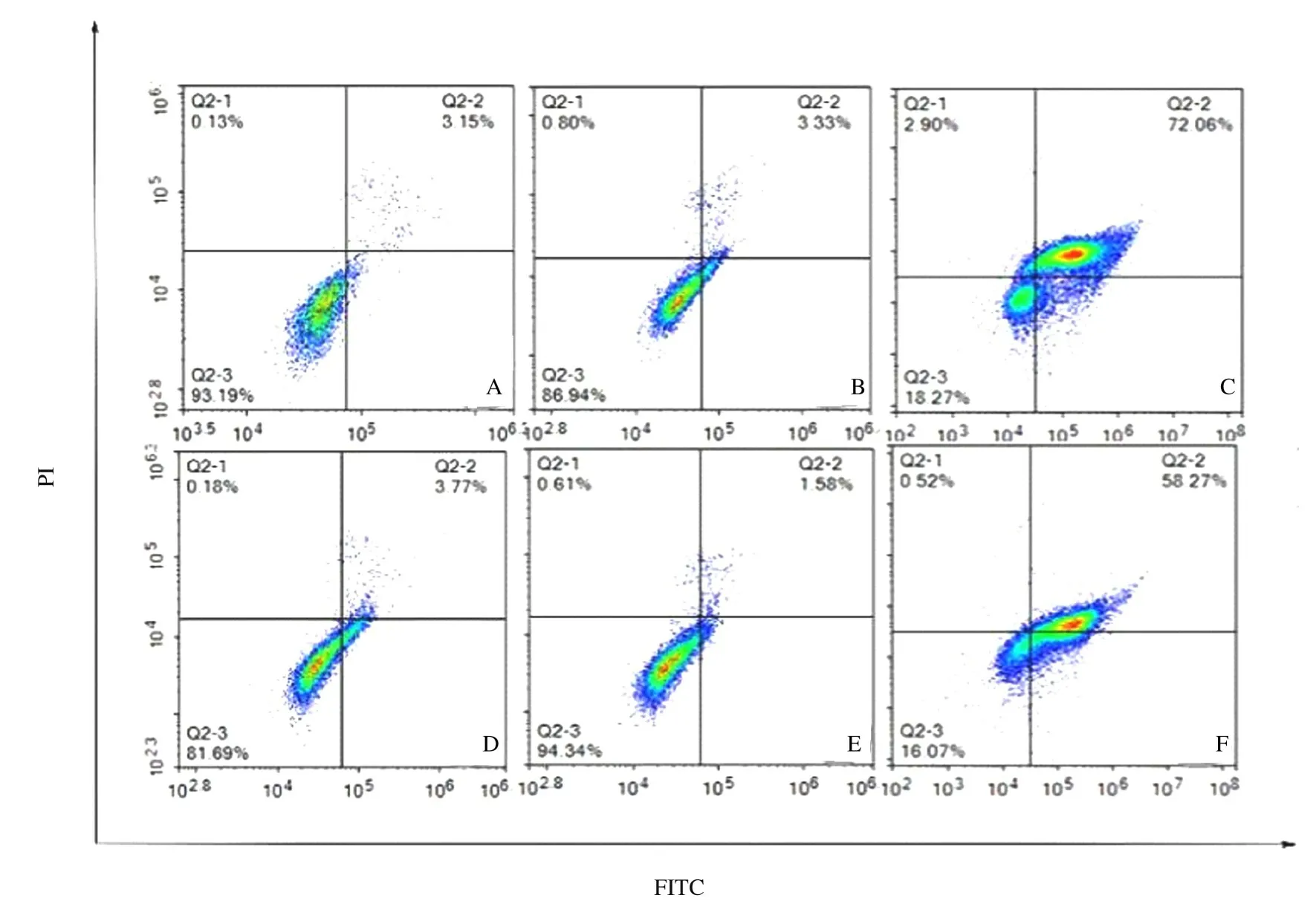
图7 各组细胞凋亡率Fig.7 Apoptotic rates of cells in various groups

图8 Western blotting 法检测各组细胞中cleaved-Caspase-3、Bax 和Bcl-2 蛋白表达电泳图Fig.8 Electrophoregram of expressions of cleaved-Caspase-3,Bax and Bcl-2 proteins in cells in various groups detected by Western blotting method
3 讨论
人体有超过60%的蛋白质编码基因上都具有miRNAs 的结合位点,在细胞生长、增殖、凋亡和迁移过程中起到重要的调控作用,还可以通过调控蛋白编码基因的表达影响癌症的发生和发展[12]。有多种miRNA 参与了TSCC 的发生进程[13-14],miR-762 被证实在多种肿瘤组织中高表达[4-8],但关于其在TSCC 中的表达情况和作用却未见报道。NCOR1 是近些年来发现的肿瘤抑制因子,在多种肿瘤组织中低表达,但未见其在TSCC 中的相关报道。本研究结果显示:在TSCC 组织及TSCC 细胞中miR-762 的表达水平明显高于其在对应的癌旁组织及正常舌上皮细胞中的表达,而NCOR1 在TSCC 组织及TSCC 细胞中mRNA 表达水平明显低于其在对应的癌旁组织及正常舌上皮细胞中的表达,且Pearson 相关性检验结果显示在TSCC 组织中miR-762 与NCOR1 mRNA 表达水平呈负相关关系,提示miR-762 和NCOR1 可能为TSCC 的差异基因。通过TargetScan 软件检测结果显示:miR-762 基因序列上存在NCOR1 的结合位点,并进一步通过荧光素酶报告实验验证了两者的靶向关系。
研究[15-16]显示:NCOR1 在膀胱癌细胞中的过表达导致了细胞增殖能力的增强。而对NCOR1 基因进行miRNA 干扰可以提高基因的调节能力,有效地降低增殖反应。为明确miR-762 和NCOR1 在TSCC 中的具体作用,本研究选择TSCC 细胞CAL-27 作为研究对象,通过在细胞中转染miR-762 inhibitor 或si-NCOR1 来抑制细胞中miR-762 或NCOR1 的表达,观察其对TSCC 细胞增殖和凋亡的影响,结果显示:转染miR-762 inhibitor 明显上调了CAL-27 细胞中的NCOR1 蛋白表达,同时,抑制miR-762 表达能明显抑制CAL-27 细胞增殖,而抑制NCOR1 表达能促进CAL-27 细胞增殖,同时抑制miR-762 和NCOR1 表达能减弱miR-762 对CAL-27 细胞增殖的抑制作用,说明miR-762 能负向靶向NCOR1,miR-762 抑制TSCC 细胞的增殖作用与靶向上调NCOR1 表达有关。
细胞凋亡是一种程序性的细胞死亡,通过内源性与外源性2 种独立的通路调控[17-18],其中线粒体介导的内源性通路与Bax、Bcl-2 和Caspase-3 等蛋白有密切关联:抗凋亡蛋白Bcl-2 通过抑制细胞色素C 的释放维持线粒体外膜完整性,促凋亡蛋白Bax 通过增加线粒体外膜的通透性促进细胞色素C进入细胞质,而Caspase-3 是细胞凋亡蛋白级联反应中的下游关键蛋白,当Bcl-2/Bax 表达失衡,Caspase 级联反应被激活,细胞凋亡程序便会启动[19-20]。本研究结果显示:与空白对照组比较,miR-762 inhibitor 组细胞凋亡率和细胞内cleaved-Caspase-3 及Bax 蛋白水平明显升高,Bcl-2 蛋白水平明显下调;而si-NCOR1 组细胞凋亡率和细胞内cleaved-Caspase-3 及Bax 蛋白水平明显下降,Bcl-2蛋白水平明显升高;与单独转染miR-762 inhibitor比较,同时转染miR-762 inhibitor 和si-NCOR1 后细胞凋亡率下降,说明NCOR1 下调能够回补miR-762 对CAL-27 细胞的抑制作用。
综上所述,miR-762 在TSCC 组织和细胞中高表达,NCOR1 在TSCC 组织和细胞中低表达,抑制miR-762 表达能通过靶向上调NCOR1 表达抑制TSCC 细胞增殖,促进细胞凋亡。miR-762 可能成为TSCC 的一种新的诊断分子标志物和潜在的治疗靶标。

