盆底肌损伤后修复过程中囊泡转运相关基因的表达
陈 珏,洪 莉,李素廷,王 治,陈 茂,郝梦磊,肖 雅,闵 洁,胡 鸣
(武汉大学人民医院妇产科,湖北 武汉 430060)
压力性尿失禁(stress urinary incontinence,SUI)是指在咳嗽、打喷嚏、大笑、跑步或举重等身体运动或活动时,腹内压增加使膀胱的压力迅速升高而导致不自主的尿液溢出。我国女性SUI 的总体发病率约占18.9%,且发病率随着人口的老龄化而不断攀升[1]。盆底肌是以肛提肌为主要成分的盆底组织支持结构,以骨骼肌为主要组成[2]。衰老、妊娠和阴道分娩等因素可造成盆底肌收缩力下降或结构性损伤,盆底支持结构无法对抗腹腔压力,最终导致SUI 和盆底器官脱出[1]。经阴道分娩的产妇中有10%~30% 存在明显的肛提肌撕裂,其损伤可能是造成产后SUI 发生的主要因素[3]。
肌肉损伤后主要通过肌卫星细胞的激活,在生肌调节因子的调节和规范下[4],增殖并分化为新的肌纤维或与受损肌纤维融合,以促进损伤后骨骼肌的修复,其中涉及着复杂的信号调控网络[5]。内质网-高尔基体之间存在着蛋白囊泡的转运[6],分泌性囊泡装载着多种与肌肉修复相关的细胞因子和miRNA[7],通过促进肌肉和血管生成,从而参与到肌肉功能调节和损伤修复过程[8]。现有研究主要关注促进骨骼肌损伤修复的细胞因子[9-10]及其作用机制[11-12],在囊泡转运过程中起作用的因素鲜有报道,因此探讨肌肉修复过程中调节囊泡转运的相关因素,有望为肌肉损伤后再生修复的治疗提供新的靶点。
基因表达综合数据库(Gene Expression Omnibus,GEO)是一种高通量数据表达数据库,收录并整理了全球研究者所上传的微阵列芯片、二代测序及其他形式的高通量基因组数据[13-14]。本研究首先收集GEO 数据库中与肌肉损伤相关的数据集,通过GEO2R 分析筛选共同上调的差异表达基因,并确认在肌肉损伤后的不同进程中囊泡转运相关基因的表达情况。通过经典的阴道扩张模拟产伤法构建小鼠盆底肌损伤模型[15],采用实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)法对损伤后不同时间点的盆底肌中相关囊泡转运基因的表达进行分析,寻找在盆底肌损伤修复过程中可能调节囊泡转运的相关分子,以期为SUI 的研究提供新的思路。
1 材料与方法
1.1 实验动物分组选取SPF 级健康12 周龄的C57BL/6 雌性处鼠32 只,动物生产许可证号:SCXK(辽)2020-0001,体质量18~23 g,平均体质量(20.26±1.04)g。雌性处鼠随机抽取8 只作为对照组,剩余小鼠通过阴道扩张+远端牵引法构建盆底肌损伤模型[15-16],将24 只造模成功雌鼠随机分为3 组,每组8 只,根据损伤与否及损伤后的时间分为造模1 d 组、造模3 d 组和造模5 d 组。所有小鼠均购于武汉大学人民医院实验动物中心,本研究符合动物保护、动物福利和伦理原则以及国家实验动物伦理福利的相关规定,且已获得武汉大学人民医院伦理委员会批准。
1.2 主要试剂和仪器RNAiso Plus(Total RNA 提取试剂,Code No.9108,宝日医生物技术有限公司),HifairTMⅡ1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus,11123ES)和HieffTMqPCR SYBR®Green Master Mix(Low Rox Plus,11202ES)(上海翊圣生物科技有限公司)。NanoDrop ™分光光度计(美国Thermo Fisher Scientific 公司),RT-qPCR 仪(美国Appllend Biosystems 公司),6-Fr 导尿管(大连库利艾特医疗制品有限公司),30 g 钢制砝码(上海众渊公司)。
1.3 肌肉损伤数据集查找和筛选以“muscle regeneration”为关键词在GEO 中搜索与肌肉再生修复相关的数据集,选取 GSE5413[17]、GSE45577[18]和GSE469[19-20]3 个数据集,采用GEO2R 以及R 语言分子包进行数据处理分析,筛选出3 个基因集里共同上调的差异表达基因,通过文献检索综合筛选出与细胞内囊泡转运相关的基因。
1.4 小鼠盆底肌损伤模型的构建采用1.5%异氟烷对小鼠进行气体麻醉后取仰卧位固定,使用外科消毒润滑剂润滑避免阴道裂伤,有序地插入和取出阴道扩张器。使用校正6Fr 弗利导尿管,将导尿管尖端部分剪除,确保尖端球囊密闭性良好,将其润滑插入阴道,用5/0 丝线收缩阴道周围皮肤将导尿管固定好。导尿管球囊内注入生理盐水0.3 mL,直径约为8 mm,相当于新出生小鼠脑部直径。导尿管末端连接一固定于实验台边缘的定滑轮,滑轮另一端悬挂30 g 钢制砝码,1 h 后撤掉牵引,球囊放水并拔除。对照组小鼠仅将尿管置于阴道中,不进行导尿管球囊注水扩张及牵引,放置1 h 后拔出[15-16]。
1.5 小鼠盆底肌取材将各组小鼠眼球放血,断颈法处死后用眼科剪和镊子打开盆腔,分离内脏和脂肪组织,暴露耻骨联合并从中间剪断,依次轻轻减去双侧耻骨联合前段和阴道壁,暴露肛提肌组织。用手术刀沿盆壁及脊柱剥离肛提肌组织,留取直肠末端作为标记。获取盆底肌组织后立即装入洁净干燥的冻存管内,置于液氮罐中保存。
1.6 RT-qPCR 法检测各组小鼠盆底肌组织中目标基因表达水平使用RNAiso Plus 提取盆底肌组织的总RNA,并通过NanoDrop™分光光度计测定RNA 浓度和纯度。使 用HifairTMⅡ1st Strand cDNA Synthesis SuperMix for RT-qPCR 将来自总RNA 的样品RNA 逆转为cDNA。使用HieffTMqPCR SYBR®Green Master Mix(Low Rox Plus)进行RT-qPCR。反应条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火延伸30 s,重复40 个循环;熔解曲线:95 ℃维持15 s,60 ℃维持60 s,95 ℃维持15 s。引物序列如表1 所示。以GAPDH作为参考基因,采用2-ΔΔCt法计算每个基因的表达水平,实验重复3 次。

表1 RT-qPCR 引物序列Tab.1 Primer sequences of RT-qPCR
1.7 数据处理使用GEO 数据库自带的GEO2R在线分析工具处理基因表达数据集,分析并筛选出差异表达基因,筛选标准为P<0.05 且倍数变化(fold change,FC)对数值的绝对值|log(FC)|>2。使用R 软件分析差异表达基因,可视化为热图。使用FunRich 软件生成韦恩图,筛选出3 个数据集共差异表达的基因,进行下一步分析。
1.8 统计学分析采用GraphPad Prism 7.0 软件进行统计学分析。各组小鼠盆底肌组织中目标基因表达水平以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 差异基因分析和筛选以“muscle regeneration”为关键词搜索与肌肉再生修复相关的GEO 数据集,选取GSE5413、GSE45577 和GSE469 3 个数据集,以损伤后第3 天数据与对照组进行比对,采用GEO2R 分析差异表达基因,使用R软件ggplot2程序包使差异表达基因可视化,生成火山图(图1A),使用FunRich 软件生成韦恩图,结果显示3 个数据集共差异表达基因有614 个。见图1B。

图1 GSE5413、GSE45577 和GSE469 3 个数据集火山图(A)和在肌肉损伤时共同高表达基因的韦恩图(B)Fig.1 Volcano diagram(A)of three data sets of GSE5413,GSE45577 and GSE469 and Venn diagram of common highexpression genes during muscle injury(B)
2.2 囊泡转运相关基因筛选及表达变化分析通过文献检索,从共差异表达基因中筛选出与囊泡转运相关的 10 个基因:ArfGAP3、LGALS3、KDELR3、CSF1R、ANXA4、STMN1、THBS2、PLXNB2、KIF20A 和EMR1 基因。提取3 个数据集中10 个基因在肌肉损伤后不同时间点的表达水平。GSE5413 数据集为偏心收缩或冷冻引起的损伤后7 d 内,分别在6 h、1 d、3 d 和7 d 时的RNAseq数据,结果显示:在偏心收缩损伤后,ARFGAP3、LGALS3、STMN1、KIF20A 和EMR1 基因表达增加,KDELR3、CSF1R、ANXA4、THBS2 和PLXNB2 基因表达水平呈降低趋势(图2A)。GSE45577 数据集结果显示:在甘油或心脏毒素环磷酰胺(cyclophosphamide,CTX)注射损伤3、7、14 和21 d 后,胫骨前肌中CSF1R、THBS2、PLXNB2、KIF20A 和EMR1 基因表达水平升高,ArfGAP3 和ANXA4 表达水平先降低后升高,KDELR3 和STMN1 基因在损伤后表达水平降低(图2B)。GSE469 数据集展示了分别在向腓肠肌注射CTX 诱导肌肉再生,注射后的27 个时间点(0~40 d)时,腓肠肌中上述基因的表达情况。ARFGAP3、LGALS3、KDELR3、THBS2、KIF20A 和EMR1 基因在肌肉损伤后表达水平升高,CSF1R、ANXA4、STMN1 和PLXNB2 基 因在损伤后表达水平降低(图2C)。

图2 GSE5413、GSE45577 和GSE469 数据集中基因表达情况Fig.2 Gene expressions in GSE5413,GSE45577 and GSE469 data sets
2.3 盆底肌损伤后囊泡转运相关基因的表达RT-qPCR 法检测与囊泡转运相关的10 个基因(ARFGAP3、LGALS3、KDELR3、CSF1R、ANXA4、STMN1、THBS2、PLXNB2、KIF20A和EMR1),在盆底肌损伤模型小鼠中第0、1、3 和5 天时的表达情况。
RT-qPCR 法检测结果显示:在小鼠盆底肌损伤后 mRNA 表达水平升高的有ARFGAP3、STMN1、THBS2 和 PLXNB2 基 因。其 中ARFGAP3 mRNA 表达水平在损伤后第1 天增加1.687 倍(P<0.05),第3 天增加2.493 倍(P<0.01)。STMN1 mRNA 表达水平在损伤后第1 天升高0.295 倍(P<0.05);THBS2 mRNA 表达水平在损伤后第1 天升高1.565 倍(P<0.01);PLXNB2 mRNA 表达水平在损伤后第3 天升高1.124 倍(P<0.01)。
在小鼠盆底肌损伤后mRNA 表达水平降低的有CSF1R、ANXA4 和EMR1 基因。其中CSF1R mRNA 表达水平在损伤后第1 天降低0.467 倍(P<0.01),第3 天降低0.276 倍(P<0.05);ANAX4 基因mRNA 表达水平在损伤后第3 天降低0.228 倍(P<0.05),第5 天降低0.224 倍(P<0.05);EMR1 基 因mRNA 表达水平在损伤后第1 天降低0.208 倍(P<0.05)。
LGARLS3、KDELR3 和KIF20A mRNA 表 达水平在小鼠盆底肌损伤后与损伤前比较差异无统计学意义(P>0.05)。见图3。
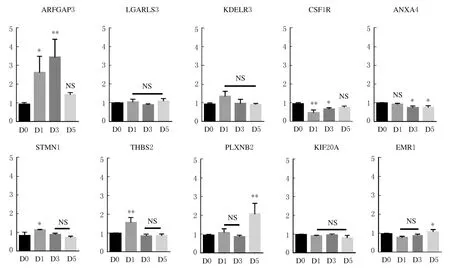
图3 小鼠盆底肌损伤模型中损伤第0、1、3 和5 天时ARFGAP3、LGARLS3、KDELR3、CSF1R、ANXA4、STMN1、THBS2、PLXNB2、KIF20A 和EMR1 基因mRNA 表达水平Fig.3 Expression levels of ARFGAP3,LGARLS3,KDELR3,CSF1R,ANXA4,STMN1,THBS2,PLXNB2,KIF20A and EMR1 gene mRNA in mouse pelvic floor muscle injury models at 0,1,3,and 5 d of injury
3 讨论
SUI 被喻为一种看不见的“社交癌”,发病时私密性高,患者常羞于启齿或求助无门,对患者的生活、人际关系和心理健康都产生了巨大的负面影响。SUI 的发病率较高,且病情随着年龄的增长而加重。随着科学技术水平的提高,我国人口平均寿命延长,人们对于生活品质的追求也逐步提升。关于SUI 的发病机制及干预靶点研究将对SUI 的治疗具有重要的指导意义。
盆底肌肉损伤是造成SUI 的重要因素之一,临床研究[21]显示:衰老、慢性便秘、妊娠和阴道分娩导致盆底肌肉急、慢性损伤,使盆底肌收缩功能下降。SUI 患者盆底肌也呈现出病理性萎缩的改变,如肌肉横切面肌减小、肌丝缺损、排列紊乱,大量纤维碎片累积以及炎症细胞浸润等特征[22],表明盆底肌损伤与SUI 的发生密切相关。临床研究[23]表明:阴道分娩导致盆底肌损伤是尿道生殖膈扩张最重要的因素,通过产前和产后的会阴超声随访检测,发现产后6 周~6 个月盆底肌裂孔面积减小,提示盆底肌损伤后具有一定的再生修复能力。
GEO 中整理了高通量基因组数据[13-14],以“muscle regeneration”为关键词搜索,查询出3 个在肌肉损伤后不同时间进程的差异化表达基因及基因集(GSE5413、GSE469 和GSE45577)。通过分析发现在肌肉损伤后的再生修复过程中,3 个基因集共有614 个共差异表达基因。囊泡转运可调节多种肌细胞因子的分泌,从而参与到肌肉功能调节或损伤修复过程。GEO2R 分析筛选出在3 个基因集中共同高表达或与细胞内囊泡转运相关的10 个基因。对上述基因进一步研究,结合在小鼠盆底肌损伤的动物模型中的RT-qPCR 法验证结果,发现在盆底肌损伤后的基因差异表达可以找出盆底肌损伤修复再生过程中的靶点。
本研究通过小鼠盆底肌损伤模型研究结果显示:在盆底肌损伤修复的过程中mRNA 表达水平升高的有 ARFGAP3、STMN1、THBS2 和PLXNB2 基 因,其 中 ARFGAP3、THBS2 和PLXNB2 mRNA 表达水平升高趋势较明显;在盆底肌损伤后CSF1R、ANXA4 和EMR1 mRNA 表达水平降低,其中CSF1R mRNA 表达水平降低差异有统计学意义。在盆底肌损伤修复期间,各种分泌性细胞因子可通过促进血管形成,调控炎症反应,抑制细胞凋亡,招募内源性干细胞,从而保护受损骨骼肌细胞,促进骨骼肌功能和形态的恢复[24]。上述在盆底肌损伤后具有表达差异的基因,可能通过调控细胞高尔基体运输分泌性细胞因子,从而介导细胞信号传递。后续对于上述差异化表达基因和信号分子关系的研究,将有助于揭示盆底肌再生修复的调节机制。
本研究基于SUI 的研究现状,利用公共数据库挖掘出肌肉损伤修复过程中的差异化表达基因,并构建小鼠盆底肌损伤模型,验证在盆底肌损伤后修复过程中上述差异基因的表达情况,对后续的研究启发思路具有重要意义。然而针对盆底肌损伤后第0、1、3 和5 天时间点进行基因表达的分析,仅初步发现具有表达差异的基因,后续对于验证层面的丰富以及探索差异化表达基因在盆底肌修复过程中的调控作用,仍存在很大的研究空间。盆底肌损伤修复的复杂调控机制有待进一步探索和发现。

