莪术醇对小鼠肝窦内皮细胞结构的影响及其对肝内血管新生的抑制作用
郑 洋 ,王佳慧 ,彭 岳 ,原鲜玲 ,汪 磊 ,赵铁建
(1.广西中医药大学赛恩斯新医药学院医学系,广西 南宁 530222;2.广西中医药大学基础医学院生理教研室,广西 南宁 530222)
肝纤维化病因复杂,任何能造成肝脏慢性损害的因素均可导致肝脏发生纤维化,如慢性乙型肝炎、慢性丙型肝炎、脂肪性肝炎、自身免疫性肝病、血吸虫肝病和药物性肝病等[1],因此防治肝纤维化对于慢性肝病患者具有十分重要的临床意义[2]。肝内血管新生是肝纤维化的病理形态特征,也是肝纤维化难以逆转的重要病理原因[3]。肝窦内皮细胞(liver sinusoidal endothelial cells,LSEC)是肝内非实质细胞中的一类,也是肝血窦的主要组成细胞,其细胞表面有很多窗孔结构,有利于肝内的物质交换。肝纤维化发生时,LSEC 会介导肝纤维化特征病理改变“肝窦毛细血管化”的形成[4],导致肝内大量血管新生,但是主要为未成熟的无效血管,不仅难以改善肝组织营养缺乏状态,反而加剧了肝实质细胞缺血缺氧损伤[5]。血管内皮标志物分化抗原簇 31(cluster of differentiation 31,CD31)和血管性血友病因子(von Willebrand factor,vWF)等LSEC 表型也发生较大改变。有研究[6]表明:肝内血管新生在肝纤维化疾病中扮演十分重要的角色。广西莪术(Curcuma kwangsiensis S.G.Lee et C.F.Liang)是姜科姜黄属中药莪术(Rhizoma Curcumae)的一种,通常以其干燥块根入药,其行气逐瘀和破血散结的功效作用比较强[7]。莪术醇作为广西道地药材莪术主要活性成分,莪术醇具有活血化瘀、保肝、抗炎和利胆等多种功效。目前关于莪术醇对肝内血管新生作用的报道较少,其具体的作用机制尚不明确。本研究通过探讨莪术醇对肝内血管新生的作用,阐明莪术醇抗肝纤维化的分子机制,为莪术醇防治肝纤维化提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF 级KM 小鼠30 只,2 周龄,体质量为12~16 g,购于湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2016-0002,动物使用许可证号:SYXK(桂)2019-0001。小鼠适应性饲养2 周后进行后续实验。莪术醇(货号:C114054)和丹参酚酸B(货号:S101148)(上海阿拉丁生物公司),MTT(上 海BIOSHARP 公 司,货 号:0793),Matrigel(北京拜尔迪生物科技有限公司,货号:354230),Trizol(美国Ambion 公司,货号:15596-026),CD31 抗体(货号:Ab222783)和vWF 抗体(货号:Ab174290)(英 国Abcam 公 司),GAPDH 抗体(杭州贤至生物有限公司,货号:AB-P-R001)。酶标仪(北京普天新桥技术有限公司,型号:PT-350C),显微镜(日本OLYMPUS公司,型号:IX51),倒置显微镜(苏州景通仪器有限公司,型号:XSP-11CD),RT-qPCR 仪(美国ABI 公司,型号:QuantStudio 6)。
1.2 LSEC 原代分离培养和分组小鼠按照80 mg·kg-1体质量使用剂量10 g·L-1戊巴比妥钠进行腹腔注射麻醉,200 μL 肝素静脉注射抗血液凝固。解剖腹部后用导管插入门静脉,剪开肝脏的下腔静脉,采用无钙GBSS 进行肝脏灌流,温度37 ℃,输液泵灌流速度为10 mL·min-1,输灌量约200 mL。结扎下腔静脉。用39 ℃的胶原酶溶液,以5 mL·min-1的流速行肝脏再灌注,灌注20 min 后,摘取肝脏,剥掉肝脏包膜和血管,将该膏样肝脏物质在新鲜的胶原酶溶液中振荡。细胞悬液通过尼龙纱布过滤以滤去未消化的组织,所得的滤过液为肝脏细胞悬液,使用Percoll 密度梯度沉降法及细胞选择性贴壁法分离原代肝窦内皮细胞[8],主要步骤包括:GBSS 液肝脏灌注→胶原酶肝脏灌注→胶原酶溶液振荡→细胞悬液离心去除杂质→Percoll 密度梯度沉降。将得到的LSEC 放至适宜的培养基中培养,待细胞生长达80%融合时,用0.25%胰蛋白酶和0.02%EDTA 消化收集细胞,将细胞分为空白对照组、模型组、莪术醇组和丹参酚酸B 组。将细胞密度调整至5×104mL-1,接种到96 孔细胞培养板,每孔100 μL 细胞悬液,空白对照组细胞仅用普通培养基处理,模型组细胞用100 μg·L-1廋素活化,培养细胞48 h,莪术醇组细胞先用45 mg·L-1莪术醇处理30 min 再用廋素培养细胞48 h[9],丹参酚酸 B 组细胞先用1×10-6mmol·L-1丹参酚酸B 处理30 min 再用廋素培养细胞48 h,每组设置6 个复孔。
1.3 MTT 法检测各组细胞增殖率取对数生长期细胞,胰酶消化后,将细胞密度调整为7×104mL-1,接种到96 孔细胞培养板,每组设6 个复孔,每孔100 μL 细胞悬液,并设置空白孔,在细胞孔周围孔内加入适量无菌PBS 缓冲液,培养过夜后,每孔加入10 μL MTT,37 ℃培养4 h,吸出培养基,加入DMSO 振荡数分钟,酶标仪测定吸光度(A)值,根据A 值测出细胞增殖率。细胞增殖率=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)× 100%。
1.4 实时荧光定量聚合酶链式反应(RT-qPCR)法检测各组细胞中CD31 和vWF mRNA 表达水平利用Trizol 试剂提取总RNA,采用primer 5.0软件,由武汉巴菲尔生物科技公司合成引物。引物序列:CD31,上游引物5'-TCCGATGATAACCACTGCAA-3',下游引物,5'-GTGGTGGAGTCTGGAGAGGA-3';vWF,上游引物5'-GCTCTCTCTCTCTTACCCGGATG-3',下游引物 5'-ATACTCCTTGCCCTGATGGA-3';β-actin,上游引物 5'-GCAGGAGTACGATGAGTCCG-3',下游引物5'-CCTGACAATGACTCGACGCA-3'。按照逆转录试剂盒,合成cDNA,反应条件:95 ℃、1 min;95 ℃、10 s,60 ℃、30 s,40 个循环,以β-actin 作为内参对照,取PCR 产物进行凝胶成像分析,每个样本的mRNA 相对表达水平=2-△△Ct,△Ct=目的基因Ct 值-GAPDH Ct 值,每组进行6 次重复。
1.5 免疫印迹法检测各组细胞中CD31 和vWF 蛋白的表达提取细胞总蛋白,使用BCA 法测定各组细胞蛋白浓度,行SDS-PAGE 电泳、转膜,用TBST 液室温摇床封闭2 h,加入CD31 和vWF,GAPDH 抗体4 ℃过夜,使PVDF 膜浸泡于二抗孵育液中,通过ECL 显色系统显色,用BandScan 软件分析胶片灰度值,将各组目的蛋白灰度值与内参蛋白(GAPDH)灰度值的比值作为目的蛋白相对表达水平。
1.6 扫描电镜观察各组LSEC 的结构各组孵育的细胞爬片,2.5%的戊二醛固定2 h;0.1 mol·L-1磷酸缓冲液冲洗3 次;1%鞣酸处理1 h,1%四氧化锇后固定1 h;磷酸缓冲液再次冲洗;梯度乙醇溶液(50%、70%、90%和100%)连续脱水,每个梯度浓度脱水15 min,再次用100% 乙醇脱水3 次,每次15 min;用临界点干燥器对细胞标本进行临界点干燥,金属溅射;扫描电镜观察样品。
1.7 血管形成实验检测各组LSEC 血管新生数量4 ℃融化Matrigel 胶,按每100 μ L 均匀加至96 孔细胞培养板底部;低速无菌离心去除气泡;37 ℃孵育60 min,在40 min 时取对数生长期LSEC,按照5×104mL-1密度接种于96 孔细胞培养板,用无血清DMEM 培养基继续培养;各组用不同试剂处理后,在倒置显微镜下观察管腔形成情况,每孔随机选取6 个视野,使用Image J 软件统计完整管腔数。
1.8 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组细胞增殖率、细胞中CD31 和vWF mRNA 及蛋白表达水平以及各组细胞血管形成数量均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 KM 小鼠原代LSEC 分离的结果在显微镜下观察分离的KM 小鼠原代LSEC,12 h 后,细胞呈圆形,而后细胞逐步生长为卵圆形,见图1A 中箭头;36 h 后,卵圆形细胞渐渐变成纺锥形,如图1B 中箭头,细胞生长较好。
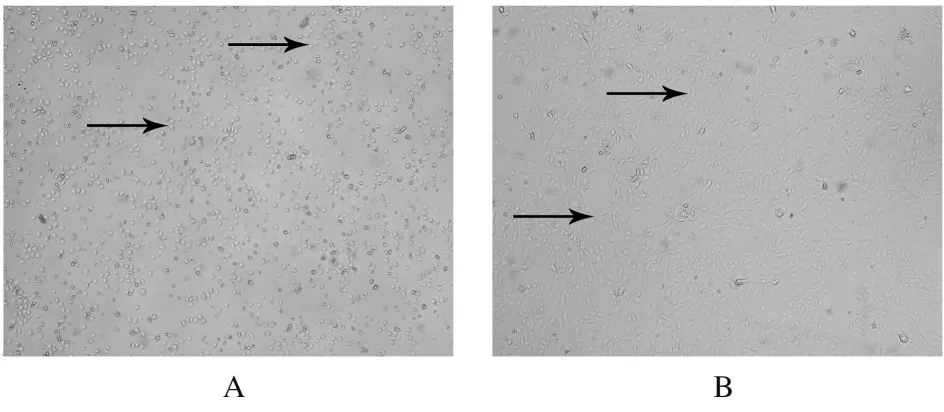
图1 KM 小鼠LSEC 原代分离结果(×40)Fig.1 Primary isolation results of LSEC of KM mice(×40)
2.2 各组细胞增殖率MTT 法检测各组细胞增殖率,模型组细胞增殖率较空白对照组明显降低(P<0.05);莪术醇组和丹参酚酸B 组细胞增殖率较模型组明显降低(P<0.05);莪术醇组细胞增殖率较丹参酚酸B 组升高,但差异无统计学意义(P>0.05)。见表1。
表1 各组细胞增殖率Tab.1 Proliferation rates of cells in various groups(n=6,-)
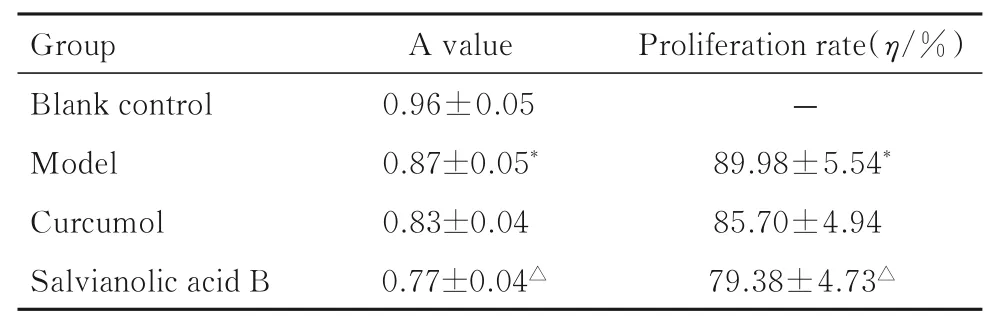
表1 各组细胞增殖率Tab.1 Proliferation rates of cells in various groups(n=6,-)
*P<0.05 compared with blank control group;△P<0.05 compared with model group.
2.3 各组细胞中CD31 和vWF mRNA 表达水平模型组细胞中CD31 和vWF mRNA 表达水平较空白对照组升高(P<0.05);莪术醇组和丹参酚酸B 组细胞中CD31 和vWF mRNA 表达水平较模型组明显降低(P<0.05);莪术醇组与丹参酚酸B 组CD31 和vWF mRNA 表达水平比较差异无统计学意义(P>0.05)。表明莪术醇具有抑制连续性血管生成的作用。见表2。
表2 各组细胞中CD31 和vWF mRNA 表达水平Tab.2 Expression levels of CD31 and vWF mRNA in cells in various groups(n=6,)

表2 各组细胞中CD31 和vWF mRNA 表达水平Tab.2 Expression levels of CD31 and vWF mRNA in cells in various groups(n=6,)
*P<0.05 compared with blank control group;△P<0.05 compared with model group.
2.4 各组细胞中CD31 和vWF 蛋白表达水平模型组细胞中CD31 和vWF 蛋白表达水平较空白对照组升高(P<0.05);莪术醇组和丹参酚酸B 组细胞中CD31 和vWF 蛋白表达水平较模型组明显降低(P<0.05);莪术醇组与丹参酚酸B 组细胞中CD31 和vWF 蛋白表达水平比较差异无统计学意义(P>0.05)。表明莪术醇具有抑制血管新生的作用。见图2 和表3。
表3 各组细胞中CD31 和vWF 蛋白表达水平Tab.3 Expression levels of CD31 and vWF proteins in cells in various groups(n=6,)

表3 各组细胞中CD31 和vWF 蛋白表达水平Tab.3 Expression levels of CD31 and vWF proteins in cells in various groups(n=6,)
*P<0.05 compared with blank control group;△P<0.05 compared with model group.
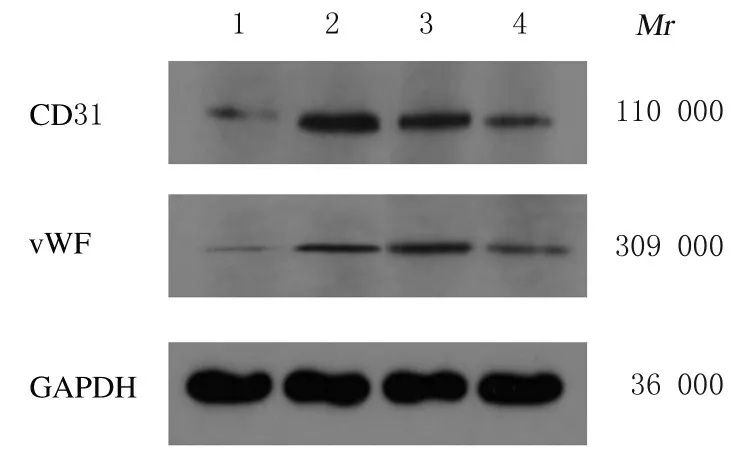
图2 各组细胞中CD31 和vWF 蛋白表达电泳图Fig.2 Electrophoregram of expressions of CD31 and vWF proteins in cells in various groups
2.5 各组小鼠LSEC 的窗孔结构扫描电镜检测结果显示:在正常LSEC 中,有大量开放的窗孔;而模型组开放的窗孔数量减少;莪术醇组LSEC 窗孔数量较模型组增加。表明莪术醇可改善LSEC 窗孔开放情况,改善肝内的微循环。见图3。

图3 各组小鼠LSEC 窗孔结构(Bar=50 μm)Fig.3 Structures of fenestrations of LSEC of mice in various groups(Bar=50 μm)
2.6 各组小鼠LSEC 新生血管数量血管形成实验结果显示:模型组小鼠LSEC 新生血管数量较空白对照组增加(P<0.05);莪术醇组和丹参酚酸B组小鼠LSEC 新生血管数量较模型组减少(P<0.05);莪术醇组与丹参酚酸B 组新生血管数量比较差异无统计学意义(P>0.05)。表明莪术醇具有抑制血管新生的作用。见图4 和表4。
表4 各组小鼠肝内新生血管数量Tab.4 Number of new blood vessels in liver of mice in various groups(n=6,)

表4 各组小鼠肝内新生血管数量Tab.4 Number of new blood vessels in liver of mice in various groups(n=6,)
*P<0.05 compared with blank control group;△P<0.05 compared with model group.

图4 各组小鼠LESC 中肝内血管形成情况(Bar=100 μm)Fig.4 Formation of intrahepatic blood vessels in LESC of mice in various groups(Bar=100 μm)
3 讨论
肝纤维化是多种慢性损伤因素作用于肝脏所引起的应答反应,进一步发展会导致肝硬化和肝癌的发生[10]。肝纤维化是各种慢性肝病的共同病理过程,以肝星状细胞激活大量细胞外基质沉积为主要特征[11]。LSEC 是覆盖于肝窦的薄层扁平状细胞,表面富含窗孔,窗孔直径为100~150 nm,为肝窦和Disse 间隙之间物质交换通道。研究[12]显示:原代分离的具有窗孔表型的LSEC 与肝星状细胞共培养时,肝星状细胞活化的标志物α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)的表达明显降低,LSEC 可使肝星状细胞恢复静息状态。DELEVE 等[13]在活化的肝星状细胞中加入LSEC,并且给予可溶性鸟苷酸环化酶活化剂维持LSECs 的窗孔表型,结果显示:活化型肝星状细胞逆转为静息状态。LSEC 调控肝星状细胞活化的作用,可能与其调控肝内物质交换有密切关系。肝纤维化与肝脏血管生成密切相关,可促进肝内血管生成,血管生成又加剧了肝纤维化[14]。因此针对LSEC介导的肝内血管新生,成为防治肝纤维化的研究热点[15]。
本课题组前期研究[16]显示:莪术醇具有抑制Rho/ROCK 信号通路,从而抑制HSC 的活化,发挥抗肝纤维化作用。近期研究[9]显示:莪术醇可以增加LSEC 窗孔结构。肝内血管新生是一种缺氧启动和生长因子依赖的动态病理过程,缺氧诱导因子1α 在细胞受低氧刺激时诱导产生并活化,是组织缺氧的重要反应[17]。血管新生程度取决于缺氧的程度及细胞对缺氧诱导因子1α 的反应[18],研究[19-21]表明:缺氧诱导因子1α 是一种氧浓度调节的转录因子,随着肝损伤加重,组织缺氧区域扩大,缺氧诱导因子1α 高表达,可刺激肝星状细胞激活并通过诱导下游血管内皮生长因子表达和转录,促进血管新生,改善局部组织血供,暂时缓解肝组织的缺氧,但是过度的血管新生会导致大量无效血管生成,这种血管不能进行物质交换反而加重肝脏的损伤。肝脏的微循环是以肝窦为中心,门静脉与肝动脉终末支经肝窦至细小肝静脉间的血液循环,肝血窦不同于一般的毛细血管,LSEC 之间存在窗孔,形成筛板样结构,并缺乏连续性基底膜,肝窦毛细血管化的主要特征是LSEC 的失窗孔和内皮下连续性基底膜的形成[22]。内皮细胞表达CD31和vWF,且常被作为连续性血管形成的标志,正常的LSEC 不表达CD31 和vWF,在LSEC 介导肝窦毛细血管化时会大量表达,因为其表型发生了转变[23-24]。血管生成与重构是肝纤维化发生过程中非常重要的环节,以血管生成与重构为靶点进行药物干预,可能成为抑制或逆转肝纤维化的有效手段[25]。
本研究以LSEC 为研究对象,从KM 小鼠分离原代LSEC,通过肝脏胶原酶灌注结合Percoll 密度梯度沉降法获得呈纺锥形生长良好的原代细胞;分子生物学检测结果显示:莪术醇可以抑制CD31 和vWF 的表达,表明在莪术醇的干预下,连续性血管生成减少;扫描电镜实验结果显示:模型组LSEC 窗孔数量明显减少,从而导致肝内微循环障碍物质交换受限,促进了肝纤维化发生,而莪术醇组LSEC 窗孔数量较模型组明显增加,说明其具有改善肝内微循环的作用;血管形成实验结果显示:模型组有大量新生血管形成,莪术醇干预后血管新生数量明显减少。
综上所述,莪术醇通过调控LSEC 的结构,抑制肝内血管新生,可能是其抗肝纤维化的机制之一。血管新生与肝纤维化发生相促相伴,血管新生是肝纤维化重要的早期病变,但是本研究只观察到莪术醇抑制肝内血管新生的作用,并未对其调控的分子机制进一步的探讨,未来本课题组将进一步深入研究莪术醇对肝窦毛细血管化介导的血管新生调控机制。

