胱天蛋白酶募集域蛋白9在胰腺腺泡细胞导管组织转化中的作用
李清华 杨志文
1上海市松江区中心医院消化内科,上海 201600;2上海市松江区中心医院药剂科,上海 201600
胰腺癌临床表现隐匿、病情进展迅速、预后极差,5年生存率小于5%,中位生存期小于6个月[1]。胰腺腺泡细胞导管组织转化是胰腺癌的起始事件之一,巨噬细胞通过多种途径在其中起着重要作用[2-4]。胱天蛋白酶募集域蛋白9(caspase recruitment domain protein 9,card9)是巨噬细胞中一种重要的免疫炎性蛋白,可通过激活NF-κB等肿瘤炎性微环境中重要的信号分子,在胃癌、肾癌、结肠癌等肿瘤的发生和发展中起重要作用[5]。然而,card9在胰腺癌中的作用尚不清楚。本研究探讨巨噬细胞card9在胰腺腺泡细胞导管组织转化中的作用,从而阐明胰腺癌发生的分子机制。
材料与方法
一、siRNA-card9序列合成及巨噬细胞转染效率
根据Genbank(http://www.ncbi.nlm.nih.gov/)数据库以及小分子干扰RNA(small interfering RNA, siRNA)设计策略,设计3条靶向card9的siRNA(siRNA-card9)序列:siRNA-card9-1正向引物序列为5′-GGGUAAGCUAGACAGGAAUTT-3′,反向引物序列为5′-AUUCCUGUCUAGCUUACCCTT-3′;siRNA-card9-2正向引物序列为5′-CCCUCAGUUAUACCGGAAATT-3′,反向引物序列为5′-UUUCCGGUAUAACUGAGGGTT-3′;siRNA-card9-3正向引物序列为5′-GGACAAAGAUAAGCUUCGATT-3′,反向引物序列为5′-UCGAAGCUUAUCUUUGUCCTT-3′。3条siRNA-card9序列由上海吉玛公司设计及合成。
巨噬细胞株购自上海中科院细胞库,常规复苏、培养及传代。取对数生长期的巨噬细胞,以1×105细胞加入12孔培养板,加入200 nmol/L的绿色荧光素标记的siRNA-card9(购自上海吉玛公司),培养3、6、12、24、48 h后,荧光显微镜下观察转染后的荧光强度,确定siRNA-card9转染巨噬细胞的最佳时间。
取1×105巨噬细胞加入12孔培养板,按照Lipofectamine 2000转染试剂说明书步骤,分别用siRNA-card9-1、siRNA-card9-2和siRNA-card9-3转染,每次设阴性对照组,每组各设3个复孔。采用实时定量PCR法检测转染后各组巨噬细胞card9 mRNA表达,筛选最佳抑制巨噬细胞card9的siRNA。card9正向引物序列为5′-CCAGAGCAGCCCTTTATG-3′,反向引物序列为5′-CTCGGTGTCGGTGTTGTC-3′;内参GAPDH正向引物序列为5′-GTGTTTCCTCGTCCCGTAG-3′,反向引物序列为5′-TTAGTGGGGTCTCGCTCC-3′。引物由上海生工生物工程股份有限公司设计合成。反应条件:95℃ 10 min,95℃ 15 s、60℃ 45 s,40个循环。通过仪器自带软件获取Ct值,以公式2-ΔΔCt计算mRNA表达量。
将抑制率最高的siRNA-card9,以100、200、300 nmol/L 3个不同浓度转染巨噬细胞,采用上述实时定量PCR法筛选巨噬细胞最佳抑制浓度。
二、巨噬细胞card9蛋白表达量检测
将5×105巨噬细胞和100 μg/ml β葡聚糖分别加入6孔板,常规培养12、24 h后分成阳性细胞组(巨噬细胞)、β葡聚糖刺激阳性细胞组、阴性细胞组(card9-/-巨噬细胞)、β葡聚糖刺激阴性细胞组。每组设3个复孔。取各组细胞加入RIPA裂解液,常规蛋白质免疫印迹法检测巨噬细胞 card9蛋白表达量。抗card9一抗(美国proteintech公司)1∶1 000稀释,辣根过氧化物酶标记的二抗1∶200稀释,反应后ECL发光,X片曝光、显影、定影,Image J 软件计算各条带灰度值,以目的条带与内参条带的灰度值比表示各组巨噬细胞card9蛋白相对表达量。
三、腺泡细胞导管组织转化标志蛋白CK19表达检测
分别取1×105巨噬细胞、1×105胰腺腺泡细胞(北京北纳生物公司)加入Transwell小室上层和下层共培养,小室滤膜孔径0.4 μm,100或500 μg/ml β葡聚糖加入上层巨噬细胞,分为以下6组:(1)阳性细胞组(巨噬细胞+腺泡细胞);(2)阴性细胞组(card9-/-巨噬细胞+腺泡细胞);(3)100 μg/ml β葡聚糖刺激阳性细胞组;(4)100 μg/ml β葡聚糖刺激阴性细胞组;(5)500 μg/ml β葡聚糖刺激阳性细胞组);(6)500 μg/ml β葡聚糖刺激阴性细胞组。每组设3个Transwell小室,常规培养120 h。取各组下室胰腺腺泡细胞加入RIPA裂解液,免疫荧光化学染色法检测腺泡细胞导管组织转化标志物CK19蛋白表达。抗CK19单克隆抗体(英国abcam公司)1∶1 000稀释,绿色荧光标记二抗1∶200稀释,用PBS溶液清洗后加入100μl 0.5g/ml的DAPI核染液,4℃过夜,显微镜下观察并拍照。
四、统计学处理

结 果
一、siRNA-card9转染巨噬细胞的效率
倒置荧光显微镜下见绿色荧光素标记的siRNA-card9转染3、6、12、24、48 h后,巨噬细胞内荧光强度随着转染时间延长而增加,24 h荧光强度明显增加(图1),时间延长至48 h,荧光强度增加趋势明显变缓,故选择24 h为siRNA-card9转染巨噬细胞的最佳时间。

图1 3(1A)、6(1B)、12(1C)、24(1D)、48 h组(1E)绿色荧光素标记的siRNA-card9转染巨噬细胞的荧光强度
siRNA-card9-1、siRNA-card9-2和siRNA-card9-3均可成功转染巨噬细胞(图2)。阴性对照组及siRNA-card9-1、siRNA-card9-2、siRNA-card9-3转染组巨噬细胞的card9 mRNA表达量分别为1.16±0.16、0.16±0.07、0.57±0.12、0.23±0.04。与阴性对照比较,siRNA-card9-1的沉默效率为83.9%(t=7.77,P=0.002),siRNA-card9-2为43.4%(t=7.75,P=0.024),siRNA-card9-3为76.8%(t=6.98,P=0.002),提示siRNA-card9-1转染巨噬细胞的抑制效率最高。

图2 阴性对照组(2A)及siRNA-card9-1(2B)、siRNA-card9-2(2C)、siRNA-card9-3(2D)转染组巨噬细胞的荧光强度
100、200、300 nmol/L浓度的siRNA-card9-1均可成功转染巨噬细胞(图3)。阴性对照组和100、200、300 nmol/L siRNA1-card9-1转染组巨噬细胞的card9 mRNA表达量分别为1.01±0.18、0.40±0.06、0.15±0.02、0.27±0.0.4。与阴性对照组比较,100、200、300 nmol/L siRNA-card9-1的沉默效率分别为60.3%、84.4%、72.7%(t值分别为5.57、8.13、6.89,P值分别为0.005、0.001、0.002)。表明200 nmol/L为最佳抑制浓度,故后续实验采用200 nmol/L siRNA-card9-1转染巨噬细胞。

图3 阴性对照组(3A)及100(3B)、200(3C)、300 nmol/L(3D)siRNA-card9-1转染组巨噬细胞的荧光强度
二、β-葡聚糖刺激巨噬细胞上调card9蛋白的表达
阳性细胞组、β葡聚糖刺激阳性细胞组、阴性细胞组、β葡聚糖刺激阴性细胞组体外培养12 h,巨噬细胞card9蛋白表达量分别为0.86±0.05、1.03±0.05、0.59±0.03、0.52±0.16;体外培养24 h,巨噬细胞card9蛋白表达量分别为0.81±0.05、1.46±0.05、0.42±0.06、0.46±0.06。与阳性细胞组比较,β-葡聚糖刺激阳性细胞组巨噬细胞card9蛋白水平均明显升高,差异有统计学意义(t=3.88,P=0.018;t=15.90,P<0.001);与阴性细胞组比较,β-葡聚糖刺激阴性细胞组巨噬细胞card9蛋白水平未见明显升高(t=0.70,P=0.525;t=0.78,P=0.475),差异无统计学意义(图4),表明β-葡聚糖刺激可上调巨噬细胞card 9蛋白表达水平。

图3 阴性对照组(3A)及100(3B)、200(3C)、300 nmol/L(3D)siRNA-card9-1转染组巨噬细胞的荧光强度

注:card9为巨噬细胞胱天蛋白酶募集域蛋白9图4 阳性细胞组(1)、β葡聚糖刺激阳性细胞组(2)、阴性细胞组(3)、β葡聚糖刺激阴性细胞组(4)培养12 h(4A)和24 h(4B)的巨噬细胞card9蛋白表达量
三、巨噬细胞诱导腺泡细胞导管组织转化
阳性细胞组,阴性细胞组,100、500 μg/ml β葡聚糖刺激阳性细胞组,100、500 μg/ml β葡聚糖刺激阴性细胞组体外培养120 h,阳性细胞组CK19蛋白绿色荧光强度较弱;100、500 μg/ml β葡聚糖刺激阳性细胞组和腺泡细胞内CK19绿色荧光强度较阳性细胞组明显增强,且呈现β葡聚糖剂量依赖性;而阴性细胞组及100、500 μg/ml β葡聚糖刺激阴性细胞组,腺泡细胞内CK19绿色荧光强度均较阳性细胞组显著降低(图5),表明巨噬细胞诱导腺泡细胞导管组织转化存在card9基因依赖性。
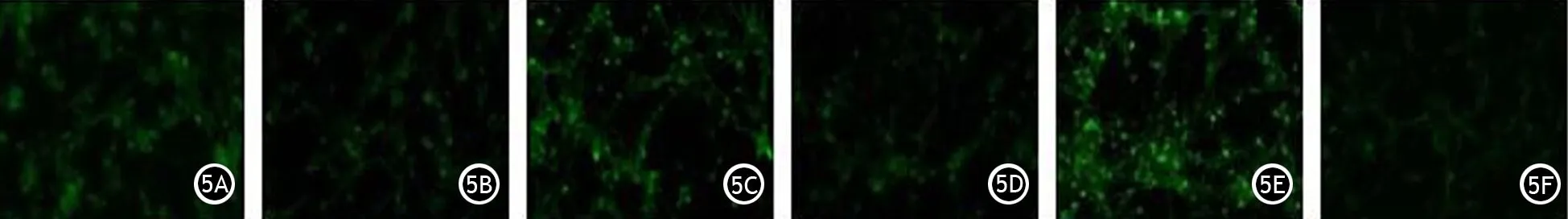
图5 阳性细胞组(5A)、阴性细胞组(5B)、100 μg/ml β葡聚糖刺激阳性细胞组(5C)、100 μg/ml β葡聚糖刺激阴性细胞组(5D)、500 μg/ml β葡聚糖刺激阳性细胞组(5E)、500 μg/ml β葡聚糖刺激阴性细胞组(5F)腺泡细胞CK19蛋白表达
讨 论
大量文献报道,真菌细胞壁的β葡聚糖与巨噬细胞膜表面C型植物凝集素受体-1特异性结合,诱导下游Sky活化,随后card9招募bcl10、malt1,形成card9/bcl10/malt1复合体,进而激活NF-κB、p38等炎症信号,释放大量炎症因子[6]。鉴于前期[7-8]大量可重复的β-葡聚糖活化巨噬细胞的实验数据,本研究仅检测巨噬细胞card9表达水平,用于验证后续实验的细胞模型。与先前报道[6-8]一致,本研究结果也显示,β-葡聚糖刺激小鼠单核巨噬细胞系RAW264.7后可上调card9的表达。
众所周知,巨噬细胞对胰腺癌的腺泡细胞导管组织转化起着关键作用[2-4]。巨噬细胞内的半胱氨酸蛋白酶,以及其分泌炎症因子RANTES和TNF-α,作用于相关信号分子,促使腺泡导管组织转化[2-3];单克隆ICAM-1抗体[4]、氯化钆抑制剂[2]可阻遏巨噬细胞胰腺组织浸润,抑制腺泡导管组织转化。
本课题组前期研究发现,急性胰腺炎患者外周血巨噬细胞card9表达水平明显升高[9];沉默巨噬细胞card9可减轻急性胰腺炎大鼠胰腺的炎症损伤[10];存在巨噬细胞card9依赖性的NF-κB、038分子机制[11]。本研究发现,β葡聚糖活化巨噬细胞,上调card9蛋白水平,诱导腺泡细胞导管组织转化,且呈现剂量依赖性;巨噬细胞card9基因敲除后,则抑制腺泡细胞导管组织转化。
巨噬细胞card9可通过多种途径参与肿瘤细胞生长繁殖。card9通过释放IL-18炎症因子[12]或者抑制骨髓源性抑制细胞[13],调节辅助T细胞功能; card9调控固有淋巴细胞的免疫应答,激活肿瘤细胞STAT3信号途径[14]; card9激活NF-κB信号分子,诱导巨噬细胞M2极化[15]。本研究结果表明,巨噬细胞与腺泡细胞共孵育后,巨噬细胞card9表达水平与腺泡细胞导管组织转化标志蛋白CK19正相关,提示巨噬细胞card9可诱导腺泡细胞导管组织转化。更深入的分子机制研究尚需在后续实验中进一步阐明。
利益冲突所有作者声明无利益冲突
作者贡献声明李清华:实验操作、论文撰写、数据整理、统计学分析;杨志文:研究指导、论文修改、经费支持

