高三酰甘油血症性胰腺炎的诊断和降脂治疗策略
何文华 祝荫
南昌大学第一附属医院消化内科,胰腺疾病诊治中心,江西省消化临床医学研究中心,南昌 330006
【提要】 随着我国居民高三酰甘油血症(HTG)的流行率逐年升高,HTG引起的急性胰腺炎(HTGP)发病率也随之攀升。本文重点介绍影响血清三酰甘油的环境因素和遗传因素,以及HTGP的发病和重症化机制、临床表现和诊断方法,并结合笔者所在胰腺中心的临床实践,提出AP发病早期紧急降脂和维持降脂的治疗策略,为临床医师规范诊治HTGP提供借鉴。
近10余年来,我国居民高三酰甘油血症(hypertriglyceridemia,HTG)的流行率逐年升高[1-3],由此而引起的胰腺炎(hyperlipidaemic pancreatitis,HTGP)发病率也随之攀升,已跃升为AP的第二大病因[4-12],多个研究显示HTG已占所有AP患者病因的30%[11,13]。HTGP患者的临床表现和其他病因的AP相似,但病情易重症化和复发,持续性全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和持续性器官功能衰竭的发生率也高于其他病因引起的AP,且发病时血清三酰甘油(triglycerides, TG)水平与病情严重程度呈正相关[10]。因此,早期降脂治疗可能改善HTGP患者的预后,临床医师应重视早期寻找AP的病因,诊断HTGP后应及时选择合理的降脂方案。
一、HTG的流行病学、病因与严重度分级
2010年中国一项横断面研究调查了国内不同城市和农村地区的18岁以上居民,发现血脂异常的总体流行率为34.0%,城市和农村地区分别为35.1%和26.3%,男性血脂异常的患病率高于女性(41.9%比32.5%)[1]。2014年一项收集40岁以上人群的横断面调查显示,中国农村和城市成年人血脂异常的患病率达43%,超重、肥胖、中枢性肥胖和糖尿病是血脂异常的常见危险因素[2]。2016年中国东北地区的横断面调查发现,血脂异常的患病率总体达62.1%,其中HTG高达43.9%[3]。上述调查表明中国成人居民的血脂异常和HTG的流行率逐年升高,已超过美国[4]和欧洲[5]的HTG流行率。
血清TG的水平受多种环境因素和遗传因素的影响[6]。环境因素和遗传因素可能通过增强TG合成、增加富含TG的脂蛋白的产生以及抑制外周TG脂解和(或)脂蛋白的清除导致HTG。环境因素包括高脂肪饮食、饮酒、活动减少、药物和新陈代谢状态。常见的非遗传性HTG病因包括肥胖、糖尿病或胰岛素抵抗和脂肪营养不良;肝脏疾病,特别是非酒精性脂肪肝;肾病综合征和肾衰竭;内分泌疾病,包括甲状腺功能减退、库欣综合征、肢端肥大、高泌乳素血症和多囊卵巢综合征;妊娠;药物,如噻嗪类利尿剂、β受体阻滞剂、非典型抗精神病药、糖皮质激素、雌激素等。遗传性HTG包括单基因遗传性HTG,如家族性异常β脂蛋白血症、家族性乳糜微粒(chylomicrons,CM)血症综合征;多基因遗传性HTG,如多因素CM血症综合征、家族性HTG和家族性混合型高脂血症。2012年美国内分泌协会指南[6]将空腹HTG严重度分为正常(TG<1.7 mmol/L)、轻度(TG 1.7~<2.3 mmol/L)、中度(TG 2.3~<11.2 mmol/L)、重度(TG 11.2~22.4 mmol/L)和极重度(TG>22.4 mmol/L)。单基因遗传性HTG的血清TG一般轻度升高,中度和重度HTG往往是隐性多基因遗传和环境因素综合影响的结果。
二、HTGP的发病机制、临床表现和诊断
研究表明,血清TG水平>11.3 mmol/L的人群中HTGP的患病率约为20%[6]。HTGP发病机制的假说是胰脂肪酶进入胰血管床分解血清TG,产生高浓度游离脂肪酸(free fatty acids,FFAs)引起胰腺腺泡细胞和毛细血管损伤[14]。血液高浓度的CM增加了血液黏度,导致的毛细血管淤积、缺血和酸中毒也损伤胰腺腺泡细胞[14]。笔者所在团队的动物实验研究发现,大颗粒脂蛋白(主要是CM)升高为主的GPIHBP1-/-小鼠比极低密度脂蛋白(very low density lipoprotein, VLDL)升高为主的apoc3tg小鼠胰腺坏死更严重,原因是前者血液中的CM比VLDL分解出更多的FFAs,从而引起大面积胰腺坏死[15]。有学者提出血CM过多是诱发HTGP的前提条件,CM持续增多的指标(TG/载脂蛋白B>10.6)对识别HTGP发生风险具有很高的灵敏度和特异度[6]。
HTGP患者同样急性起病,以持续性上腹痛或全腹痛为主要症状,伴恶心、呕吐等消化道症状。此外血清TG水平越高越易重症化[16],发生持续性SIRS[17]和持续性器官功能衰竭的风险更高[18]。笔者所在团队的大样本研究发现,HTGP患者的胰腺坏死发生率、持续性器官功能衰竭的发生率和病死率均高于其他病因的AP患者[16]。值得注意的是,32%的HTGP患者出院后会再次复发[19]。笔者所在团队的回顾性研究发现,HTG和酒精病因均是AP复发的危险因素[20]。此外,50%以上的HTGP患者的实验室检查可出现“假性低钠血症”和“假性胰酶正常”[21-22]。HTGP的诊断首先需符合AP的诊断标准[9],然后确定AP的病因是否为HTG[10]:当血清TG水平≥11.3 mmol/L时,或血清TG水平≥5.65 mmol/L并排除其他病因后,可判定HTG为病因[22]。
三、HTGP的降脂治疗策略
HTGP的早期治疗除了液体复苏、镇痛和营养支持等内科综合治疗外,还需快速降脂以阻止HTGP的病情进展[10,23]。笔者所在团队研究证明,降低血清TG水平可防止HTGP小鼠发生胰腺坏死[15]。快速清除血清TG及过度释放的FFAs可能是HTGP早期治疗的关键靶点,目前的共识是尽快将血清TG降至5.65 mmol/L以下[14,24]。笔者提出需根据患者发病的不同阶段,分别制定HTGP的降脂治疗策略,包括紧急降脂治疗、维持降脂治疗和长期调脂治疗。具体实施策略见图1。
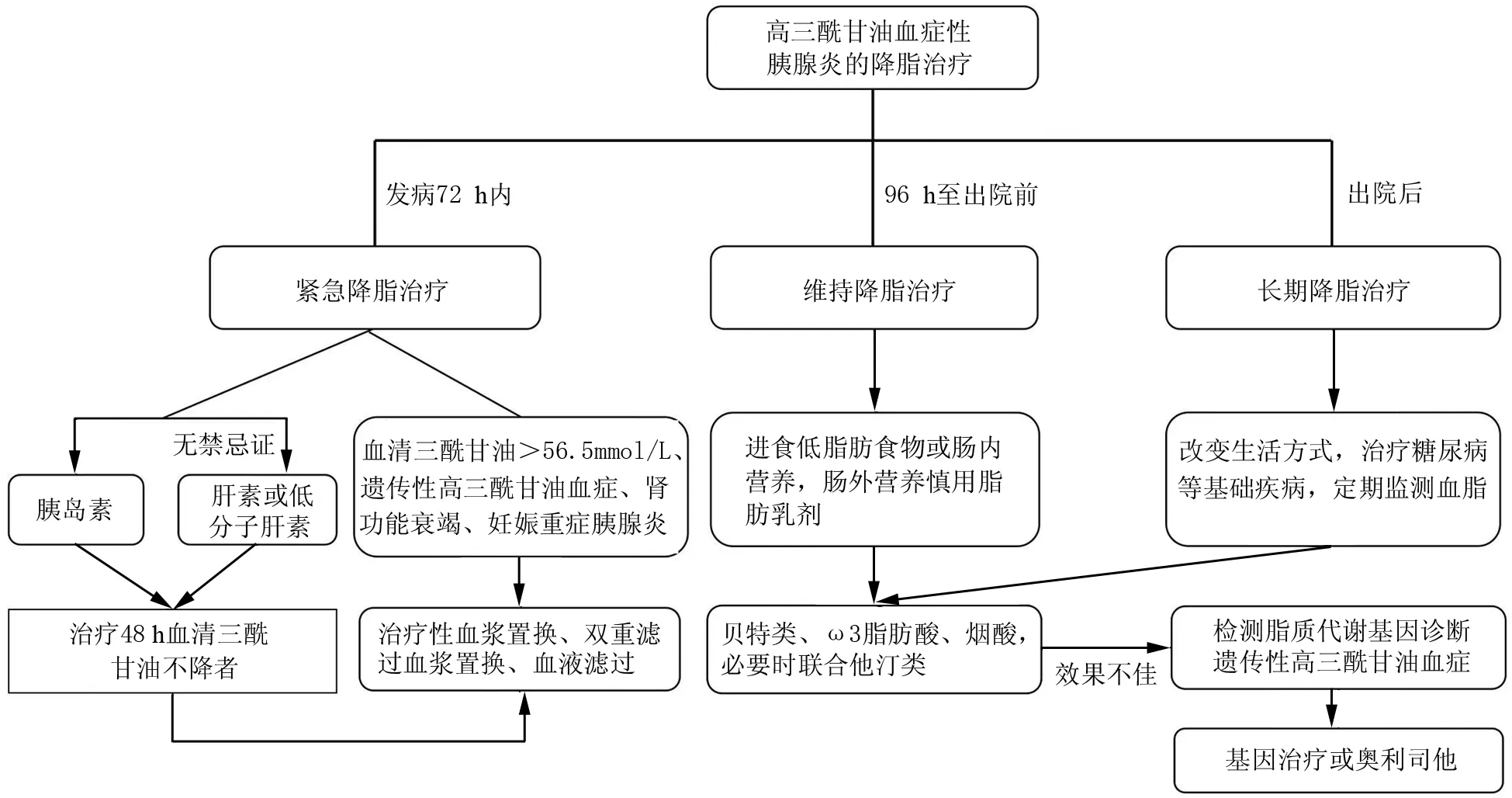
图1 高三酰甘油血症性胰腺炎的降脂治疗流程图
1.发病72 h内的紧急降脂治疗:由于发病24 h内的血清TG水平与HTGP病情严重程度呈正相关,在发病72 h以内,特别是24 h以内快速降低血清TG水平是阻止病情加重的关键。紧急降脂方案包括药物治疗(胰岛素、肝素等)和血液净化治疗(血浆置换、血液滤过等)两大类[25]。由于72 h内大部分患者有消化道症状或需禁食,而口服药物降脂速度较慢,故此阶段不宜口服降脂药物。
胰岛素是所有HTGP患者紧急降脂治疗的一线药物[26],无论是否合并糖尿病,它都是有效且安全的方案[27-29]。胰岛素的作用机制是通过上调脂蛋白脂酶(lipoprotein lipase,LPL)的合成及活性,加快LPL分解血清TG为脂肪酸并且被组织氧化利用[25]。研究发现,胰岛素促进胰腺腺泡细胞糖酵解产生ATP,可阻止细胞内Ca2+超载和细胞坏死[30]。肝素促进血管内皮上的LPL释放入血,从而加快血清TG分解[31],它与胰岛素联合具有协同作用[32-34]。若无明显禁忌证(如活动性出血、肾功能衰竭等),可短期联合使用治疗重度HTG。低分子肝素比普通肝素出血风险更小,有研究发现它能减少胰腺和全身器官微血栓的形成,改善重症AP的临床预后[35]。笔者所在团队在全球首次开展了一项HTGP降脂治疗的前瞻性随机对照研究[34],发现胰岛素联合低分子肝素治疗HTGP的降脂速率虽慢于高容量血液滤过,但持续性呼吸衰竭的发生率却显著低于高容量血液滤过,且未发现显著的出血风险和TG水平反弹的不良反应[34]。
血液净化包括治疗性血浆置换(therapeutic plasma exchange,TPE)、双重滤过血浆置换(double-filtration plasmapheresis,DFPP)和持续血液滤过[25]。两项病例对照研究显示,使用TPE或DFPP均可以缩短住院时间,特别是针对TG水平>56.5 mmol/L血液净化包括治疗性血浆置换(therapeutic plasma exchange,TPE)、双重滤过血浆置换(double-filtration plasmapheresis,DFPP)和持续血液滤过[25]。两项病例对照研究显示,使用TPE或DFPP均可以缩短住院时间,特别是针对TG水平>56.5 mmol/L的HTGP患者[36-37]。荟萃分析显示TPE和DFPP能有效降低血清TG水平,但尚不确定是否能降低并发症和病死率的发生[26,38]。最近国内一项倾向性匹配分析发现,DFPP治疗HTGP患者的血清TG下降率快于对照组(使用胰岛素等药物),但持续性呼吸衰竭的发生率却高于对照组[39]。国外有学者认为,DFPP未降低持续性呼吸衰竭发生率的原因是它不能清除有肺毒性的FFAs[40]。血液净化是有创操作,美国血液净化协会(ASFA)建议HTGP患者应个体化应用,而非常规使用[41]。它的不良反应包括导管相关反应(如皮疹、管道堵塞、深静脉血栓形成)、电解质紊乱(如低钙血症、低钾血症)、抗凝剂相关出血和过敏反应。目前建议将血液净化作为二线方案用于胰岛素或联合肝素治疗48 h后血清TG仍持续升高的患者[26,42]。此外,以下特殊人群血液净化可作为首选方案:TG>56.5 mmol/L的患者;已知有遗传性HTG(如LPL基因突变)的患者;合并持续性急性肾功能衰竭患者;妊娠期合并重症HTGP的患者。
2.住院期间的维持降脂治疗:在紧急降脂之后,住院期间仍需持续维持血清TG在5.65 mmol/L以下。建议HTGP患者发病3 d内需禁食以加快血清TG水平下降[43]。首次进食或肠内营养时间推迟至发病3 d后,轻症患者可进食低脂肪食物,不能耐受经口饮食者可行肠内营养;肠内营养不耐受的患者,应给予肠外营养[42],同时监测血清TG水平,当TG升至5.65 mmol/L时禁用脂肪乳剂。肝素或低分子肝素使用3 d需停药,因长期使用可导致LPL耗竭和血清TG水平反弹[44]。72 h之后患者消化道症状常得到缓解,可口服降脂药物以维持降脂目标。口服降脂药物包括贝特类、ω-3脂肪酸和烟酸衍生物[45]。贝特类药物(如苯扎贝特、非诺贝特)通过刺激LPL的释放而降低血清TG水平,对于无LPL基因突变的患者作用显著,但需注意贝特类药物有引起横纹肌溶解或肌病的风险。ω-3脂肪酸可治疗HTG[46],它联合贝特类药物比单用贝特类降脂效果更好。ω-3脂肪酸不良反应较少,孕妇也可安全使用[47-48]。烟酸类药物如阿昔莫司能使血清TG降低50%,但有皮肤潮红、瘙痒等不良反应[45]。他汀类药物常与贝特类、烟酸或ω-3脂肪酸联合治疗贝特类药物不能控制的重度HTG[45,49]。
3.出院后的长期调脂治疗:HTGP患者出院后容易复发。一项大样本调查研究发现,TG≥5.65 mmol/L的患者发生胰腺炎的风险高于<5.65 mmol/L的患者[50]。血清TG水平未控制、血糖控制不佳的糖尿病及酗酒是复发常见原因[19],因此HTGP患者出院后应定期监测血脂,并需长期控制血清TG水平在5.65 mmol/L以下,以预防复发。首先改变生活方式,包括限制碳水化合物摄入、进食低脂肪食物、增加体育锻炼、控制体重、戒酒、治疗糖尿病等基础疾病[22-33]。如血清TG仍持续高于5.65 mmol/L,应服用降脂药,首选贝特类,其次是ω-3脂肪酸和烟酸衍生物,对于胆固醇升高者服用他汀类降脂药物。如果降脂药物效果不佳应询问家族史,可检测脂质代谢基因以诊断遗传性HTG。新出现的基因疗法为患有遗传性HTG患者提供了长期控制血脂的方案。2012年欧盟批准Glybera用于治疗家族性脂蛋白脂肪酶缺乏症,它是由腺相关病毒载体亚型1(AAV1)携带增强LPL功能的基因,可有效降低血清TG水平和发生AP的风险,但费用高昂[6]。2019年欧盟批准载脂蛋白C-Ⅲ反义寡核苷酸volanesorsen用于治疗家族性CM血症综合征(FCS),在3期临床试验中33例患者每周注射1次volanesorsen,3个月后的TG平均水平下降了77%[51]。依维那单抗(Evinacumab)是一种针对血管生长素样蛋白3的人类单克隆抗体,它于2021年被美国食品药品监督管理局(FDA)批准用于治疗纯合子家族性高胆固醇血症患者,使用后血清TG水平可降低76%[52]。目前我国尚无上述基因药物,对于确诊的遗传性HTG可考虑服用奥利司他减少肠道脂肪酸吸收来控制血脂。
综上所述,临床医师应重视在AP早期寻找病因,当血清TG水平≥11.3 mmol/L时,或血清TG水平≥5.65 mmol/L并排除其他病因后,需考虑HTGP的诊断。HTGP在发病72 h内应给予紧急降脂治疗,胰岛素是一线药物,短期联用低分子肝素可加快降脂速度,但须注意禁忌证。TPE、DFPP和持续血液滤过可个体化用于胰岛素和肝素治疗48 h无效者、入院血清TG>56.5 mmol/L者、遗传性HTG患者、持续性肾功能衰竭及妊娠期重症HTGP患者。在发病72 h之后需口服降脂药物包括贝特类、ω-3脂肪酸和烟酸,经口进食低脂肪食物,血清TG≥5.65 mmol/L时禁用脂肪乳剂。出院后需改变生活方式,治疗糖尿病等基础疾病,定期监测血脂,血清TG持续≥5.65 mmol/L者服用降脂药。药物治疗效果不佳者可检测脂质代谢基因,目前遗传性HTG可服用奥利司他调控血脂。
利益冲突所有作者声明无利益冲突

