大鼠永久性脑缺血后脑内Nestin 的表达变化
梁晓艳 赵 梦 陈 超 周 洋 李斌斌 赵紫琦 顾 玉
1.承德护理职业学院基础部,河北承德 067000;2.河北省承德市中心医院检验科,河北承德 067000
缺血性脑血管疾病(ischemic cerebrovascular disease,ICVD)具有高复发率、高致残率和高死亡率等特点,挽救脑缺血后濒死神经元,改善缺血所致的神经功能障碍为医学界的一大难题。近年来,随着对成年神经系统再生能力和干细胞的研究逐步深入,运用神经干细胞(neural stem cell,NSC)治疗ICVD 成为临床研究热点。研究证实,成年哺乳动物(包括成人)脑内的NSC 绝大多数处于相对静止的状态,当脑缺血或其他脑损伤时,可诱导其增生、定向迁移并分化为神经元和神经胶质细胞。然而,脑缺血后NSC何时开始增生、增生高峰期、持续时间及分化结局等仍有待进一步研究。巢蛋白(neuro epithelial stem cell prote,Nestin)是NSC 最常用的标志物,可在一定程度上反映NSC 的变化,其短暂表达于胚胎发育早期的NSC,脑缺血损伤后成年脑组织又能重新大量表达。为了能更有效地运用内源性NSC 来促进脑缺血后神经功能的修复,研究脑缺血后NSC 的具体反应至关重要。因此,本研究通过采用免疫组织化学技术,观察脑缺血大鼠脑内Nestin 的表达变化,旨在探讨脑缺血后NSC 的增生、迁移和分化规律,为临床上运用内源性NSC 来治疗ICVD 患者提供一定实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 成年健康SD 雄性大鼠77 只(成都达硕生物科技有限公司),实验动物合格证号:SCXK(川)2008-24,体质量(260±20)g,其中2只大鼠用于脑缺血后2,3,5-氯化三苯基四氮唑染色(2,3,5-triphenyl tetrazolium chloride,TTC),余75 只采用随机数字法随机分为正常对照组(Control)、假手术组(Sham)和缺血组(大脑中动脉闭塞middle cerebral artery occlusion,MCAO);假手术组和缺血组又分为术后1d、2d、3d、1 周、2 周、3 周和4 周共7个亚组,每组5 只。本研究通过昆明医科大学动物伦理委员会审(审批号:D·WLL20220007001),实验过程中对动物的处置符合动物伦理学标准。
1.1.2 主要试剂和仪器 TTC 染色、兔抗GFAP 抗体、Cy3 标记的羊抗鼠IgG、FITC 标记的羊抗兔IgG(美国Sigma Chemical 公司);鼠抗Nestin 抗体(美国Santa cruz 公司);S-P 即用型超敏试剂盒、DAB 显色试剂盒(福州迈新生物技术开发公司);激光共聚焦显微镜(日本奥林巴斯公司)。
1.2 方法
1.2.1 大鼠永久性脑缺血模型复制 参照肖宗宇等的MCAO 模型复制方法,利用显微外科技术在右侧颞骨前下紧邻颧弓前份上缘的部位开窗入颅,电凝阻断嗅束至大脑下静脉间的一段大脑中动脉(middle cerebral artery,MCA),从而相应部位产生永久性脑缺血。假手术组仅暴露MCA 但不凝闭,余步骤相同。
1.2.2 MCAO模型大鼠脑组织TTC染色 将2 只用于脑TTC 染色的大鼠于MCAO 术后1d 断头取脑,将其中1 只大鼠脑组织经-20℃冰箱冻存20min,去除嗅球、小脑和低位脑干后沿冠状面切成5 片,同另1只完整的大鼠脑组织一起浸入1%TTC 溶液,于37℃的水浴箱中避光染色30min,期间每10min 翻动一次脑片,使其染色均匀,取出脑组织浸入2%多聚甲醛充分固定后照相分析。
1.2.3 免疫组化样品制备及染色 各组大鼠按相应时间点灌注固定、断头取脑,常规制作石蜡切片,厚度10μm。①抗Nestin 抗体的免疫组化(stre-ptavidinperoxidaseconjugtate method,SP)法单标染色下试剂说明书操作,一抗为小鼠抗大鼠 Nestin 抗体(1∶500)。②抗Nestin/GFAP 抗体的免疫荧光双标染色步骤:切片脱蜡至水,微波炉高火15min 完成抗原修复,滴加内源性过氧化物酶阻断剂及5%非免疫性羊血清,置室温15min,甩去血清加一抗(鼠抗Nestin 抗体,1∶500;兔抗GFAP 抗体,1∶1000),4℃冰箱过夜后,加Cy3(红色荧光)标记的羊抗鼠IgG 和FITC(绿色荧光)标记的羊抗兔IgG(1∶200),室温孵育1h,以上每一步骤后均用0.01mol/L 的PBS缓冲液冲洗3 次,每次3min,荧光封片剂封片,激光共聚焦显微镜观察染色结果。阴性对照组分别用PBS 缓冲液和羊血清代替一抗,其余步骤同上。
1.2.4 免疫组化结果 每只大鼠随机挑选相同部位的4 张切片,在显微镜下分别于双侧侧脑室室管膜下区(subventricular zone,SVZ)、大脑皮质和纹状体选取3 个高倍视野(×400),对各脑区的Nestin阳性细胞拍照并计数,采用Image Pro Plus 6.0 图文分析系统测量平均吸光度值。
1.3 统计学方法

2 结果
2.1 TTC 染色结果
大鼠脑缺血后1d,脑组织TTC 染色显示,非部位染为红色,梗死灶呈苍白色,梗死灶与大脑中动脉供血区相吻合,梗死范围和体积恒定,全脑和脑组织冠状切片TTC 染色均证明模型复制成功,见图1。
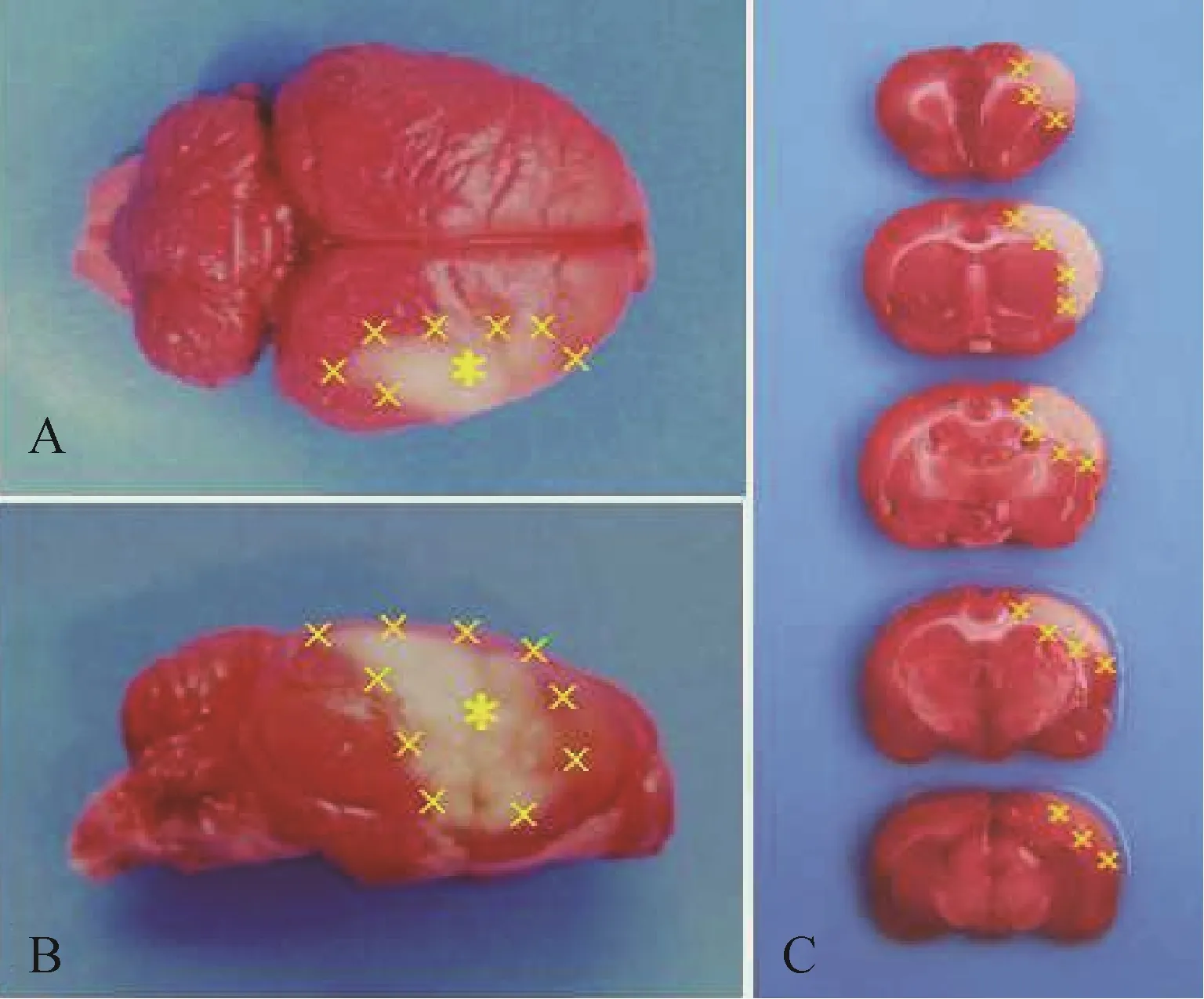
图1 脑缺血后1d 脑组织TTC 染色
2.2 抗Nestin 抗体免疫组化染色结果
2.2.1 脑缺血后Nestin 阳性产物的分布规律 Nestin免疫阳性产物呈棕褐色,定位于胞质和突起,阴性对照未着色。正常对照组和假手术组,Nestin 阳性产物主要分布于双侧SVZ 和第三脑室周围,大脑皮质和纹状体仅少量血管内皮呈Nestin 弱阳性;脑缺血后,Nestin 阳性细胞从缺血侧SVZ 梯度式迁往梗死灶边缘,随着缺血时间延长及梗死体积逐渐缩小,阳性细胞始终紧紧围绕在梗死灶的边缘,但未能进入梗死灶中央,梗死灶中央只见少量纤维状结构和血管内皮呈Nestin 阳性,见图2。
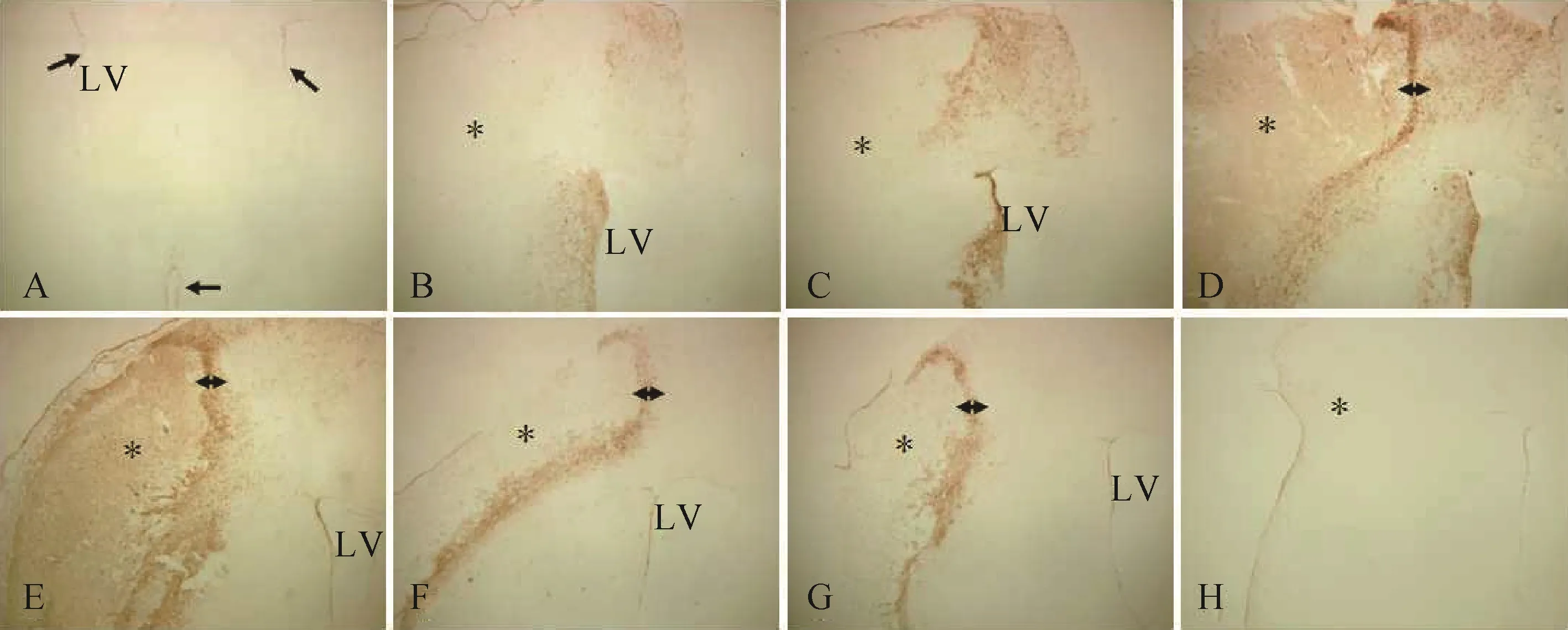
图2 脑缺血后Nestin 阳性产物的分布规律(×40,抗Nestin 抗体免疫组化染色)
2.2.2 脑缺血后Nestin 阳性细胞的形态变化 正常对照组和假手术组,大脑皮质和纹状体未见Nestin 阳性细胞,分布于SVZ 和第三脑室周围的Nestin 阳性细胞呈椭圆形或不规则形,体积小,突起短少。脑缺血后,Nestin 阳性细胞呈多突起的星形,突起呈放射状从胞体发出,形似星形胶质细胞,随着缺血时间延长,阳性细胞体积逐渐变大,突起增多、变长;同时,从缺血侧SVZ 至梗死灶,Nestin 阳性细胞呈现出定向迁移的形态,距梗死灶越近的细胞体积越大、突起越长,且大部分突起伸向梗死灶,见图3。
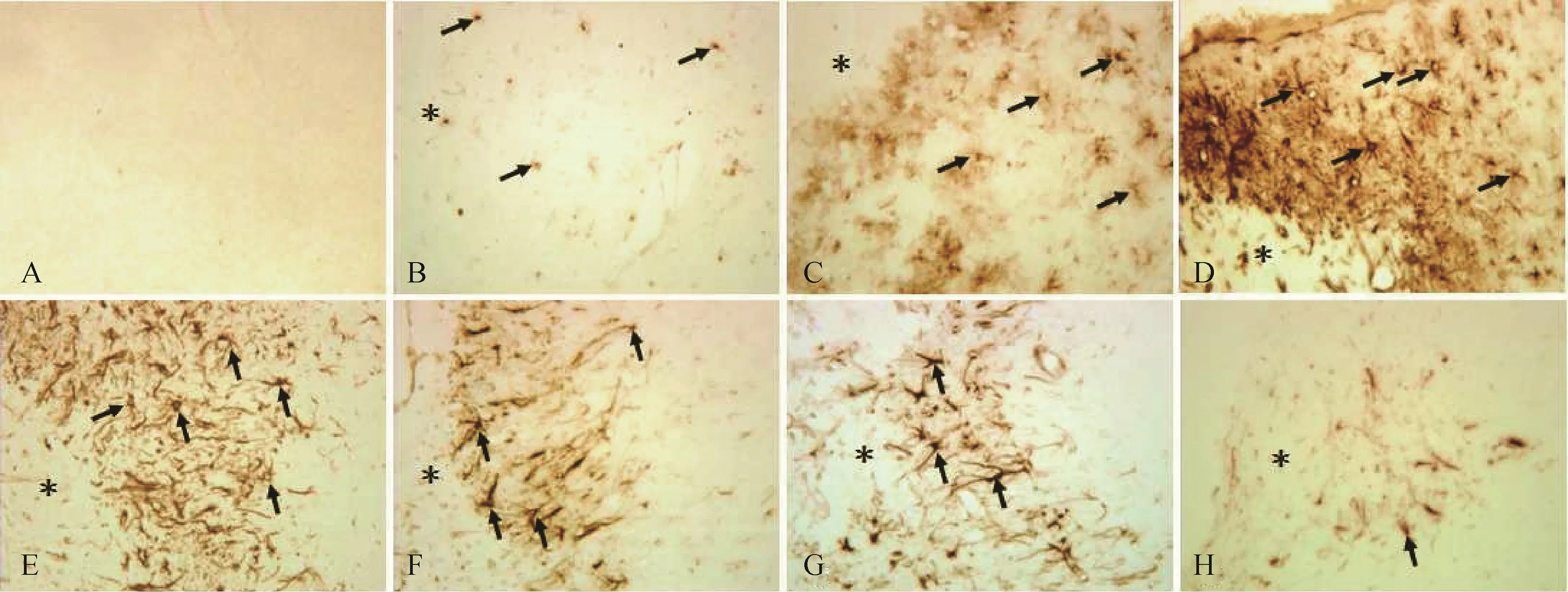
图3 脑缺血后Nestin 阳性细胞的形态变化(×400,抗Nestin 抗体免疫组化染色)
2.2.3 脑缺血后Nestin 阳性细胞的数量变化 正常对照组和假手术组相比较,以及假手术组各亚组之间比较,分布于各脑区的Nestin 阳性细胞数量比较,差异均无统计学意义(>0.05);脑缺血后,Nestin阳性细胞数呈一过性增多,于缺血后3d 达到高峰。与正常对照组、假手术组和缺血对侧比较,缺血侧SVZ 的Nestin 阳性细胞数于缺血后1d、2d、3d、1周,差异均有统计学意义(<0.05);脑缺血后1d,梗死灶周围大脑皮质和纹状体出现Nestin 阳性细胞,并持续存在至缺血后4 周;缺血后1d、2d、3d、1周,缺血对侧大脑皮质和纹状体也出现少量Nestin阳性细胞,见表1。

表1 MCAO 后各组大鼠的Nestin 阳性细胞数(,个,n=5)
2.2.4 脑缺血后Nestin 阳性细胞的平均吸光度值 与正常对照组、假手术组和缺血对侧比较,缺血侧SVZ的Nestin 阳性细胞平均吸光度值于缺血后1d、2d、3d 和1 周,差异均有统计学意义(<0.05),其中,缺血后3d 达高峰,缺血后2 周已回落到正常水平,见图4;缺血侧大脑皮质和纹状体的Nestin 阳性细胞平均吸光度值于MCAO 后各组均升高,高峰期在缺血后3d 和1 周,差异均无统计学意义(>0.05),见图5。
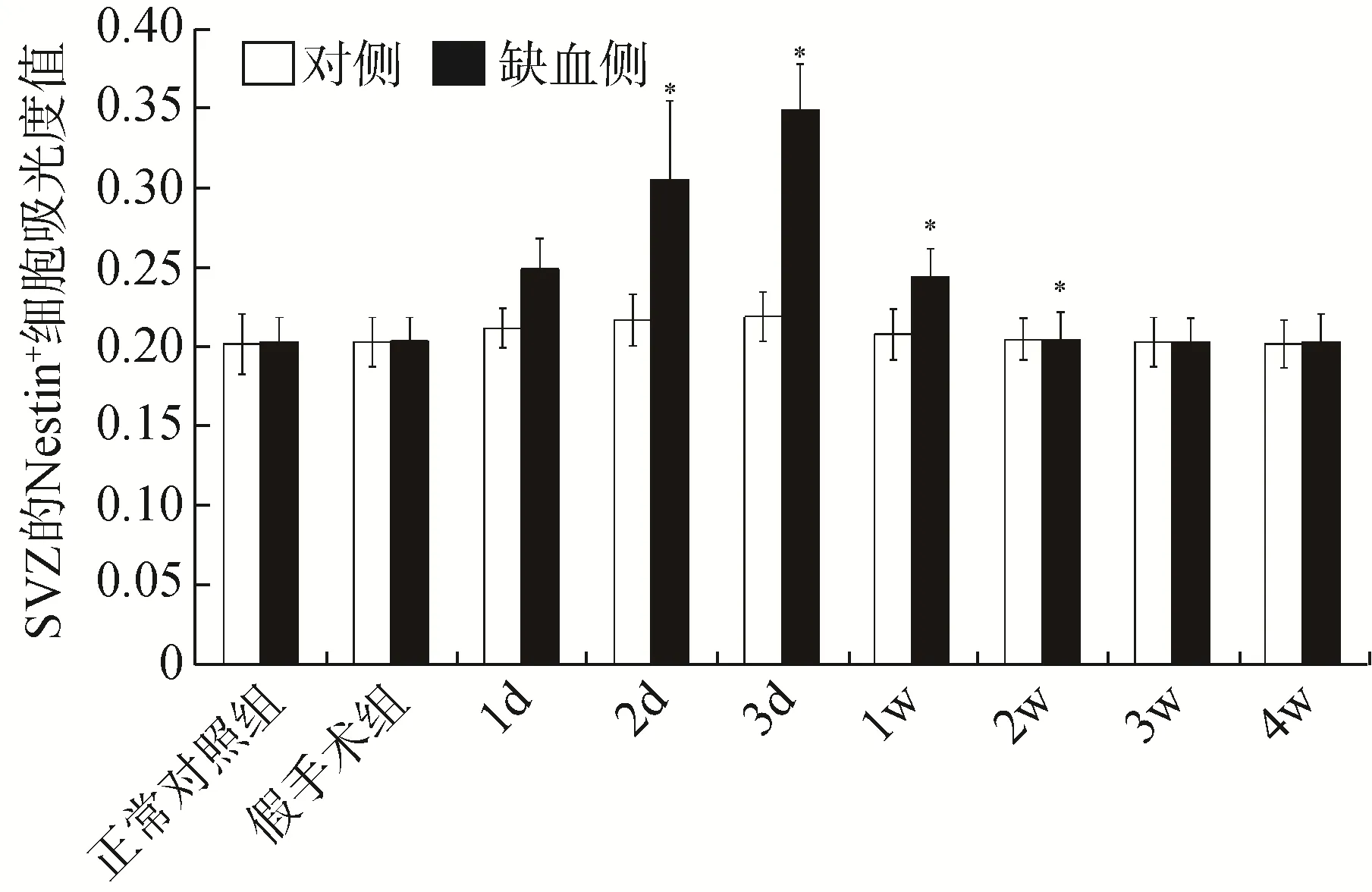
图4 MCAO 后各组大鼠SVZ 的Nestin 阳性细胞平均吸光度值的变化

图5 MCAO 后各组大鼠大脑皮质和纹状体Nestin阳性细胞平均吸光度值的变化
2.3 Nestin/GFAP 免疫荧光双标染色结果
正常对照组和假手术组,大脑皮质和纹状体可见少量血管内皮有微弱的Nestin 阳性表达,有大量GFAP 阳性细胞散在分布,免疫荧光双标未见Nestin与GFAP 有共表达;脑缺血后,梗死灶周围大脑皮质和纹状体的Nestin 阳性细胞和GFAP 阳性细胞均增多,且大部分Nestin 阳性细胞与GFAP 共表达,见图6。
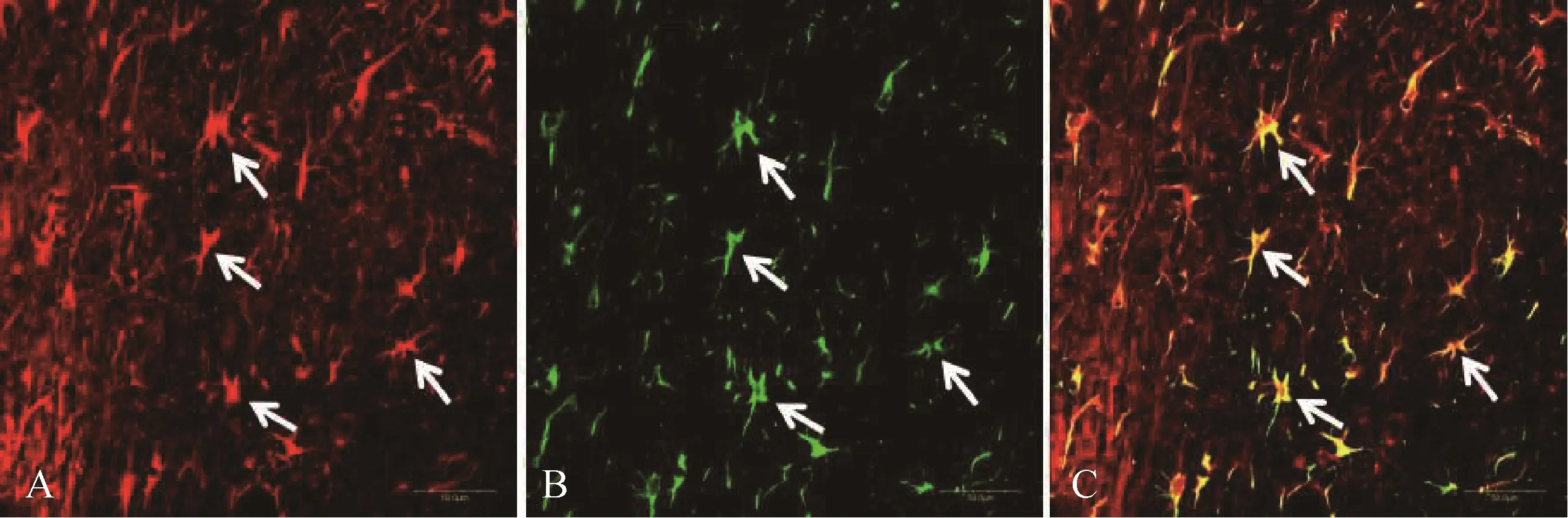
图6 脑缺血后1 周梗死灶周围大脑皮质和纹状体Nestin/GFAP 免疫荧光双标染色
3 讨论
神经干细胞(neural stem cell,NSCs)是指具有自我更新和增生能力,且能够分化为神经元、星形胶质细胞和少突胶质细胞的细胞群。目前已证实,成年哺乳动物(包括成年人)脑内多个部位存在NSC,其中侧脑室室管膜下区(subventricular zone,SVZ)被公认为成年脑内最大的“神经干细胞库”。生理情况下,分布于SVZ 部位的NSC 持续增生、更新,经吻侧迁移流向嗅球迁移,在迁移过程中NSC不断发育成熟,最终分化为嗅球的中间神经元。然而,脑缺血等损伤后,在某些细胞因子或信号通路的作用下,SVZ 显著增生的NSC 逐渐迁往梗死灶方向,并分化为神经元和神经胶质细胞,通过替换死亡神经元、挽救濒死神经元及抑制炎症反应等,参与脑缺血后神经功能的重建。Xu 等运用线栓法制备大鼠局灶性脑缺血2h 再灌注模型,实验表明梗死灶周围的Nestin 阳性细胞于缺血后1d 开始增多,缺血后7d 阳性细胞数量达到高峰,阳性细胞可持续存在至缺血后2 周。王佳等从大面积脑梗死患者术后废弃的前颞叶脑组织中成功分离出NSC,通过体外培养其能够大量增生、稳定传代并维持NSC 特性,且具有向神经元及星形胶质细胞分化的潜能。以上研究均表明,通过激活内源性NSC 来修复脑缺血患者神经功能障碍具有十分重要的应用价值。
本研究结果显示,脑缺血损伤后,缺血侧SVZ部位的Nestin 阳性细胞被激活,并迁往梗死灶周围的大脑皮质和纹状体,于缺血后3d 阳性细胞计数最多,该结果与部分研究认为Nestin 阳性细胞在缺血后7d 数量最多不一致。本实验还发现,随着缺血时间的延长,增生的Nestin 阳性细胞逐渐减少直至消失,缺血后2 周,缺血侧SVZ 的阳性细胞数及表达强度已回落到正常水平,梗死灶周围的阳性细胞在缺血后4 周也基本消失,推测可能是由于绝大部分新生细胞因缺血区的新陈代谢、氧化、炎症及其他刺激引发的凋亡机制而死亡。
星形胶质细胞是中枢神经系统内数量最多的一种细胞,其特异性标志物为胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)常用于星形胶质细胞的鉴定和分离。星形胶质细胞对神经元起支持、营养及协助代谢等作用,对维持神经元的正常形态和功能至关重要。脑缺血损伤后,星形胶质细胞通过聚集于梗死灶边缘形成胶质瘢痕,起到限制缺血损伤范围、避免梗死灶中央炎症向外扩散的作用。另外,星形胶质细胞还可以释放神经营养因子和免疫介质,为缺血后神经元的存活提供良好的微环境,加强神经元抵御神经毒性物质的能力,减轻或阻止神经元的继发损伤,从而参与脑缺血组织的神经功能修复。本实验运用抗Nestin/GFAP 抗体的免疫荧光双标染色发现,脑缺血后增生的绝大部分Nestin 阳性细胞与GFAP 有共表达,结合脑缺血后Nestin 的动态表达变化,推测脑缺血后增生的Nestin 阳性细胞由缺血侧SVZ 逐渐迁移至梗死灶边缘,并分化为星形胶质细胞,从而参与脑缺血损伤后的神经保护作用。
综上所述,脑缺血后激活了缺血侧SVZ 部位的Nestin 阳性细胞一过性增生,于脑缺血后3d 达到增生高峰,Nestin 阳性细胞从缺血侧SVZ 迁往梗死灶边缘并分化为星形胶质细胞,可能通过形成胶质瘢痕、释放神经营养因子和免疫介质等对脑缺血后神经功能的修复起着重要作用。

