微RNA-152靶向调控内质网脂质Raft关联蛋白1对甲状腺乳头状癌细胞增殖和迁移的影响
赵艳利,康志强,毛 雨,张晓珂,孙 玲,汪 湲
(郑州大学附属郑州中心医院内分泌科,河南 郑州 450000)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的甲状腺恶性肿瘤,研究表明,10%~15%的PTC患者是中度分化的PTC变异型,这种变异型可促进癌细胞的侵略性,导致患者具有较高病死率[1-2]。微RNA(microRNA,miRNA)是非编码的小分子RNA,与特定靶基因3′非翻译区结合后共同调节基因的转录和翻译,与肿瘤发生、发展密切相关[3-4]。研究表明,miR-152在PTC中表达下调,在PTC发生、发展中发挥重要作用[5],但miR-152在PTC中的具体作用机制尚不清楚。本研究通过体外培养PTC细胞株TPC-1,观察miR-152异常表达对TPC-1细胞生物学功能的影响,并预测miR-152可能作用的靶基因,为寻找PTC新的治疗靶点提供理论依据。
1 材料与方法
1.1 细胞、主要试剂与仪器人PTC细胞株TPC-1、正常甲状腺细胞株Nthy-ori 3-1由上海中国科学院细胞研究所提供;达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)购自美国Gibco公司,兔多克隆内质网脂质Raft关联蛋白1(endoplasmic reticulum lipid raft associated protein 1,ERLIN1)抗体购自英国Abcam公司,miR-152 mimics、miRNA-mimics阴性对照购自北京博迈斯科技发展有限公司,实时荧光定量聚合酶链式反应(real-time quantitative reverse transcription polymerasechain reaction,qRT-PCR)所需引物由生工生物工程(上海)股份有限公司合成;Mir-162-PC/Mir-262-PC型CO2培养箱购自日本松下公司,SpectraMax®iD5酶标仪购自美国Molecular Devices公司,BD FACSCanto Ⅱ流式细胞仪购自美国BD公司,XDS-10显微镜购自上海炳宇光学仪器有限公司,ChemiDocXRS化学发光成像系统购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养将TPC-1、Nthy-ori 3-1细胞接种于DMEM培养基,置于37 ℃、含体积分数5% CO2的恒温培养箱中培养12 h后,显微镜下观察细胞生长状态,细胞融合达80%左右时进行消化、传代,取对数生长期细胞进行后续实验。
1.2.2 细胞处理及分组取对数生长期TPC-1细胞,以每孔2×105个细胞的密度接种于6孔培养板中,当细胞融合达80%时进行转染,将TPC-1细胞随机分为miR-152组(转染miR-152-mimics至TPC-1细胞内)、miR-con组(转染miRNA-mimics阴性对照至TPC-1细胞内)及空白对照组(不做任何处理);另取对数生长期Nthy-ori 3-1细胞作为Nthy-ori 3-1组。
1.2.3 qRT-PCR法检测各组细胞中miR-152、ERLIN1 mRNA表达提取各组细胞总RNA,并反转录为cDNA。以cDNA为模板,配制20 μL反应体系,于qRT-PCR仪上进行扩增。反应条件:95 ℃ 预变性 30 s,95 ℃变性5 s,60 ℃退火30 s,70 ℃延伸10 s,共35个循环。miR-152上游引物序列为5′-GCCCAGGTTCTGTGATACACT-3′,下游引物序列为5′-CCCAAGTTCTGTCATGCAC-3′;ERLIN1上游引物序列为 5′-GCGAAAGCAGATGCTGAATAT-3′,下游引物序列为5′-ATATTCAGCATCTGCTTTCGC-3′;U6上游引物序列为5′-TTACATTGCTATCCACAGAACGG-3′,下游引物序列为5′-CTATGCTGCTGCTTTTTGCTC-3′;β-actin上游引物序列为5′-CTTCTACAATGAGCTGCGTG-3′,下游引物序列为5′-TCATGAGGTAGTCAGTCAGG-3′。以U6为miR-152的内参,以β-actin为ERLIN1的内参,采用2-△△Ct法计算Nthy-ori 3-1、TPC-1细胞中miR-152相对表达量和TPC-1细胞中ERLIN1 mRNA相对表达量。
1.2.4 四唑盐(methyl thiazolyl tetrazolium,MTT)比色法检测各组TPC-1细胞增殖能力取转染后处于对数生长期的TPC-1细胞,调整细胞密度为 1×108L-1,接种至96孔板,培养24 h后,MTT比色法检测各组细胞增殖能力,各组设6个平行孔,每孔加入 20 μL MTT,于37 ℃、含体积分数5% CO2的恒温培养箱中孵育4 h后,每孔加入 200 μL 二甲基亚砜,用酶标仪测波长570 nm处的吸光度值,计算细胞增殖抑制率。增殖抑制率=(l-吸光度实验组/吸光度对照组)×100%。实验重复6次,取均值。
1.2.5 平板克隆形成实验检测各组TPC-1细胞增殖能力取转染后处于对数生长期的TPC-1细胞,调整细胞密度为1×106L-1,接种至培养皿中,各组设6个平行孔。当克隆细胞肉眼可见时,弃去培养基,结晶紫染色、冲洗,晾干后用相机拍照并计数细胞克隆数。实验重复6次,取均值。
1.2.6 流式细胞术检测各组TPC-1细胞凋亡情况收集各组TPC-1细胞,调整细胞密度为1×109L-1的细胞悬液,取100 μL细胞悬液加入5 μL膜联蛋白V-异硫氰酸荧光素(annexinV-fluoreseein isothiocyanate,AnnexinV-FITC)和5 μL碘化丙啶(propidium lodide,PI)混匀,室温避光孵育15 min后,流式细胞仪进行检测。实验重复6次,取均值。
1.2.7 Transwell实验检测各组TPC-1细胞迁移、侵袭能力收集各组TPC-1细胞,调整细胞密度为2×108L-1,接种于Transwell上室,下室加 250 μL含体积分数10%胎牛血清的培养基,置于37 ℃、含体积分数 5% CO2的培养箱中培养48 h后,40 g·L-1多聚甲醛固定,结晶紫染色,于倒置显微镜下随机选取5个视野进行观察并计算细胞迁移数。细胞侵袭能力检测:制备50 μL Matrigel胶(200~300 mg·L-1),铺在Transwell小室的上室,待Matrigel胶凝固,后续操作步骤与细胞迁移能力检测一致,并计算细胞侵袭数。
1.2.8 Western blot法检测各组TPC-1细胞中ERLIN1 蛋白表达提取各组TPC-1细胞总蛋白,二喹啉甲酸法测其浓度,按每孔30 μg蛋白上样,进行电泳分离、转膜,封闭后分别加入一抗(抗ERLIN1、β-actin抗体,11 000),4 ℃过夜培养,次日加二抗(15 000),温室培养1 h,洗膜,滴加增强化学发光液进行显色,扫描胶片,Tanon 600图像分析系统分析条带灰度值。目的蛋白相对表达量=目的蛋白条带灰度值/内参β-actin条带灰度值。

2 结果
2.1 各组细胞中miR-152相对表达量比较结果见表1。空白对照组、miR-con组、miR-152组TPC-1细胞中miR-152相对表达量显著低于Nthy-ori 3-1组,差异有统计学意义(P<0.05);miR-152组TPC-1细胞中miR-152相对表达量显著高于空白对照组和miR-con组,差异均有统计学意义(P<0.05);空白对照组与miR-con组 TPC-1细胞中miR-152相对表达量比较差异无统计学意义(P>0.05)。
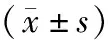
表1 4组细胞中miR-152相对表达量比较
2.2 过表达miR-152对TPC-1细胞增殖能力的影响结果见图1和表2。与空白对照组、miR-con组比较,miR-152组TPC-1细胞增殖抑制率显著升高,细胞克隆数显著降低,差异均有统计学意义(P<0.05);空白对照组与miR-con组TPC-1细胞增殖抑制率和细胞克隆数比较差异均无统计学意义(P>0.05)。
图1 3组TPC-1细胞克隆情况
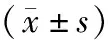
表2 3组TPC-1细胞增殖能力比较
2.3 过表达miR-152对TPC-1细胞凋亡的影响结果见图2和表3。miR-152组TPC-1细胞凋亡率显著高于空白对照组和miR-con组,差异有统计学意义(P<0.05);空白对照组与miR-con组TPC-1细胞凋亡率比较差异无统计学意义(P>0.05)。
图2 流式细胞术检测3组TPC-1细胞凋亡情况
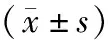
表3 3组TPC-1细胞凋亡率比较
2.4 过表达miR-152对TPC-1细胞迁移、侵袭能力的影响结果见图3和表4。miR-152组TPC-1细胞迁移数、侵袭数均显著低于空白对照组和miR-con组,差异有统计学意义(P<0.05);空白对照组与miR-con组TPC-1细胞迁移数、侵袭数比较差异均无统计学意义(P>0.05)。
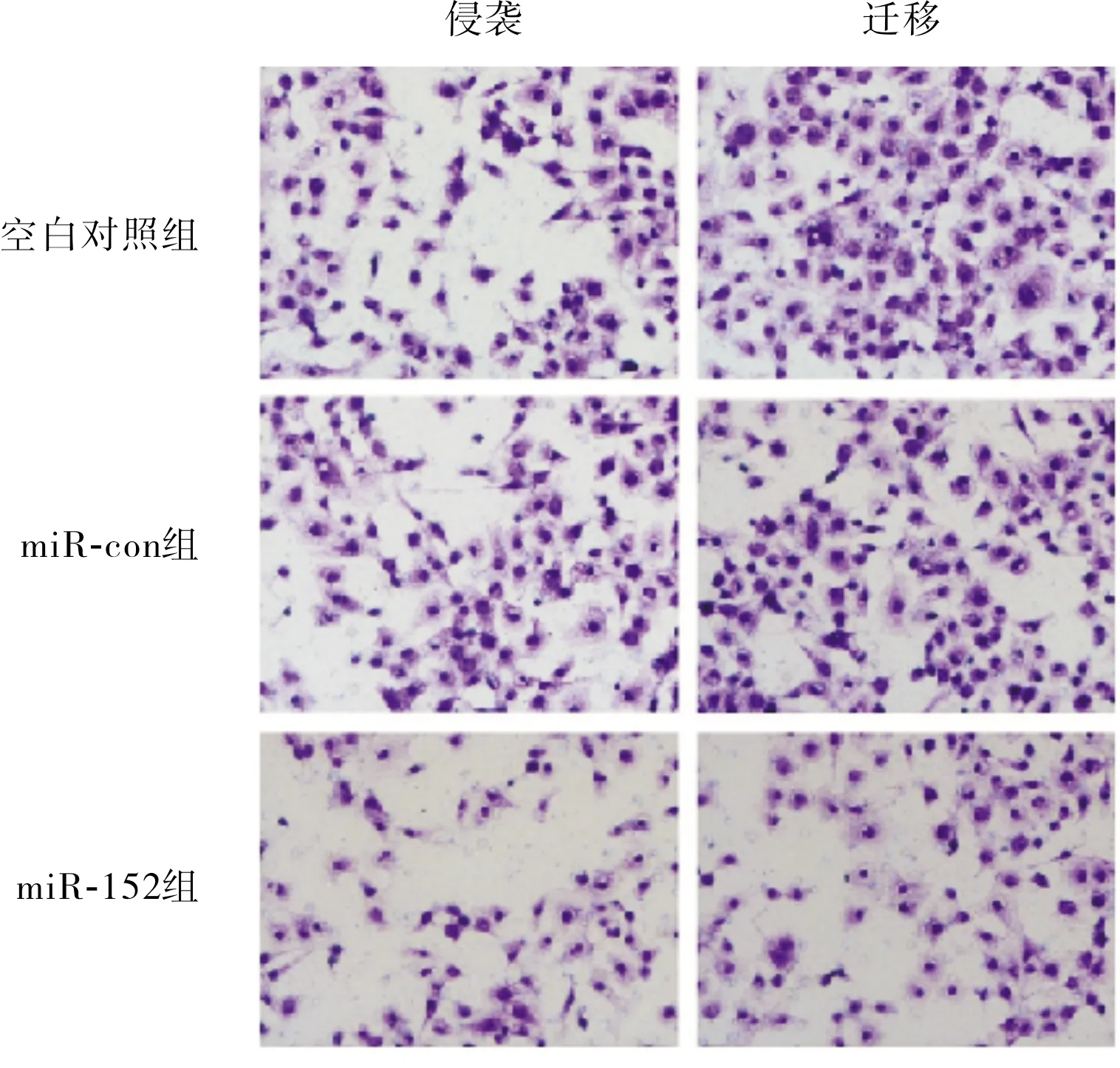
图3 3组TPC-1细胞迁移、侵袭能力
表4 3组TPC-1细胞迁移、侵袭能力比较
2.5 过表达miR-152对TPC-1细胞中ERLIN1 mRNA及蛋白表达的影响结果见图4和表5。miR-152组TPC-1细胞中ERLIN1 mRNA及蛋白相对表达量均显著低于空白对照组和miR-con组,差异有统计学意义(P<0.05);空白对照组与miR-con组TPC-1细胞中ERLIN1 mRNA及蛋白相对表达量比较差异均无统计学意义(P>0.05)。
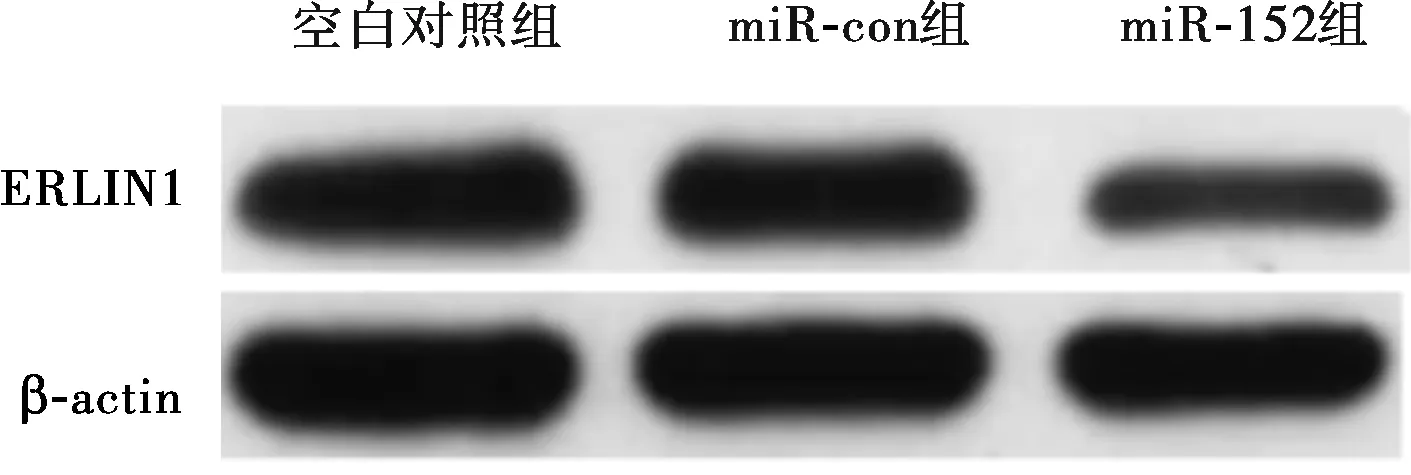
图4 3组TPC-1细胞中ERLIN1蛋白表达(Western blot)
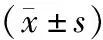
表5 3组TPC-1细胞中ERLIN1 mRNA及蛋白相对表达量比较
3 讨论
PTC是一种分化型甲状腺癌,占甲状腺癌的85%~90%,大部分PTC患者具有较好的预后,但PTC较易发生颈部淋巴结转移,导致患者复发及再手术风险增加,是造成甲状腺癌病死率升高的主要原因[6-8]。随着生物技术的不断发展和人们对非编码RNA的认识,大量研究表明,miRNA不仅可以调节基因表达,还参与调节细胞增殖、发育、分化、凋亡等多种生物过程,miRNA异常表达与心血管疾病、肝癌、PTC等多种疾病的发生有关[9-12]。胡仿玲等[13]研究报道,miRNA与PTC的发生、发展、侵袭、转移相关,可作为诊治PTC的生物标志物。因此,从分子水平研究PTC的发病机制,寻找其药物治疗的新靶点,对PTC患者临床治疗具有重要意义。
miR-152属于miR-148/miR-152家族,在子宫内膜癌、乳腺癌等多种癌组织和细胞中低表达,其表达与癌细胞增殖、侵袭、迁移和凋亡等过程密切相关[14-16]。本研究发现,与Nthy-ori 3-1组相比,空白对照组、miR-con组、miR-152组TPC-1细胞中miR-152表达水平显著降低,提示miR-152与PTC疾病的发生密切相关。XIE等[17]研究表明,miR-152是一种肿瘤抑制因子,miR-152过表达可以抑制子宫内膜癌细胞增殖。本研究发现,miR-152组TPC-1细胞中miR-152相对表达量显著高于空白对照组和miR-con组,提示过表达miR-152的TPC-1细胞株构建成功。进一步研究发现,与空白对照组、miR-con组相比,miR-152组TPC-1细胞中细胞增殖抑制率显著升高,细胞克隆数显著减少,提示miR-152过表达可以抑制TPC-1细胞增殖。周文宾等[18]研究显示,在肾癌细胞中,过表达miR-152可以降低细胞的存活率,促进细胞凋亡。本研究发现,miR-152组TPC-1细胞凋亡率显著高于空白对照组和miR-con组,提示miR-152表达升高可以促进TPC-1细胞凋亡。HE等[19]研究显示,miR-152表达与垂体腺癌细胞侵袭、迁移能力密切相关。本研究结果显示,miR-152组TPC-1细胞的迁移数、侵袭数均显著低于空白对照组和miR-con组,提示过表达miR-152可抑制TPC-1细胞迁移、侵袭。
ERLIN1基因属于内质网脂质筏相关蛋白家族,是胆固醇结合蛋白,与体内胆固醇的稳态平衡、病毒感染后RNA复制及感染性病毒的产生有关[20-21]。吴贺文[22]研究表明,ERLIN1在乳腺癌细胞中高表达可影响细胞生长、侵袭、迁移等生物过程,miR-410可以靶向负调控ERLIN1。本研究发现,miR-152组TPC-1细胞中ERLIN1 mRNA及蛋白相对表达量显著低于空白对照组和miR-con组,提示miR-152可能通过靶向调控ERLIN1的表达来抑制TPC-1细胞增殖、侵袭和迁移,促进细胞凋亡。
综上所述,miR-152在TPC-1细胞中低表达,其可能通过靶向负调控ERLIN1的表达来影响细胞增殖、侵袭、迁移、凋亡等生物过程,从而参与PTC的进展和转移。但miR-152与ERLIN1在PTC中作用的具体机制仍需进一步研究来验证。

