过氧化物酶体增殖物激活受体γ辅激活剂-1α rs2946385基因多态性与帕金森病的相关性
谷晓源,车祥源,马 静,宋净洋,邢红霞,李超堃
(1.河南省神经修复重点实验室,河南 新乡 453000;2.新乡医学院第一附属医院神经内科,河南 卫辉 453100;3.新乡医学院基础医学院生理学与神经生物学教研室,河南 新乡 453003;4.新乡医学院第三附属医院神经内科,河南 新乡 453003)
帕金森病(Parkinson′s disease,PD)是一种常见的神经变性疾病,以黑质多巴胺能神经元进行性缺失和路易小体形成为病理特征[1]。氧化应激和线粒体功能缺陷,特别是复合物I活性下降是PD发病机制的核心[2-3]。过氧化物酶体增殖物激活受体γ辅激活剂-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)是参与细胞能量代谢和线粒体生物合成的许多基因的重要辅助活化因子,通过参与调节线粒体能量代谢来发挥神经保护作用[4-5]。此外,细胞内需要严格的质量控制体系来保证健康的线粒体网络以维持线粒体稳态。PGC-1α表达上调可以调节线粒体质量控制,以防止线粒体功能障碍,如亨廷顿病、阿尔茨海默病和PD[6]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD小鼠模型中,PGC-1α基因敲除小鼠黑质中酪氨酸羟化酶阳性神经元丢失达61%,而野生型仅丢失12%[7]。PGC-1α基因在PD的发生中起重要作用,是PD候选易感基因。目前,关于PGC-1α 基因多态性与PD发生的相关性尚无相关研究。有研究发现,PGC-1α rs2946385基因多态性与2型糖尿病(type 2 diabetes,T2DM)的发生显著相关[8]。而T2DM和PD患者存在相同的通路损害,如超过60%的PD患者胰岛素信号受损且出现糖耐量受损,在约62%的PD痴呆患者中发现胰岛素抵抗,且其中30%的人对葡萄糖不耐受[9]。与不合并糖尿病的PD患者相比,合并糖尿病的PD患者的统一帕金森病评定量表第三部分(unified Parkinson′s disease rating scale part Ⅲ,UPDRS-Ⅲ)运动评分、脑脊液tau蛋白水平较高,纹状体多巴胺转运蛋白结合水平较低[10]。以上研究提示PGC-1α rs2946385基因多态性与PD的发生可能存在相关性。基于此,本研究探讨了PGC-1α rs2946385 基因多态性与PD发病风险的相关性。
1 资料与方法
1.1 一般资料选择2018年3月至2019年12月新乡医学院第一附属医院神经内科门诊及住院诊断为PD的86例患者(PD组)为研究对象。患者均符合英国帕金森病脑库临床诊断标准[11]。排除标准:(1)有精神疾病及家族史者;(2)糖尿病、躯体障碍疾病;(3)各种原因引起的帕金森综合征和帕金森叠加综合征;(4)脑血管疾病史、颅脑外伤史。由2名神经内科医师进行临床信息收集并行头颅CT或核磁共振成像检查排除以上疾病。采用汉密尔顿抑郁量表(hamilton depression scale,HAMD)、汉密尔顿焦虑量表(hamilton anxiety scale,HAMA)、UPDRS-Ⅲ运动评分、简易精神状态评价量表(mini-mental state exam,MMSE)及蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)分别来评估PD患者的抑郁状态、焦虑状态、运动功能及认知功能。MMSE量表得分<27分为认知功能下降,MOCA 量表得分<26分为认知功能下降,HAMD量表得分>17 分表示存在抑郁,HAMA量表得分>14分表示合并焦虑。根据PD患者运动症状和UPDRS-Ⅲ评分,依据KANG等[12]提出的分型方法将PD患者分为强直少动型(rigidity dominant PD,AR-PD)组(n=44)和震颤为主型(tremor dominant PD,TD-PD)组(n=42)。另选择性别、年龄与PD组匹配的健康体检者86例作为对照组。PD组:男44例,女42例;年龄40~83(60.27±8.12)岁;病程1~10(3.33±1.94)a;认知功能正常24例,认知功能下降62例;合并焦虑19例,不合并焦虑67例。对照组:男45例,女41例;年龄42~79(60.29±8.66)岁。2组受试者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。AR-PD组:男23例,女21例;年龄40~82(60.09±8.77)岁;病程1~10(3.45±1.95)a;认知功能正常11例,认知功能下降33例;合并焦虑13例,不合并焦虑31例。TD-PD组:男21例,女21例;年龄40~83(60.45±70.47)岁;病程1~10(3.19±1.95)a;认知功能正常20例,认知功能下降22例;合并焦虑6例,不合并焦虑36例。本研究通过新乡医学院第一附属医院伦理委员会审核批准,所有入组对象提前被告知本研究的目的,并签署相关知情同意书。
1.2 rs2946385 基因多态性检测
1.2.1 全基因组提取所有受试者抽取清晨空腹肘静脉血4 mL,置于乙二胺四乙酸二钠抗凝管中,严格按照血液DNA提取试剂盒的说明操作取全基因组,采用WD9409B紫外分析仪检测 DNA的浓度及纯度,放入-80 ℃冰箱冻存备用。
1.2.2 rs2946385位点引物的设计与合成依据美国国家生物信息中心PGC-1α基因序列设计,在基因组找到rs2946385基因位点,采用引物设计软件Oligo Analyzer设计引物,由武汉金开瑞生物工程有限公司合成。该位点上游引物序列为5′-TCCTATCACATGCTATTGCAG-3′,下游引物序列为5′-GGGAAATAGACAGGAATAAACAGG-3′。
1.2.3 rs2946385基因片段获取应用聚合酶链反应(polymerase chain reaction,PCR)技术进行目的基因片段的扩增。PCR反应体系(50 μL):模板DNA 1 μL,双蒸水21 μL,2×Taq PCR Mix 25 μL,上、下游引物各1.5 μL。PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,共35个循环,72 ℃终末延伸10 min。PCR反应结束后,取2 μL PCR产物,加入1 μL核酸染料染色,混匀,在170 V恒压下使用质量分数1%的琼脂糖凝胶进行核酸电泳12 min左右,然后使用XRS+型凝胶成像仪确认扩增产物。
1.2.4 PCR产物测序选取可以扩增出rs2946385基因片段的PCR产物,将该产物送至武汉金开瑞生物工程有限公司进行测序,测序结果使用DNAMAN8软件进行比对分析,使用Chromas软件读取测序峰图,对PD组和对照组rs2946385位点进行基因分型。

2 结果
2.1 受试者非运动症状比较结果见表1和表2。PD组患者中认知功能下降、焦虑、抑郁患者所占比例显著高于对照组,差异有统计学意义(P<0.05)。AR-PD组与TD-PD组患者中焦虑、抑郁患者所占比例比较差异均无统计学意义(P>0.05),AR-PD组患者中认知功能下降患者所占比例显著高于TD-PD组,差异有统计学意义(P<0.05)。

表1 PD组与对照组受试者非运动症状比较
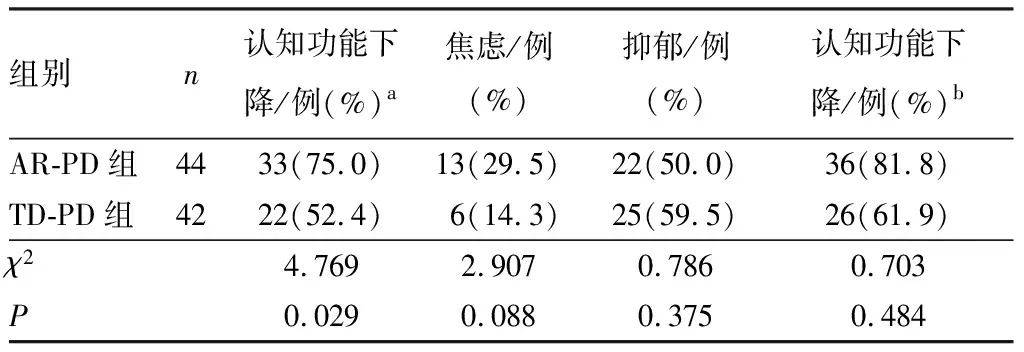
表2 AR-PD组与TD-PD组受试者非运动症状比较
2.2 rs2946385 基因型和等位基因在PD及其亚型中的分布结果见图1和表3。rs2946385位点基因型有AA、CA、CC 3种,PD组和对照组基因分布均符合Hardy-Weinberg平衡定律(P>0.05)。PD组患者CC基因型、等位基因C频率与对照组比较差异无统计学意义(P>0.05)。AR-PD组患者CC基因型、等位基因C频率与TD-PD组比较差异均无统计学意义(P>0.05)。

表3 各组受试者rs2946385 基因型和等位基因频率的比较
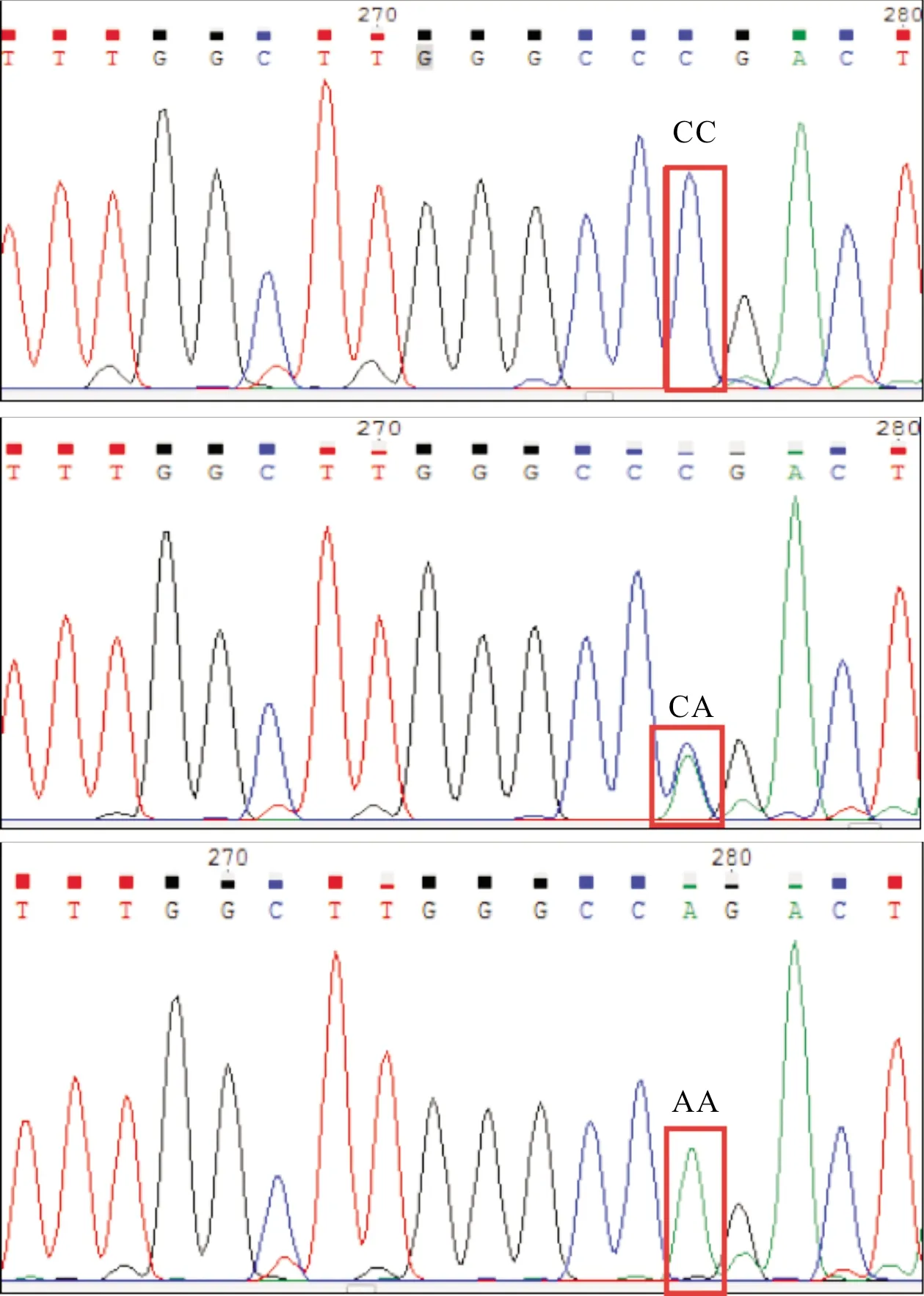
注:rs2946385位点 C>A,分CC、CA、AA 3种基因型。
2.3 rs2946385 基因型和等位基因与PD患者焦虑、认知的关联性分析结果见表4和表5。PD组中合并焦虑与不合并焦虑患者的基因型和等位基因分布比较差异均无统计学意义(P>0.05)。TD-PD组合并焦虑与不合并焦虑患者的基因型和等位基因分布比较差异无统计学意义(P>0.05)。AR-PD组合并焦虑患者中基因型CC患者所占比例及等位基因C频率显著低于不合并焦虑患者,差异均有统计学意义(P<0.05)。
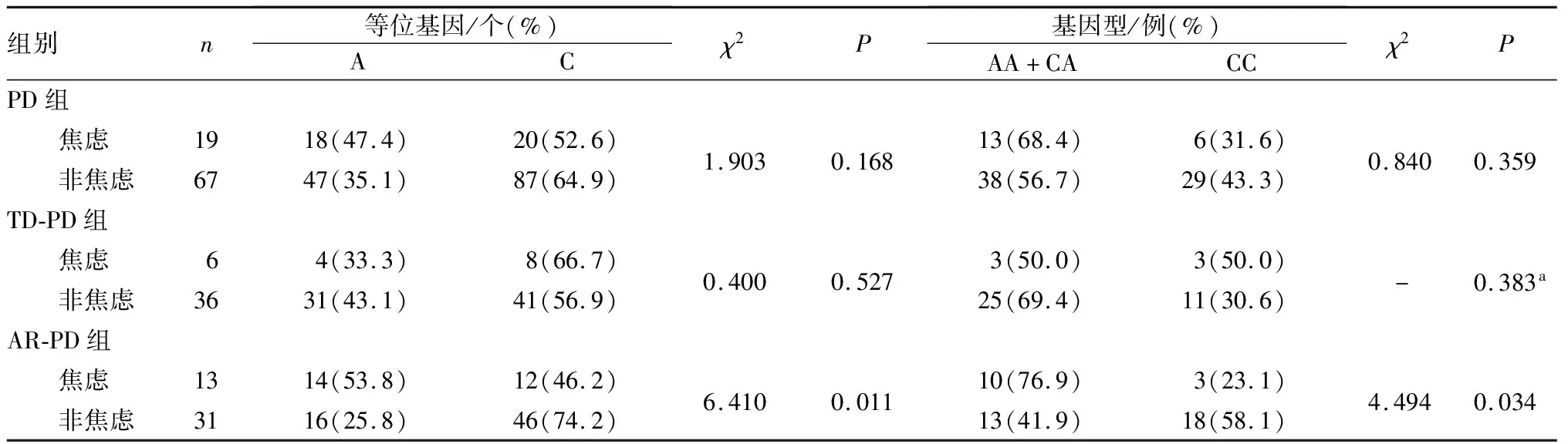
表4 PD组中焦虑与非焦虑受试者rs2946385 基因型和等位基因频率比较
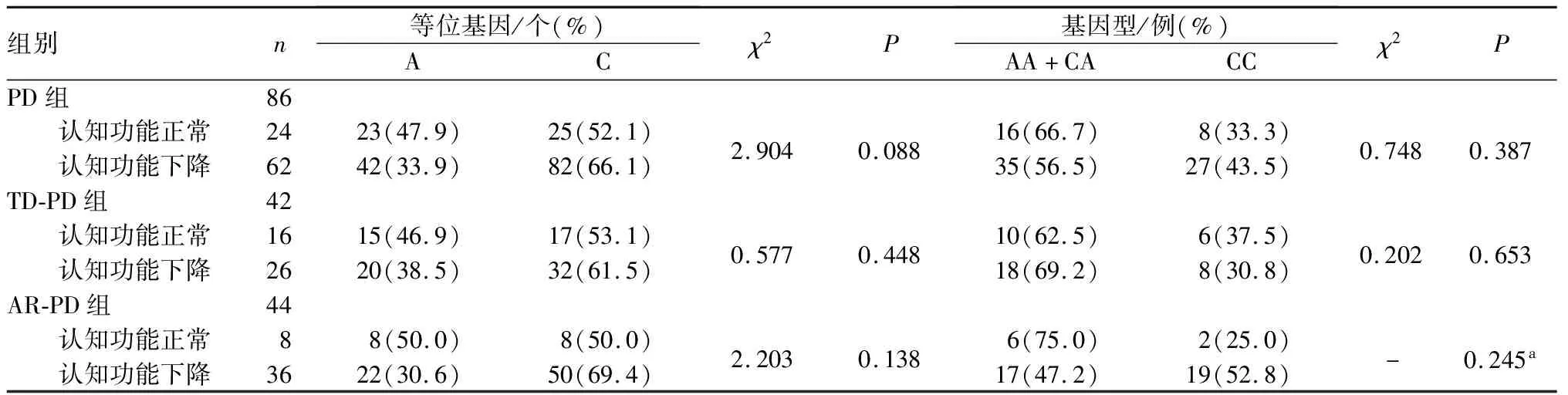
表5 PD组患者中认知功能正常与认知功能下降患者rs2946385 基因型和等位基因频率比较
PD组、TD-PD组、AR-PD组合并认知功能下降与不合并认知功能下降患者的基因型和等位基因分布比较差异均无统计学意义(P>0.05)。
2.4 影响AR-PD患者并发焦虑的因素logistic回归分析结果见表6。年龄、性别、病程、PGC-1α rs2946385不是AR-PD合并焦虑的独立危险因素(P>0.05),UPDRS-Ⅲ评分的严重程度是AR-PD合并焦虑的独立危险因素(P<0.05)。调整性别、年龄、病程、UPDRS-Ⅲ评分等危险因素后,PGC-1α rs2946385与AR-PD组患者合并焦虑仍无相关性(P>0.05)。

表6 AR-PD并发焦虑的危险因素logistic回归分析
3 讨论
PD是一种进展性神经退行性疾病,有研究发现,线粒体功能障碍和氧化应激与PD密切相关[1]。PD患者死后脑组织尸检结果[13]、MPTP和鱼藤酮应用于 PD的动物和细胞模型[14-15]均表明线粒体功能障碍与散发性PD的发病机制有关。PGC-1α基因可以挽救MPTP诱导的C57BL小鼠线粒体功能障碍[16],PGC-1α在PD的发病中起保护作用。
T2DM患者发生PD的概率显著升高,T2DM和PD的发病可能存在共同的遗传倾向和(或)共同的致病途径[8]。PGC-1α是PD发病中的重要调节因子,因此,本研究观察了PGC-1α rs2946385位点突变率与PD的发生是否相关。本研究中,对照组和PD组受试者PGC-1α rs2946385位点突变的频率比较差异无统计学意义,也未观察到PGC-1α rs2946385位点与AR-PD、TD-PD患者发病风险的相关性。据此推断,PGC-1α rs2946385基因多态性可能不是T2MD与PD的共同致病原因,PGC-1α rs2946385基因多态性可能不是PD发病的危险因素。本研究未纳入合并糖尿病的PD患者,PGC-1α rs2946385位点突变阳性与PD合并糖尿病的发生风险尚不清楚,今后的研究将会对此进一步探讨。既往有研究报道,PGC-1α是焦虑相关疾病的潜在易感基因[17]。LEONE等[18]在PGC-1α基因缺陷小鼠中观察到焦虑样行为的增加。而在SZALARDY等[19]的研究中并未观察到PGC-1α基因缺陷小鼠焦虑行为的增加,相反这些动物尤其是雄性动物的焦虑相关行为显著降低[19]。基于以上不同观点,本研究也观察了PGC-1α rs2946385基因多态性与PD非运动症状焦虑发生的相关性,结果显示,PD组、TD-PD组中PGC-1α rs2946385基因多态性与受试者合并焦虑的发生没有关联,而AR-PD组患者中PGC-1α rs2946385基因型CC、等位基因C频率与受试者合并焦虑的发生有关,但logistic回归分析结果显示,PGC-1α rs2946385基因多态性并不是AR-PD患者合并焦虑的独立危险因素,这可能与本研究的样本量不够足、入选研究对象限定为豫北地区人群有关。本研究发现,运动症状越严重,AR-PD组患者合并焦虑的风险越大,这与万志荣等[20]研究结果一致。既往研究多关注在PD合并抑郁方面,对并发焦虑的关注度不高,针对UPDRSⅢ评分、PGC-1α rs2946385基因多态性与PD亚型合并焦虑的发病风险仍需进一步扩大样本量进行验证。此外,有文献报道,PD患者的首发症状中,以震颤为首发症状的患者发生认知功能障碍的比例要较以肌强直为首发症状的患者少[21]。本研究结果也发现,AR-PD组中认知功能下降患者所占比例显著高于TD-PD组。而PGC-1α rs2946385基因多态性与PD及AR-PD和TD-PD 2种亚型组受试者是否合并认知功能下降无关,PGC-1α rs2946385位点突变不是PD并发认知功能下降的危险因素。国外有研究报道,TD-PD亚型PD患者合并抑郁的发病率随病情进展而降低[22]。本研究未观察到该现象,TD-PD组与AR-PD组中合并抑郁患者的比例比较差异无统计学意义,这可能与样本量、地区差异、受教育程度等多种因素有关。
综上所述,AR-PD型患者的认知功能下降较TD-PD型患者更明显。UPDRSⅢ评分越高,AR-PD型患者合并焦虑的风险越大。尽管在本研究中并未发现PGC-1α rs2946385基因多态性与PD、TD-PD型、AR-PD型患者焦虑、认知功能下降的发生存在相关性,但该研究结果是中国PD人群遗传学的重要补充。PGC-1α rs2946385基因多态性与PD的相关性尚需多中心、大样本研究来验证。

