沉默信号调节蛋白6在溃疡性结肠炎小鼠结肠组织中的表达及意义
于佳卉,毛光兰,王庆志,熊熙文
(1.新乡医学院法医学院,河南 新乡 453003;2.新乡医学院第三附属医院康复科,河南 新乡 453003)
溃疡性结肠炎(ulcerative colitis,UC)是由遗传易感性、免疫及环境因素引起的一种累及直肠、结肠的特发性肠道炎症性疾病,可对共生菌群与肠黏膜的相互作用产生负面影响[1-3]。葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)作为诱导小鼠UC模型的常用化学试剂,通过饮用水将DSS以口服方式给予小鼠,可导致以体质量减轻、血性腹泻、溃疡形成、上皮细胞丧失和嗜中性粒细胞浸润为特征的严重结肠炎。目前对UC发病机制的研究仍然有限。沉默信号调节蛋白(silent information regulator,SIRT)是一类烟酰胺腺嘌呤二核苷酸依赖的蛋白去乙酰化酶,参与机体的抗应激和代谢稳态等生理过程。在哺乳动物中,SIRT家族包括7个成员(SIRT1~7)[4]。SIRT6可以通过对组蛋白及非组蛋白的去乙酰化作用而调控基因转录和蛋白功能,参与调节体内多种重要病理生理学过程,如糖代谢平衡、衰老、肿瘤和炎症等[5-7]。有研究认为,SIRT6在肠道上皮细胞中的表达是保护肠道黏膜免受损伤的必要条件,在维持肠道上皮细胞对损伤的抵抗中发挥重要作用[8]。基于此,本研究通过观察DSS诱导UC小鼠结肠组织中SIRT6及巨噬细胞标志抗体F4/80、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis facto-α,TNF-α)mRNA 表达,探讨SIRT6在UC发生发展中的作用,为UC发病机制的研究和靶基因治疗提供理论依据。
1 材料与方法
1.1 实验动物14日龄C57BL6/J野生型(wild type,WT)小鼠22只和清洁级无病原体SIRT6IKO小鼠13只,雌雄不限,均由新乡代谢与整合生理学重点实验室提供,在12 h/12 h光照循环、室温20~22 ℃下饲养,自由摄食和饮水。实验动物操作均按照河南省实验动物伦理指导方针进行,并经新乡医学院动物使用与伦理委员会批准。
1.2 主要试剂与仪器DSS购自美国MP Biomedicals公司,二硫苏糖醇(dithiothreitol,DTT)、羟乙基哌嗪乙磺酸(hydroxyethylpiperazine ethane sulfonic acid,Hepes)购自上海生工生物工程股份有限公司,苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)购自上海阿拉丁生化科技股份有限公司,彩虹预染蛋白分子量Marker购自美国Thermo公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒购自江苏新赛美生物科技有限公司,增强型化学发光液(enhanced chemiluminescence liquid,ECL)购自上海碧云天生物科技公司,蛋白酶抑制剂购自德国罗氏有限公司,苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自北京索莱宝生物科技有限公司,免疫组织化学试剂盒购自北京中山金桥生物技术有限公司,硝酸纤维素(nitrocellulose,NC)膜购自美国Santa Cruz Biotechno-longy公司,兔抗人F4/80抗体购自美国Cell signaling technology公司,兔抗人SIRT6抗体和兔抗人actinin抗体购自美国Abcam公司;蛋白电泳槽和转膜槽购自美国Bio-Rad公司,常规切片机购自德国徕卡公司。
1.3 实验方法
1.3.1 动物分组及模型制备将小鼠分为SIRT6IKO对照组(n=3)、WT对照组(n=6)、SIRT6IKO-DSS组(n=10)和WT-DSS组(n=16)。WT-DSS组和SIRT6IKO-DSS组小鼠喂养含 25 g·L-1DSS的饮用水制备UC模型(每日5 mL,连续7 d,更换正常饮用水喂养14 d,以此为1个循环,共3个循环),大鼠出现稀便、大便脓血(肉眼血便或大便隐血阴性)等指征为造模成功。WT对照组和SIRT6IKO对照组小鼠每日饮用正常饮用水。
1.3.2 UC小鼠疾病活动度指数(disease activity index,DAI)评分WT-DSS组和SIRT6IKO-DSS组小鼠每天称体质量并计算体质量下降率,观察小鼠大便性状和血便情况。在造模第3个循环末根据小鼠体质量下降率、大便性状和血便评分计算DAI。体质量下降率=[(体质量-基准体质量)/基准体质量]×100%,体质量下降率评分:体质量下降率0%为0分,0%<体质量下降率≤5%为1分,5%<体质量下降率≤10%为2分,10%<体质量下降率≤15%为3分,>15%为4分。大便性状评分:正常为0分,松散大便为2分,腹泻为4分。血便评分:正常为0分,隐血阳性为2分,肉眼血便为4分。根据体质量下降率、大便性状、血便3项指标的得分计算小鼠DAI,DAI=(体质量下降率评分+大便性状评分+血便评分)/3[9],DAI越高表示UC越重。
1.3.3 结肠组织取材各组小鼠于第3个循环结束时采用颈椎脱臼法处死,无菌操作下迅速解剖小鼠,收集新鲜结肠组织置于液氮中,-80 ℃冰箱保存备用。
1.3.4 Western blot检测小鼠结肠组织中SIRT6蛋白相对表达量取WT对照组、SIRT6IKO对照组和WT-DSS组每只小鼠50 mg新鲜结肠组织加入适量的组织蛋白裂解液,加入体积分数1%蛋白酶抑制剂和体积分数1% PMSF(100 mmol·L-1),冰浴条件下使用组织匀浆器充分匀浆,4 ℃下12 000×g离心15 min,取上清液,采用BCA蛋白浓度测定试剂盒测定提取的组织蛋白浓度,样品浓度测定后,所有样品取相同质量移至新的离心管中,用PBS补足至相同的体积,加入1/4样本体积的5×loading buffer,充分混匀后放置金属浴中加热,100 ℃变性5 min。SDS-聚丙烯酰胺凝胶电泳和NC转膜后,脱脂牛奶封闭1 h;加入SIRT6一抗(稀释度为11 000)、内参actinin一抗(稀释倍数15 000),4 ℃摇床孵育过夜;滴加辣根过氧化物酶标记的山羊抗兔二抗(稀释比例为15 000),室温二抗孵育1 h。ECL发光、压片、显影,应用化学发光成像系统进行图像采集,Image J软件分析目的蛋白条带和内参条带的灰度值,以目的蛋白条带和内参条带的灰度值比值表示目的蛋白相对表达量。
1.3.5 WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织形态学观察取新鲜结肠组织于40 g·L-1多聚甲醛中固定,48 h后脱水、透明,浸蜡后包埋成蜡块,5.0 μm常规切片,进行HE染色,显微镜下观察。应用组织学损伤指数[9]评估小鼠结肠组织学形态学变化,黏膜损伤程度评分:结肠黏膜正常为0分,隐窝腺体丢失1/3为1分,隐窝腺体丢失2/3为2分,隐窝腺体全部丢失为3分,黏膜上皮糜烂、破坏、伴有明显的炎症细胞浸润为4分;黏膜损伤范围评分:结肠黏膜正常为0分,局部黏膜损伤为1分,损伤累及1/3肠道为2分,损伤累及2/3肠道为3分,损伤累及整个肠道为4分;组织学损伤指数=(黏膜损伤程度评分+范围积分评分)/2[9],组织学损伤指数越高,表示结肠黏膜损伤越重。
1.3.6 免疫组织化学染色法检测结肠组织中F4/80的表达取WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织切片进行脱蜡、水化处理后,磷酸盐缓冲液(phosphate buffered solation,PBS)洗涤3次,每次5 min,置于95 ℃、0.01 mol·L-1枸橼酸钠缓冲液(pH 6.0)中5 min进行抗原修复,快速冷却至室温,PBS洗涤3次,用体积分数3%过氧化氢阻断 20 min,PBS洗涤后,置于体积分数5%山羊血清中室温放置1 h。滴加F4/80一抗(稀释度为1800),4 ℃孵育过夜;滴加HRP标记的山羊抗兔二抗(稀释比例为1200),室温孵育1 h,DAB显色 5 min,脱水、封片,应用光学显微镜观察,使用Image J软件分析阳性结果。F4/80阳性结果评分标准:阳性细胞数<5%为0分;5%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。
1.3.7 结肠组织总RNA的提取按照RNAiso Plus试剂盒说明书提取结肠组织的总RNA,称量100 mg 结肠组织,加入1 mL RNAiso Plus后使用电动研磨器充分匀浆,加入200 μL氯仿震荡混匀,室温静置2 min。4 ℃下12 000×g离心15 min,取上清移至新的1.5 mL离心管中,加入500 μL异丙醇混匀沉淀RNA,室温静置20 min,4 ℃下12 000×g离心15 min,使用1 mL体积分数75%乙醇清洗沉淀,4 ℃下12 000×g离心5 min,弃上清液。空气干燥RNA沉淀,并迅速将其溶解于适量的焦碳酸二乙酯处理的灭菌蒸馏水中,使用酶标仪测定RNA浓度,用紫外分光光度计测定其纯度。总RNA置于-80 ℃冰箱中备用。
1.3.8 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)检测结肠组织中IL-6、TNF-α mRNA的表达将提取的结肠组织总RNA反转录为cDNA;根据qRT-PCR试剂盒说明书进行IL-6、TNF-α mRNA检测。反应体系20 μL:灭菌水6 μL,2×SYBR Premix Ex Taq Ⅱ10 μL,上游引物0.8 μL,下游引物0.8 μL,Rox Reference Dye 0.4 μL,cDNA 2 μL。IL-6的上游引物序列为5′-GAGGATACCACTCCCAACAGACC-3′,下游引物序列为5′-AAGTGCATCATCGTTGTTCATACA-3′;TNF-α的上游引物序列为5′-GGGACAGTGACCTGGACTGT-3′,下游引物序列为5′-AGGCTGTGCATTGCACCTCA-3′;内参36B4 的上游引物序列为5′-AGATGCAGCAGATCCGCAT-3′,下游引物序列为5′-GTTCTTGCCCATCAGCACC-3′。采用2-△△Ct法计算目的基因在结肠组织中的相对表达量,实验重复3次,取均值。

2 结果
2.1 WT-DSS组和SIRT6IKO-DSS组小鼠体质量、DAI评分比较结果见表1。第3个循环末,WT-DSS组和SIRT6IKO-DSS组小鼠体质量均显著低于第1、2个循环末,差异有统计学意义(P<0.05);2组小鼠第1循环末与第2个循环末体质量比较差异无统计学意义(P>0.05);第1、2个循环末,SIRT6IKO-DSS组与WT-DSS组小鼠体质量比较差异无统计学意义(P>0.05);第3个循环末,SIRT6IKO-DSS组小鼠体质量显著低于WT-DSS组,差异有统计学意义(P<0.05)。第3个循环末,WT-DSS组和SIRT6IKO-DSS组小鼠DAI评分均显著高于第1、2个循环末,差异有统计学意义(P<0.05);WT-DSS组第2个循环末小鼠DAI评分与第1个循环末比较差异无统计学意义(P>0.05);第2个循环末,SIRT6IKO-DSS组DAI评分显著高于第1个循环末,差异有统计学意义(P<0.05);第2、3个循环末,SIRT6IKO-DSS组小鼠DAI评分显著高于WT-DSS组,差异有统计学意义(P<0.05)。
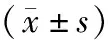
表1 WT-DSS组和SIRT6IKO-DSS组小鼠体质量、DAI评分比较
2.2 WT对照组及SIRT6IKO对照组小鼠结肠组织中SIRT6蛋白相对表达量比较结果见图1。WT对照组和SIRT6IKO对照组小鼠结肠组织中SIRT6蛋白相对表达量分别为0.64±0.01、0.19±0.01;SIRT6IKO对照组小鼠结肠组织中SIRT6蛋白相对表达量低于WT对照组,差异有统计学意义(P<0.05)。
A:WT对照组;B:SIRT6IKO对照组。
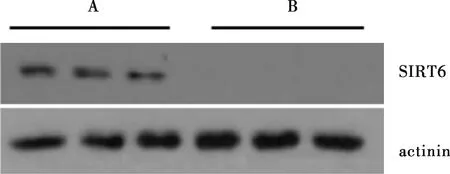
2.3 WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织病理学变化结果见图2。WT-DSS组小鼠和SIRT6IKO-DSS组小鼠结肠组织学损伤指数分别为(1.20±0.29)、(2.30±0.21)分,SIRT6IKO-DSS组小鼠结肠组织组织学损伤指数显著高于WT-DSS组,差异有统计学意义(P<0.05)。
A:WT-DSS组;B:SIRT6IKO-DSS组。
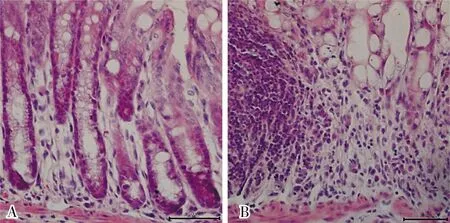
2.4 WT对照组和WT-DSS组小鼠结肠组织中SIRT6蛋白表达比较结果见图3。WT对照组和WT-DSS组小鼠结肠组织中SIRT6蛋白相对表达量分别为2.14±0.14、1.12±0.07,WT对照组小鼠结肠组织中SIRT6蛋白相对表达量显著高于WT-DSS组,差异有统计学意义(P<0.05)。
A:WT对照组;B:WT-DSS组。
2.5 WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织中F4/80表达结果见图4。WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织中F4/80阳性表达评分分别为(0.39±0.14)、(2.00±0.14)分,SIRT6IKO-DSS组小鼠结肠组织F4/80阳性表达评分显著高于WT-DSS组,差异有统计学意义(P<0.05)。

A:WT-DSS组;B:SIRT6IKO-DSS组。
2.6 WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织中IL-6、TNF-α mRNA相对表达量比较WT-DSS组和SIRT6IKO-DSS组小鼠结肠组织中IL-6 mRNA的相对表达量分别为0.66±0.08、2.08±0.23,TNF-α mRNA的相对表达量分别为0.76±0.12、1.45±0.10;SIRT6IKO-DSS组小鼠结肠组织中IL-6、TNF-α mRNA相对表达量显著高于WT-DSS组,差异有统计学意义(P<0.05)。
3 讨论
UC是以腹泻、腹痛、血便为主要临床症状的一种非特异性慢性炎症性肠道疾病。在西方,UC的发病率可高达 6/100 000~15/100 000,多数集中在年轻人群[9];近年来,UC的发病率和患病率在亚洲、非洲和东欧等发展中地区也逐渐增高[10]。UC病程反复,临床治疗效果不理想,患者预后较差,病程可多达几十年甚至伴随终生,严重影响患者的生活质量,缩短患者寿命。UC的发病因素涉及环境、遗传、肠道微生物、免疫因素等多个方面[10-13],研究UC的发病机制对于其防治有重要意义。啮齿类动物的肠道炎症模型对于研究UC的病理机制有重要价值,化学物质诱导的动物结肠炎模型在UC的研究中得到广泛应用。DSS诱导的结肠炎的临床症状(如便血、腹泻和体质量)、肠道病理(如上皮侵蚀、黏蛋白和杯状细胞耗竭、溃疡)以及行为改变(如记忆缺失)等特征与人类UC相似[14],而且重复周期的低浓度DSS可用于诱导慢性复发性炎症性肠病的循环模型。因此,本研究选择DSS诱导的UC小鼠模型作为研究对象。
SIRT6蛋白主要定位于细胞核,同时拥有 ADP-核糖基转移酶和去乙酰化酶活性,SIRT6是基因组稳定性、葡萄糖稳态、代谢和炎症的关键调控因子,参与转录、端粒完整性和DNA修复等多种细胞功能的调控[15],与炎症反应和糖尿病、肥胖等多种代谢相关的疾病有关[16]。研究报道,SIRT6在肠道上皮细胞中的表达是保护肠道黏膜免受损伤的必要条件,在维持肠道上皮细胞对损伤的抵抗中发挥重要作用[8]。小鼠肠道上皮SIRT6缺失在正常情况下对肠道形态无明显影响,肠道上皮细胞中的SIRT6并不是正常生理状态下肠道发育和稳态所必需的蛋白;但SIRT6的表达在病理条件下可受到抑制,例如,过氧化氢处理可显著降低内皮细胞中的SIRT6[17]。本研究结果显示,WT-DSS组小鼠结肠组织中SIRT6蛋白相对表达量显著低于WT对照组,说明DSS处理可降低小鼠结肠组织中SIRT6 mRNA的表达,UC与肠道SIRT6水平下降有关,推测SIRT6可能参与DSS诱导的UC的发生过程。有研究报道,在断奶的SIRT6缺失小鼠中存在一种具有上皮脱落的独特的结肠炎表型[18]。为进一步研究SIRT6在UC发病机制中的作用,本研究选择SIRT6IKO小鼠作为研究对象,基因敲除效率检测结果表明,SIRT6IKO对照组小鼠结肠组织中SIRT6蛋白相对表达量低于WT对照组,证实敲除SIRT6基因的SIRT6IKO小鼠结肠组织中SIRT6蛋白呈低表达,可以用于研究SIRT6在UC发病机制中的作用。本研究结果显示,在DSS处理的第3个循环末,SIRT6IKO-DSS组小鼠体质量显著低于WT-DSS组;第2、3个循环末,SIRT6IKO-DSS组小鼠DAI评分显著高于WT-DSS组;SIRT6IKO-DSS组小鼠结肠组织组织学损伤指数显著低于WT-DSS组。这一结果说明,肠道上皮细胞中SIRT6的缺失会加重DSS诱导的结肠组织损伤,增加疾病的严重程度,这有力地支持了炎症诱导的肠道上皮组织中SIRT6表达下调在结肠炎发展过程中直接影响了肠黏膜完整性的观点,进一步证实SIRT6参与了DSS诱导的UC的发生发展过程。
SIRT6通过哪些机制参与UC的发生发展过程目前尚不太清楚。肠道上皮细胞(intestinal epithelial cells,IECs)是主要的物理屏障,可阻止致病抗原与肠道免疫细胞过度接触,从而保护机体免受不必要的免疫反应[19]。研究表明,上皮屏障的破坏和随后的细菌移位是肠道炎症的初始阶段。IECs在慢性炎症环境中凋亡显著增加,形成屏障的紧密连接蛋白表达降低,使其不能形成功能上皮单层发挥物理屏障功能,而IECs屏障的破坏是UC发病的关键过程[20]。TNF-α和干扰素-γ等促炎症细胞因子可加重炎症性肠病,促进上皮细胞凋亡,降低上皮紧密连接蛋白的表达,进而导致肠道上皮屏障功能破坏。在病理生理过程中,巨噬细胞在有害成分如甲醛及其他一些氧化产物刺激下,可释放TNF-α、IL-8、IL-6等多种细胞因子参与组织的炎症反应[21]。肠道巨噬细胞通过对肠道微生物刺激的不恰当反应、对宿主组织中微生物的低效清除以及从适当的促炎反应向抗炎反应的转变受损等途径参与炎症性肠病的形成[22]。有研究表明,IFN-α等炎症介质和活性氧可直接抑制SIRT6在肠道上皮细胞中的表达[23];环氧合酶-1/前列腺素E2(prostaglandin E2,PGE2)是UC的重要保护介质,PGE2可减轻结肠炎黏膜损伤[24];SIRT6通过定位在核转录因子κB(nuclear transcription factor κB,NF-κB)基因的启动子,脱去乙酰基H3K9Ac,使NF-κB基因沉默,从而降低NF-kB的活性[25]。因此,推测SIRT6可能通过一种细胞因子相关机制保护肠上皮细胞免受炎症损伤。本研究结果显示,SIRT6IKO-DSS组小鼠结肠组织中F4/80表达明显高于WT-DSS组,SIRT6IKO-DSS组小鼠结肠组织中IL-6、TNF-α mRNA相对表达量显著高于WT-DSS组,F4/80是巨噬细胞的特异性标志物,说明结肠上皮细胞SIRT6的缺失显著促进了结肠组织巨噬细胞的浸润,使IL-6、TNF-α等促炎症因子水平明显升高,从而增加了UC的易感性,加重了结肠组织的炎症反应和损伤。
综上所述,本研究初步证实,UC小鼠结肠组织中SIRT6呈低表达,而结肠上皮细胞SIRT6的缺失显著促进了巨噬细胞的浸润,使IL-6、TNF-α等促炎症因子水平明显升高,从而增加了UC的易感性,加重了结肠组织的炎症反应和损伤,这为UC发病机制的研究和潜在治疗靶点提供了新的实验依据。

