丙泊酚对卵巢癌SKOV3细胞迁移和侵袭能力的影响
李燕乐,柏效治,谢小娟
(河南科技大学临床医学院 河南科技大学第一附属医院麻醉科,河南 洛阳 471003)
卵巢癌是仅次于子宫内膜癌的第二大妇科肿瘤,其在女性生殖系统肿瘤中死亡率居于首位,晚期卵巢癌的5 a生存率仅为20%~30%[1-2]。目前,外科手术仍是治疗卵巢癌的主要方法,而麻醉作为肿瘤手术治疗的关键环节,与卵巢癌的关系却常被忽视。临床研究显示,无论是早期、晚期或高龄卵巢癌患者,都应当首选手术治疗[3]。因此,合理的围术期抗肿瘤措施成为提高卵巢癌患者生存率的一个重要环节。丙泊酚是烷基酚类短效静脉麻醉药,广泛用于麻醉诱导、麻醉维持及重症监护病房的静脉镇静[4]。有研究显示,除了麻醉作用外,丙泊酚还可影响肿瘤的生物学行为,而且在不同肿瘤中,丙泊酚的作用机制也各有不同[5-9]。卵巢癌的发生、发展与细胞外信号调节激酶(extracellular-signal regulated kinase,ERK)1/2、基质金属蛋白酶(matrix metalloproteinase,MMP)等多种肿瘤蛋白标志物的异常表达密切相关,基于此,本研究通过观察丙泊酚对卵巢癌SKOV3细胞中ERK1/2-MMP-2/9信号通路调控的影响来探讨丙泊酚对卵巢癌细胞迁移和侵袭能力的影响。
1 材料与方法
1.1 细胞、试剂与仪器人卵巢癌细胞株SKOV3购自中国科学院上海细胞库,达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胰蛋白酶、青链霉素购自美国Gibco公司,胎牛血清(fetal bovine serum,FBS)购自以色列BI公司,丙泊酚购自英国Astra Zeneca公司,脂肪乳购自北京费森尤斯公司,慢病毒包装试剂盒购自美国Gene Copeia公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本同仁化学研究所,Transwell小室购自康宁(上海)管理有限公司,Matrigel胶购购自美国BD公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自美国Pierce公司,MMP-2、MMP-9、ERK1/2一抗购自上海艾博抗贸易有限公司,牛血清白蛋白(bovine standard albumin,BSA)标准品、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、山羊抗兔多克隆抗体购自上海康为医疗科技发展有限公司,电化学发光(electrochemiluminescence,ECL)显影试剂盒购自美国Invitrogen公司;凝胶成像系统购自美国Bio-Rad公司,光学显微镜购自日本Nikon公司。
1.2 方法
1.2.1 细胞培养及分组将SKOV3细胞接种于含体积分数10% FBS和青链霉素双抗(青霉素100 U·mL-1,链霉素0.1 g·L-1)的DMEM培养基,置于37 ℃、含体积分数5%CO2细胞培养箱中培养。取对数生长期细胞随机分为空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组、50 μmol·L-1丙泊酚组和100 μmol·L-1丙泊酚组。空白对照组细胞给予正常培养基培养,溶剂对照组细胞给予与100 μmol·L-1丙泊酚组中丙泊酚等量的脂肪乳处理;25 μmol·L-1丙泊酚组、50 μmol·L-1丙泊酚组、100 μmol·L-1丙泊酚组细胞分别给予含25、50、100 μmol·L-1丙泊酚的培养基培养。
1.2.2 划痕实验观察细胞迁移能力在6孔板上画出数条平行横线做标记。以每孔1×105个细胞加入6孔板,每组设3个复孔。添加2 mL完全培养基至各孔,反复吹打后,置于37 ℃、含体积分数5% CO2培养箱中过夜(10~12 h)。次日吸弃培养基后,用200 μL枪头与画好的标记线及6孔板底面垂直,进行划痕操作。划痕结束后磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤细胞3次,清除划痕后的死细胞,然后加入2 mL无血清培养基,置于培养箱中继续培养。24 h后取样并进行拍照,计算细胞迁移率以观察细胞迁移能力。实验重复3次,取均值。通过测量5组细胞在0、24 h时的划痕宽度,计算出各组细胞的迁移率,细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.3 Transwell侵袭实验观察细胞侵袭能力取对数生长期SKOV3细胞,PBS清洗,加入胰蛋白酶消化,1 000 r·min-1离心5 min,弃上清,加入1 mL DMEM培养基重悬,使用细胞计数板在显微镜下计数,计数后使用DMEM培养基将细胞悬液稀释至1×108L-1备用。将Matrigel胶提前放入4 ℃冰箱过夜,融化为液体状态后备用,用PBS按照18稀释,取35 μL稀释后的Matrigel胶均匀加入Transwell小室底部的薄膜上,常温放置1~2 h。按照前述分组在Transwell小室上做好标记。在标记好的小室中分别加入200 μL不用药物处理的细胞悬液(1×108L-1),下室中加入含有体积分数10%胎牛血清的DMEM培养基,置于37 ℃、含体积分数5%CO2的细胞培养箱中培养24 h,PBS洗膜,体积分数4%甲醛室温固定2 h,4 g·L-1结晶紫染色30 min,洗涤后擦去膜内层细胞,显微镜下拍照,每个小室随机取6个不同的视野,观察并记录穿膜细胞数。实验重复3次,取均值。
1.2.4 Western blot法检测5组SKOV3细胞中MMP-2、MMP-9、ERK1/2蛋白的相对表达量取5组培养72 h后的细胞,PBS清洗,加入蛋白裂解液(可溶性蛋白苯甲基磺酰氟:蛋白酶抑制剂=5 000501),刮匙刮下蛋白,冰上裂解1~2 h,期间间断吹打震荡。4 ℃、12 000 r·min-1离心30 min,收集上清,使用BCA试剂盒进行蛋白定量。将蛋白加入含有质量分数10%十二烷基硫酸钠的聚丙烯酰胺凝胶进行电泳,每孔蛋白上样量为50 μg,电泳后,在80 V电压下转膜150 min,50 g·L-1脱脂奶粉封闭聚偏二氟乙烯膜1 h,PBS洗膜3次,分别加入MMP-2、MMP-9、ERK1/2一抗(均按11 000稀释),置于60 r·min-1摇床 4 ℃过夜。免疫蛋白印记实验电泳缓冲液洗涤3次,每次5 min,并加入11 000 IgG-辣根过氧化物酶标记的山羊抗兔二抗,室温孵育2 h,ECL法检测MMP-2、MMP-9的表达量,以β-actin为内参计算转染前SKOV3 细胞中ERK1/2、MMP-2、MMP-9蛋白的相对表达量,以GAPDH为内参计算ERK siRNA转染后SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白的相对表达量。
1.2.5 细胞外调节蛋白激酶的小干扰RNA(extracellular-signal regulated kinase small interfering RNA,ERK siRNA)转染SKOV3细胞将SKOV3细胞接种于6孔细胞培养板中,每孔3×106个细胞,然后置于37 ℃、含体积分数5% CO2的细胞培养箱中孵育24 h,待细胞生长面积达到孔底面积的80%~90%时,将对照组siRNA及ERK siRNA 与相应比例脂质体分别稀释于DMEM中,把脂质体稀释液滴加入siRNA稀释液中充分混匀,获得脂质体/DNA复合物。每孔加入该复合物300 μL,轻轻混匀。将细胞分为空白对照组、对照siRNA组和ERK siRNA组,空白对照组细胞加入300 μL DMEM培养基,对照siRNA组细胞加入对照siRNA脂质体复合物300 μL,ERK siRNA组细胞加入ERK siRNA脂质体复合物300 μL。继续培养48 h后,使用Western blot法测定ERK1/2的含量用以鉴定转染效率。
1.2.6 丙泊酚对ERK siRNA转染的SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白表达的影响将ERK siRNA转染的SKOV3细胞分为空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组、50 μmol·L-1丙泊酚组、100 μmol·L-1丙泊酚组。空白对照组细胞细胞给予正常培养基培养,溶剂对照组细胞给予与100 μmol·L-1丙泊酚组中丙泊酚等量的脂肪乳处理,25 μmol·L-1丙泊酚组、50 μmol·L-1丙泊酚组、100 μmol·L-1丙泊酚组细胞分别给予含有25、50、100 μmol·L-1丙泊酚的培养基培养。24 h后提取细胞蛋白,使用Western blot法检测各组转染ERK siRNA的SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白的相对表达量,具体方法同“1.2.4”项。

2 结果
2.1 不同浓度丙泊酚对SKOV3细胞迁移和侵袭能力的影响结果见表1和图1、图2。空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组细胞迁移率比较差异均无统计学意义(P>0.05);50 μmol·L-1丙泊酚组、100 μmol·L-1丙泊酚组细胞迁移率显著高于空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组,差异均有统计学意义(P<0.05);50 μmol·L-1丙泊酚组与100 μmol·L-1丙泊酚组细胞迁移率比较差异无统计学意义(P>0.05)。

A:空白对照组;B:溶剂对照组;C:25 μmol·L-1丙泊酚组;D:50 μmol·L-1丙泊酚组;E:100 μmol·L-1丙泊酚组。
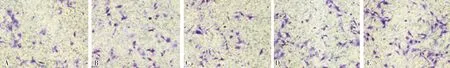
A:空白对照组;B:溶剂对照组;C:25 μmol·L-1丙泊酚组;D:50 μmol·L-1丙泊酚组;E:100 μmol·L-1丙泊酚组。
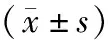
表1 5组SKOV3细胞迁移和侵袭能力比较
空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组细胞侵袭能力比较差异均无统计学意义(P>0.05);50 μmol·L-1丙泊酚组、100 μmol·L-1丙泊酚组细胞侵袭能力显著高于空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组,差异均有统计学意义(P<0.05);100 μmol·L-1丙泊酚组细胞侵袭能力高于50 μmol·L-1丙泊酚组,差异有统计学意义(P<0.05)。
2.2 各组SKOV3细胞中ERK1/2、MMP-2、MMP-9 蛋白相对表达量比较结果见表2和图3。空白对照组、溶剂对照组、25 μmol·L-1丙泊酚组SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白相对表达量比较差异无统计学意义(P>0.05)。50 μmol·L-1丙泊酚组和100 μmol·L-1丙泊酚组SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白相对表达量均显著高于空白对照组、溶剂对照组和25 μmol·L-1丙泊酚组,差异有统计学意义(P<0.05);100 μmol·L-1丙泊酚组SKOV3 组织中ERK1/2蛋白相对表达量显著高于 50 μmol·L-1丙泊酚组,差异有统计学意义(P<0.05);100 μmol·L-1丙泊酚组与50 μmol·L-1丙泊酚组SKOV3细胞中MMP-2、MMP-9蛋白相对表达量比较差异无统计学意义(P>0.05)。
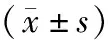
表2 5组SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白相对表达比较
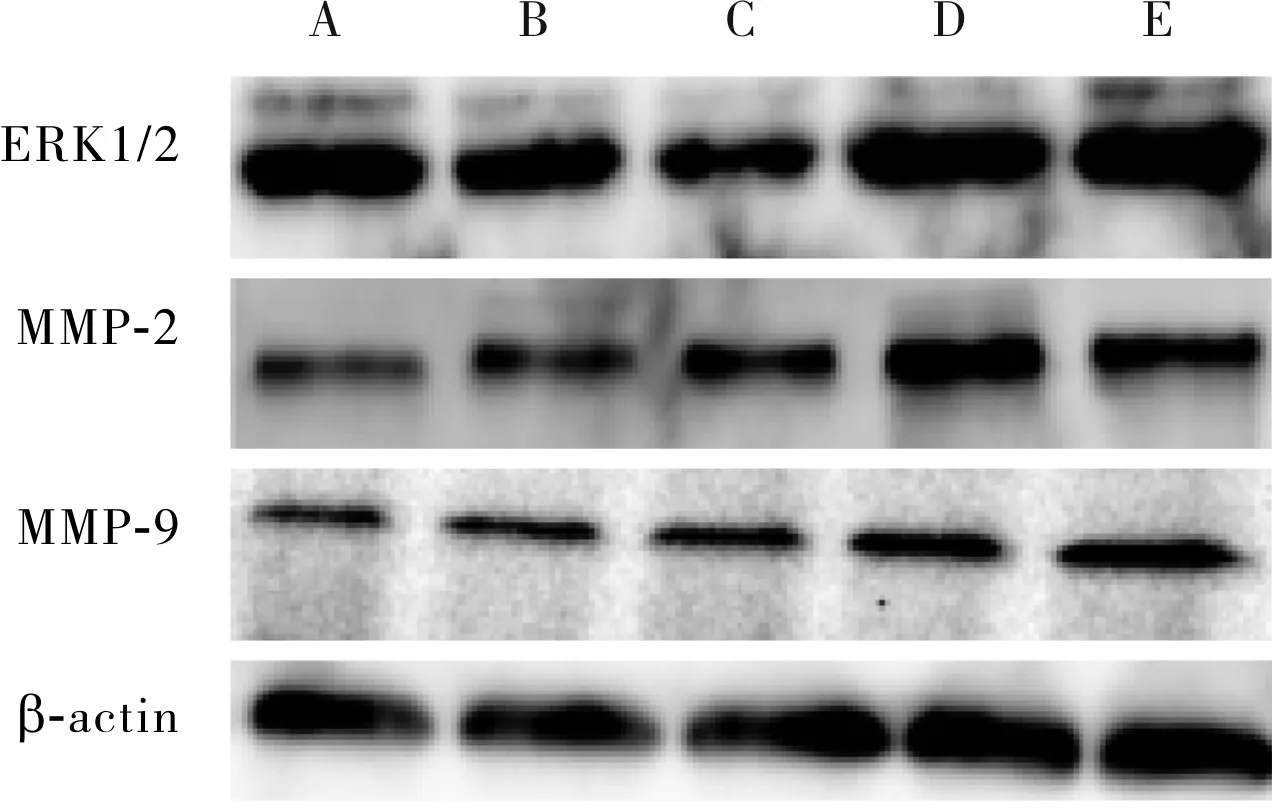
A:空白对照组;B:溶剂对照组;C:25 μmol·L-1丙泊酚组;D:50 μmol·L-1丙泊酚组;E:100 μmol·L-1丙泊酚组。
2.3 ERK siRNA干扰对SKOV3细胞中ERK1/2、MMP-2、MMP-9蛋白表达的影响结果见表3、图4和图5。空白对照组、对照siRNA组、ERK-siRNA组SKOV3细胞中ERK1/2蛋白的相对表达量分别为0.423±0.071、0.459±0.103、0.290±0.232,ERK siRNA组SKOV3细胞中ERK1/2蛋白的相对表达量显著低于空白对照组和对照siRNA组,差异有统计学意义(P<0.05)。

图4 转染ERK siRNA的SKOV3细胞中ERK1/2蛋白表达

A:空白对照组;B:溶剂对照组;C:25 μmol·L-1丙泊酚组;D:50 μmol·L-1丙泊酚组;E:100 μmol·L-1丙泊酚组。
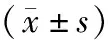
表3 5组转染ERK siRNA的SKOV3细胞中MMP-2、MMP-9蛋白相对表达量比较
5组转染ERK siRNA的SKOV3细胞中MMP-2、MMP-9蛋白的相对表达量比较差异无统计学意义(P>0.05)。
3 讨论
手术是治疗肿瘤的一种重要方法,麻醉为手术患者提供无痛、舒适、安全的手术条件[10],因此,围手术期麻醉处理对肿瘤患者预后具有重要的意义。目前,转移和复发被认为是肿瘤患者死亡的主要原因。肿瘤患者接受手术时,麻醉方法的选择、麻醉药物及非麻醉药物的应用、术后镇痛等因素均可能引起机体创伤性应激、免疫调控及内环境的改变,导致肿瘤微环境发生改变,从而引起肿瘤的复发、转移,甚至其他严重的并发症[11]。近年来麻醉与肿瘤的关系得到了广泛关注[12-13],其研究主要集中在麻醉药物基础研究,而丙泊酚作为应用最广泛的静脉麻醉药,成为这一领域主要的研究对象。卵巢癌患者病死率高、存活率低的根本原因是肿瘤细胞的侵袭和迁移能力高[14]。目前,丙泊酚与卵巢肿瘤生物学行为的相关研究鲜有报道,本研究采用体外培养卵巢癌细胞的方法,观察丙泊酚对卵巢癌细胞SKOV3迁移和侵袭能力的影响,结果显示,丙泊酚在体外可促进卵巢癌细胞SKOV3的迁移和侵袭,且该种影响与丙泊酚的药物浓度有一定相关性。YANG 等[15]研究发现,卵巢癌组织中ERK1/2 蛋白表达明显高于卵巢良性肿瘤,该结果对于卵巢癌的诊断、恶性程度的判断及卵巢肿瘤的分子多通路靶向治疗有重大意义。MMPx是一类锌离子依赖型蛋白水解酶,由结缔组织细胞分泌,并参与细胞外基质(extracellular matrixc,ECM)的降解,继而影响肿瘤细胞的迁移、侵袭等重要环节[16]。MMP-2、MMP-9的异常表达与多种肿瘤发病有关,在乳腺癌、肺癌、子宫内膜癌、膀胱癌及卵巢癌组织中均能检测到MMP-2和MMP-9,是肿瘤领域研究的热点[17-18]。丙泊酚对SKOV3细胞生物学活性的影响与ERK1/2、MMP-2、MMP-9表达量变化有关,且丙泊酚浓度越高,ERK1/2、MMP-2、MMP-9蛋白的表达量越高[19],这与本研究中各组细胞迁移、侵袭能力的结果存在一致性。
卵巢癌病死率极高,易发生扩散和转移,ERK1/2能够参与卵巢组织病理生理条件下的细胞分化、迁移、组织重建及ECM降解、血管形成等过程。本研究发现,ERK1/2信号通路与卵巢癌的发生密切相关。对照siRNA处理的细胞中MMP-2、MMP-9蛋白相对表达量与未处理的细胞无差异;丙泊酚可明显升高SKOV3细胞中ERK1/2、MMP-2、MMP-9的表达,且呈浓度依赖性,提示丙泊酚促进SKOV3细胞表达MMP-2、MMP-9可能是通过上调ERK实现的。本研究还发现,ERK siRNA处理各组细胞后,ERK1/2-MMP-2/9信号通路被抑制。进一步研究丙泊酚对SKOV3细胞生物活性影响的分子机制发现,SKOV3细胞经ERK siRNA处理后,ERK1/2表达明显降低,而丙泊酚不能有效上调SKOV3细胞表达MMP-2及 MMP-9。但ERK siRNA干预后,随着丙泊酚浓度的变化,各组细胞的生物学活性仍发生变化,说明ERK siRNA干预后丙泊酚对各组细胞的迁移、侵袭活性仍然存在影响。这一现象提示丙泊酚还能够通过分子通路对SKOV3细胞活性产生影响。但丙泊酚作为广泛应用的静脉麻醉药物,在临床中对卵巢癌患者的预后及生存率的影响仍需进一步研究论证。
综上所述,在体外,丙泊酚能够促进卵巢癌SKOV3细胞迁移和侵袭能力,这种作用可能与丙泊酚上调了卵巢癌SKOV3细胞中ERK蛋白的表达,进而上调下游MMP-2、MMP-9蛋白表达量有关。因此,推测丙泊酚是通过ERK-MMPx信号通路对卵巢癌细胞SKOV3的迁移和侵袭能力产生影响。

