尿液结合珠蛋白水平及其基因型对早期糖尿病肾病的诊断价值
宋欣 张永 张庆红 孟忠吉 胡雪梅
2型糖尿病(T2DM)患者中约34.7%发生糖尿病肾病(DKD)[1],据统计,40%~50%的终末期肾病(ESRD)是由DKD引起,DKD是糖尿病患者重要的死亡原因之一。目前DKD的诊断主要依靠临床诊断和病理诊断,肾活检的开展受到地区、经济、患者差异等情况的限制。尿白蛋白排泄率(UAER)或尿白蛋白/肌酐(UACR)是目前被广泛应用的DKD早期诊断指标,但白蛋白尿作为DKD诊断标志物的效能受到许多因素的限制[2]。相关研究表明,40%的1型糖尿病(T1DM)患者和30%的T2DM患者可出现尿蛋白的自发性消退,20%尿蛋白正常的T2DM患者表现出早期肾小球滤过率(GFR)进行性下降[3],特别是在药物干预的情况下,这种情况更为常见[4]。近年来,通过对DKD新型诊断标志物的探索发现,结合珠蛋白(Hp)水平及其基因型与DKD的发生发展相关[5-6]。本研究旨在探讨尿液Hp(uHp)对DKD的诊断价值及Hp基因多态性与DKD易感性之间的关系。
对象与方法
1.对象:2018年9月~2019年9月于十堰市太和医院就诊的T2DM患者(UAER<30 mg/24 h)29例(单纯T2DM组),年龄15~75岁。T2DM的诊断标准参考《中国糖尿病肾病防治指南(2019年版)》中T2DM的诊断标准。纳入同期于我院就诊的DKD患者61例,按照UAER水平将其分为早期DKD组(30 mg/24 h≤UAER<300 mg/24 h,33例)和临床DKD组(UAER≥300 mg/24 h,28例)。排除标准:T1DM、急慢性感染、严重心脑血管疾病、其他系统性或活动性疾病(如血液系统疾病、自身免疫性疾病、结缔组织病或恶性肿瘤等)、妊娠、精神异常、DKD以外的肾脏疾病患者。随机选取同期于我院体检的30例健康者为健康对照组。本研究通过十堰市太和医院伦理委员会审核批准(2020KS016),所有患者均知情同意。
2.方法
(1)一般资料收集:收集所有受试者的一般资料,包括性别、年龄、体重、吸烟史、收缩压及病例组患者的病程。
(2)实验室指标检测:所有受试者于清晨空腹取静脉血5 ml,分离血浆和血细胞,于-80 ℃冰箱冻存;取晨尿10 ml,于-80 ℃冰箱冻存。采用全自动生化分析仪检测所有受试者血尿素(Urea)、血肌酐(SCr)、糖化血红蛋白(HbA1c)、尿β2微球蛋白(β2-MG)、24小时尿蛋白排泄率(UAER),计算GFR。采用武汉云克隆公司的人结合珠蛋白试剂盒(SEA817Hu)检测uHp水平。
(3)Hp基因型测定:采用天根公司人血液基因组DNA提取试剂盒(DP318-02)提取血液基因组DNA,采用聚合酶链反应(PCR)检测Hp基因型。参考Koch等[7]的试验方法设计引物,用上游引物A(5’-GAGGGGAGCTTGCCTTTCCATTG-3’),下游引物B(5’-GAGATTTTTGAGCCCTGGCTGGT-3’)扩增1 757 bp的Hp1片段和3 481 bp的Hp2片段,用上游引C(5’-CCTGCCTCGTATTAACTGCACCAT-3’)和下游引物D(5’-CCGAGTGCTCCACATAGCCATGT-3’)扩增349 bp的Hp2片段。PCR反应体系为模板DNA 2 μl,dNTP,上下游引物各0.5 μl,加入ddH2O补足20 μl。反应条件为95 ℃预变性2 min;95 ℃变性1 min,62 ℃退火和延伸3 min,共35个循环;72 ℃终末延伸7 min。产物采用0.8%的琼脂糖凝胶电泳,经125 V电泳20 min,在紫外光下观察。

结 果
1.4组受试者一般资料和实验室检查结果比较:4组受试者性别、年龄、吸烟史、Urea比较差异均无统计学意义(P>0.05)。单纯糖尿病组、早期DKD组及临床DKD组患者的收缩压、HbA1c、尿液β2-MG、UAER、uHp水平均高于健康对照组,GFR水平低于健康对照组(P<0.05)。健康对照组、单纯T2DM组、早期DKD组及临床DKD组患者uHp水平依次升高,各组间比较差异均有统计学意义(P<0.05)。见表1。
2.各组HP基因型比较:共检测出Hp1-1、Hp1-2、Hp2-2 3种基因型(图1)。图1中条带1为DNA Marker 2 000 bp的电泳条带,条带2、3、4和条带5、6、7代表的样本呈一一对应关系。条带2、3、4为引物A和引物B扩增产物,其中1 757 bp的片段为含Hp1等位基因;条带5、6、7为引物A和引物B扩增产物,其中349bp的片段为含Hp2等位基因。条带2、5对应患者的基因型为Hp1-1,条带3、6和条带4、7分别对应患者的基因型为Hp1-2、Hp2-2。另外,还扩增出含750bp的片段,经查证为引物B单独扩增序列[8]。3种Hp基因型在各组频率见表2。3种基因型在4组受试者中的频率分布为Hp1-1基因型最少,Hp2-2基因型频率最高。Hp2-2基因型频率在对照组最低,在临床DKD组最高,但组间比较差异无统计学意义(P=0.525)。Hp1-1及Hp1-2基因型频率在在4组受试者中的分布无明显规律,组间比较差异无统计学意义(P=0.525)。
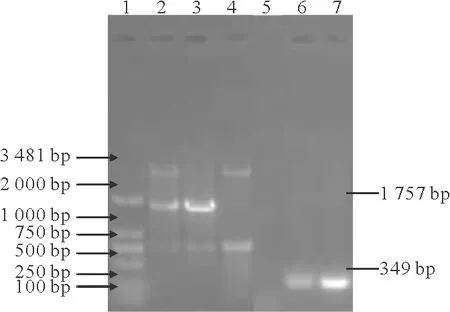
注:条带2、5为Hp1-1基因型,3、6为Hp1-2基因型,4、7为Hp2-2基因型,1为DNA Marker 2000bp图1 Hp基因型电泳结果
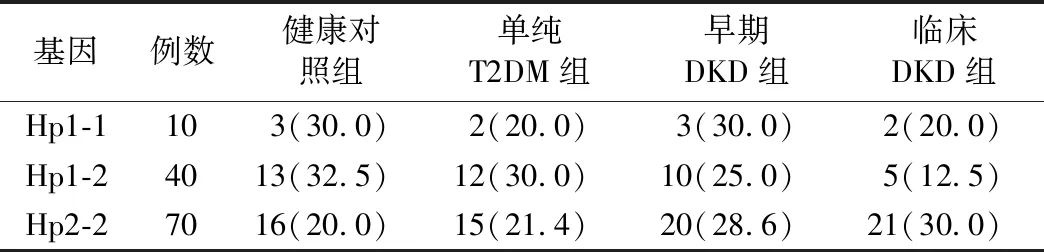
表2 3种Hp基因型在4组患者中出现的频率[例,(%)]
3.uHp、UAER、尿液β2-MG水平对早期DKD的诊断价值:以GFR为标准绘制uHp、UAER、尿液β2-MG对DKD诊断的ROC曲线,结果发现,uHp的ROC曲线下面积(AUC)明显大于UAER及尿液β2-MG的AUC(P<0.001)。见图2、表3。
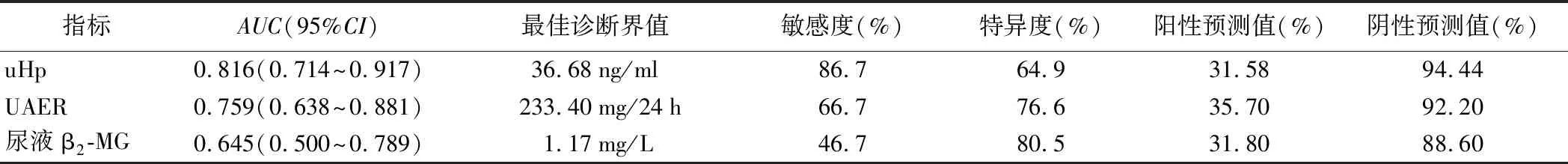
表3 uHp、UAER、尿液β2-MG对DKD的诊断价值
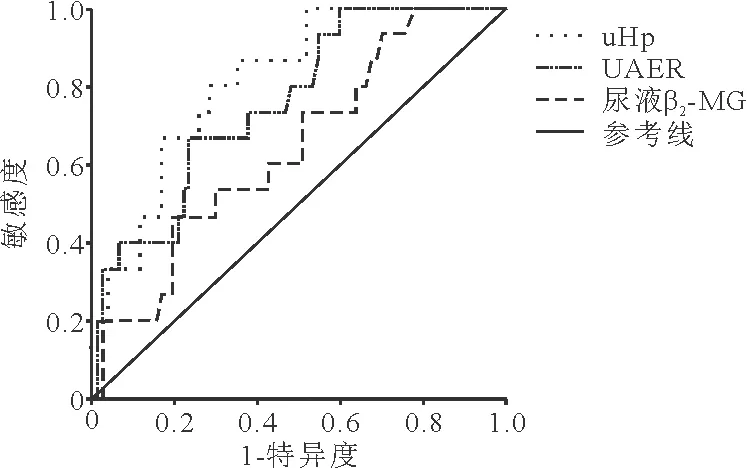
图2 uHp、UAER、尿液β2-MG对DKD透析的ROC曲线
讨 论
DKD属于T2DM严重并发症之一,是导致糖尿病患者不良预后的重要因素。由最初的肾小球高滤过到出现大量蛋白尿的过程中,肾功能的进展逐渐加速。在DKD早期阶段,肾小球结构的完整性大多得到保留,晚期时肾小球结构被破坏、滤过屏障受损、肾小管损伤、间质纤维化,病情难以逆转,因此早期预测并进行干预尤其重要[9-10]。
本研究首先比较了健康人群及不同阶段DKD患者的uHp水平,结果发现随着病情进展,uHp浓度逐渐升高,表明uHp与DKD的发生发展相关。为了解uHp对DKD的预测价值进一步绘制了ROC曲线,结果发现uHp的AUC明显大于UAER和尿液β2-MG,表明uHp对DKD的诊断效能优于UAER及尿液β2-MG。约登指数取最大值时,得到uHp的最佳诊断界值为36.68 ng/ml,即当uHp>36.68 ng/ml时诊断DKD具有较高的诊断价值,此时诊断的敏感度和特异度分别为86.7%、64.9%。
Hp主要合成场所在肝脏,但在皮肤、脂肪组织、肺及肾脏也有表达[11],在人体内发挥清除血红蛋白、促进血管生成、抗炎、抗氧化应激等作用。T2DM患者的红细胞脆性增加,游离Hb增多[12-13];DKD早期,肾小球呈高滤过状态,血液中Hp经肾小球滤过增多;另一方面,在DKD早期,Hp在肾脏的表达反应性增多;此外,DKD患者肾间质受累,肾小管上皮细胞损伤凋亡增加,Hp从脱落的近端小管上皮细胞进入管腔,最终出现DKD患者尿液中Hp浓度升高。
研究表明,Hp基因型决定了Hp在患者体内表达的差异,另外,不同基因型的Hp产物在功能上可能存在差异,主要表现在结合游离Hb的差异及其与巨噬细胞表面CD163亲和力的差异[14]。因此,不同Hp基因型与疾病的易感性也有所不同,Hp基因型可能同样对DKD有潜在预测价值[14]。我们进一步分析了Hp基因型频率在各组的差异,但并未发现Hp与DKD进展间存在显著关联。基于以上结果,我们分析可能原因如下:一方面,本研究样本量较小,可能不能很好代替总体;另一方面,虽然本试验尽量避免了试验操作因素造成的误差,但仍不排除试验过程中人为因素的干扰;第三,由于Hp基因型频率受年龄、种族、地域等影响[15],我们的研究仅基于十堰及周边地区的T2DM患者,结果是否普遍适用还需进一步大规模探索。
综上,本文就uHp水平在DKD早期诊断中的价值进行了探讨,发现uHp水平随DKD病情进展逐步升高,其对DKD的诊断效能优于UAER和尿液β2-MG,对DKD早期诊断有很大价值,作为一种无创、简便的检查手段,在临床上可以弥补单独使用尿白蛋白进行诊断的不足。另外,尽管Hp基因型影响Hp在人体的表达,但我们的实验中未发现DKD的进展与Hp基因型之间显著相关,其中的机制还有待进一步研究发现。

