肌醇依赖酶1α调控下胰岛β细胞凋亡和衰老的关系
张晓亮 汪雷 柏新乐
随着我国社会的老龄化日益加剧,衰老及其相关疾病成为危害人类健康的重要疾病之一。流行病学调查结果显示,中国成年人糖尿病的患病率随着年龄增加而同步升高,同时,高龄孕妇是妊娠期糖尿病的高危人群,表明衰老是糖尿病发病的危险因素[1]。胰岛β细胞增殖是出生后维持胰岛β细胞数量稳态的主要来源,胰岛β细胞数量的绝对或相对缺乏是糖尿病的基础病因[2-3]。研究显示,小鼠及人类胰岛β细胞的增殖率在出生一段时间后逐渐降低,人类胰岛β细胞数量在成年后迅速下降,直到60岁以后下降幅度逐渐减小[4-6]。不仅如此,胰岛β细胞在外界刺激作用下可代偿性增殖,而衰老胰岛β细胞虽然存在增殖潜能,但诱导增殖率很低[7]。因此,阐明年龄影响胰岛β细胞增殖的机制、研究如何提高衰老胰岛β细胞增殖能力,对衰老引起的糖尿病具有重要意义。哺乳动物肝脏中的肌醇依赖酶1α(IRE1α)作为细胞感应机体营养变化的感应分子,能激活c-Jun氨基末端激酶(JNK)及Caspase-12介导内质网应激诱导的凋亡[8]。有研究结果显示,抑制IRE1α通路可减少胰岛细胞凋亡,但其在衰老影响胰岛β细胞增殖中的调控作用目前尚不明确[9]。本研究通过检测不同周龄小鼠中IRE1α/JNK信号通路的活性及胰岛细胞的增殖水平,旨在探究IRE1α表达在衰老影响胰岛β细胞凋亡中的作用。
材料与方法
1.材料:雄性野生型C57BL/6小鼠购自上海斯莱克实验动物中心;IRE1α flox/flox小鼠和胰岛β细胞特异性表达(RIP cre)的小鼠均由南京模式动物中心构建;小鼠30天断奶后均一直饲养在SPF级动物房中,可任意进食及饮水;动物房保持温度(22±2)℃,湿度(35±4)%,12小时昼夜周期(早晨7时亮灯);动物证号:SCXK(沪)2018-002,伦理审查受理号:2018101023。胰岛素试剂盒购自millipore公司(美国,货号EZRMI-13k);血糖仪和血糖试纸购自雅培(美国);蛋白酶抑制剂购自Sigma-Aldrich公司(美国,货号s193-2)。磷酸化肌醇依赖酶1α(p-IRE1α)抗体(货号10255-1)、IRE1α抗体(货号10124-s)、天冬氨酸蛋白水解酶3(Caspase-3)抗体(货号65432-1)、细胞周期素D2(cyclin D2)抗体(货号23532-1)、微管蛋白(Tubulin)抗体(货号112334-1-AP)均购自Proteintech公司(美国)。胰腺十二指肠同源盒-1(PDX-1)抗体(货号3456-S)、C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(chop)抗体(货号2452-s)购自Cell Signaling Technology公司(美国)。
2.方法
(1)分组与模型建立:取雄性野生型C57BL/6小鼠50只;另将IRE1α flox/flox和RIP cre这两种c57背景的小鼠交配筛选出胰岛β细胞特异性敲除IRE1α的小鼠作为实验组(IRE1α-IKO),IRE1α flox/flox小鼠(RIP cre阴性)作为对照组(IRE1α-WT),每组各20只。小鼠均饲养至8周龄开始实验,分别饲养6周(14周龄)、12周(20周龄)、24周(32周龄)、36周(44周龄)、48周(56周龄),建立不同周龄小鼠衰老模型。C57BL/6小鼠于14周龄、20周龄、32周龄、44周龄、56周龄检测血糖、血清胰岛素后处死取胰腺组织块,于液氮中短暂保存,之后置入-80 ℃冰箱贮存用于蛋白质免疫印迹法(Western blot)检测;实验组、对照组小鼠于14周龄、20周龄、32周龄、44周龄检测血糖、血清胰岛素;56周龄时,一半进行葡萄糖及胰岛素耐量试验,一半处死取胰腺组织块,于液氮中短暂保存后置入-80 ℃冰箱贮存用于Western blot检测。
(2)小鼠血糖检测:小鼠饥饿4 h后,采用血糖仪检测小鼠的尾尖血糖,将血滴滴在试纸上然后读取血糖值,最后用纱布或棉球对鼠尾压迫止血。
(3)小鼠血清胰岛素检测:采用戊巴比妥钠麻醉小鼠,心脏取血后于4 ℃、以3 000 r/min离心10 min获得血清。采用小鼠胰岛素试剂盒(货号EZRMI-13k,检测范围为0.2~10.0 ng/ml)通过酶联免疫吸附试验(ELISA)检测其血清中胰岛素含量,操作如下:小鼠血清按1∶10比例稀释,每个样品检测3个复孔,使用酶标仪读取吸光度,使用胰岛素标准品及标准品吸光度制作标准曲线,计算血清中胰岛素含量。
(4)葡萄糖及胰岛素耐量试验:小鼠饥饿16 h后进行葡萄糖及胰岛素耐量试验,操作如下:将葡萄糖溶解于生理盐水中,按1.5 g/kg小鼠体重的剂量进行腹腔注射(每个周龄组6只);将胰岛素稀释于生理盐水中,按1 U/kg小鼠体重的剂量进行腹腔注射(每个周龄组6只)。注射前及注射后30 min、60 min、120 min使用血糖仪测量尾静脉血糖值。操作时保持小鼠安静状态,每只小鼠操作间隔保持一致。
(5)Western blot检测p-IRE1α、IRE1α、Caspase-3、PDX-1、cyclin D2、Tubulin、chop蛋白:采用RIPA裂解液裂解胰岛组织后,进行蛋白浓度测定,再用6×上样缓冲液制样,上样电泳、滤纸-凝胶-聚偏二氟乙烯膜(PVDF)膜-滤纸夹心转膜。然后用含5%脱脂奶粉的TBST溶液封闭PVDF膜1 h。封闭结束后,孵育抗体,最后加入电化学发光(ECL)结合底物反应、曝光显影。

结 果
1.不同周龄野生型C57BL/6小鼠随机血糖水平变化:野生型C57BL/6小鼠随机血糖水平在32周开始明显升高,32周龄[(8.7±0.9) mmol/L]、44周龄[(10.1±1.1) mmol/L]、56周龄[(11.7±1.8) mmol/L]与14周龄[(6.3±1.1) mmol/L]小鼠比较差异均有统计学意义(P<0.05),20周龄[(6.4±1.2)mmol/L]与14周龄小鼠比较差异无统计学意义(P>0.05)。
2.不同周龄野生型C57BL/6小鼠胰岛增殖/凋亡相关分子的表达水平:从32周开始,野生型C57BL/6小鼠的IRE1α磷酸化水平及Caspase-3水平均明显高于14周龄小鼠,PDX-1和cyclin D2的表达水平明显低于14周龄小鼠(P<0.05)。见图1、表1。
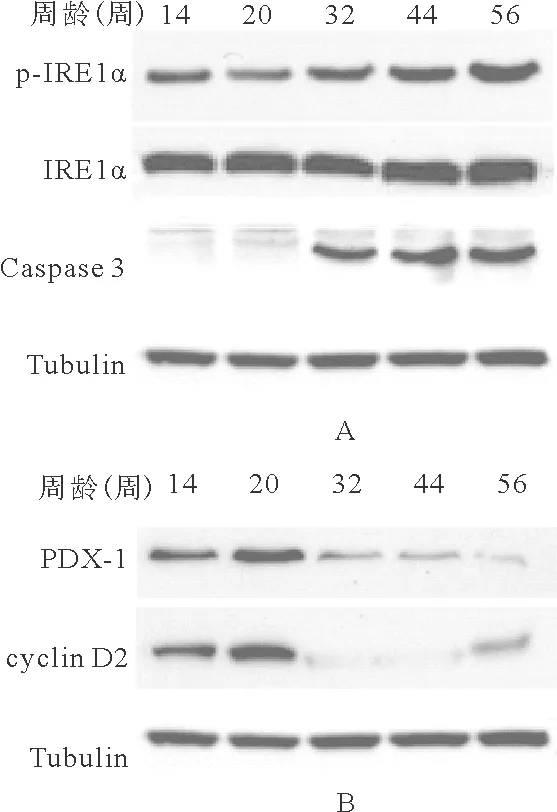
图1 不同周龄野生型C57BL/6小鼠胰岛增殖/凋亡相关分子的表达水平比较
表1 不同周龄野生型C57BL/6小鼠胰岛增殖/凋亡相关分子表达水平比较
3.不同周龄实验组和对照组小鼠随机血糖和胰岛素水平比较:实验组小鼠随机血糖水平从32周开始明显低于对照组(P<0.05);实验组小鼠血清胰岛素水平从20周开始明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 不同周龄实验组和对照组小鼠随机血糖和胰岛素水平比较
4.实验组和对照组高龄小鼠糖耐量和胰岛素耐量比较:选取56周龄的两组高龄小鼠检测糖耐量和胰岛素耐量,结果显示,实验组小鼠在腹腔注射葡萄糖溶液的30 min、60 min、120 min后糖耐量明显低于对照组,实验组小鼠在腹腔注射胰岛素溶液的30 min、60 min、120 min后胰岛素耐量明显低于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 实验组和对照组高龄小鼠糖耐量和胰岛素耐量比较
5.实验组和对照组高龄小鼠胰岛中增殖和凋亡相关分子表达比较:选取56周龄的两组小鼠,检测其胰岛中cyclin D2和IRE1α信号通路下游凋亡相关分子chop的表达结果显示,高龄实验组小鼠cyclin D2的表达水平(1.0±0.2比2.7±0.4)较对照组明显增加,而IRE1α信号通路下游凋亡相关分子chop表达水平(0.9±0.3比0.3±0.1)较对照组明显降低(P<0.001)。见图2。
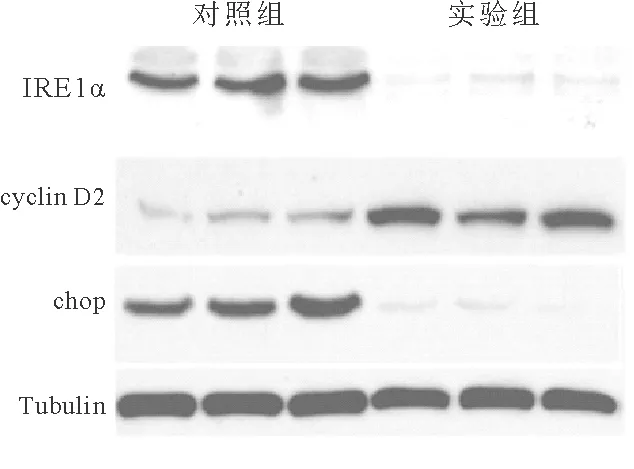
图2 实验组和对照组高龄小鼠胰岛中增殖和凋亡相关分子表达水平比较
讨 论
胰岛β细胞的增殖率在青少年期迅速减少,在成年期下降速度变慢,其降低幅度对老年人胰岛细胞的增殖尤为重要[10]。研究表明,啮齿动物、人类胰岛β细胞的增殖速率在出生后迅速下降,而β细胞增殖速率的降低与粘附分子E-钙粘素(E-cadherin)水平有关[11-12]。另有研究发现,在结直肠癌细胞中,IRE1α的沉默或高表达可影响E-cadherin水平[13]。本研究通过检测IRE1α信号分子在不同周龄小鼠胰岛中的表达,并通过IRE1α胰岛敲除小鼠探究相关的分子机制,结果显示,IRE1α基因敲除小鼠胰岛素水平较野生型小鼠增加,同时胰岛素耐量和葡萄糖耐量改善,提示敲除IRE1α的高龄小鼠胰岛β细胞功能或数量高于对照组,同时表明IRE1α信号通路可能参与调控年龄相关的胰岛细胞功能或数量,抑制IRE1α功能可提高衰老β细胞应对外界增殖刺激的增殖反应,促进胰岛β细胞增殖以满足机体对胰岛素的需求。
随着年龄增长,胰岛对外部增殖信号的应答反应下降,即胰岛细胞表现为年龄相关的增殖能力下降[11]。但随着年龄增加,胰岛素受体、催乳素受体及胰岛β细胞增殖的内源性调节因子如Foxo-1水平变化较小,表明细胞凋亡是参与调控小鼠及人的年龄相关的胰岛β细胞数量的主要机制[14]。有研究结果显示,IRE1α/JNK通路中JNK磷酸化具有促进P21泛素化降解的作用,间接抑制P21介导的cyclins/cdks复合物的核转位,导致cyclin D2翻译及转录因子E2F激活降低,增殖减少[15]。另有研究表明,chop促发细胞凋亡的作用与其作为转录因子的功能相关,其可诱导一些促凋亡蛋白质的转录表达,同时还会降低抗凋亡基因BCL2的表达,并且通过招募TRAF2激活细胞质中的Caspase-12,触发启动细胞的凋亡程序[16]。
本研究结果显示,随着小鼠周龄增加,胰岛β细胞内质网应激损伤增加,IRE1α信号通路激活,提示IRE1α信号通路激活可能参与了调控胰岛β细胞增殖和凋亡相关因子表达。进一步探究发现,高龄胰岛β细胞IRE1α敲除小鼠(IRE1α-IKO)较野生型小鼠的血糖代谢有所改善,其PDX-1和cyclin D2表达均较野生型增多,凋亡相关因子chop表达降低。鉴于PDX-1和cyclin D2作为年龄相关胰岛β细胞增殖的主要调控因子调节胰岛β细胞细胞周期的进程,提示IRE1α可能为β细胞年龄相关增殖下降的因子之一,IRE1α信号通路在年龄介导的胰岛β细胞凋亡中发挥重要的调控作用。
综上所述,IRE1α信号通路激活可能参与了衰老增加胰岛β细胞凋亡率的过程,即老年糖尿病的发生可能与IRE1α信号通路激活有关,而敲除IRE1α可促进高龄小鼠胰岛中增殖相关因子表达,并降低凋亡相关因子表达,改善小鼠血糖代谢,这可能为治疗老年糖尿病提供新思路。

