颅底脊索瘤一例
方红艳 吴晶 欧阳焱黎 王群
患者,男,76岁。因“鼻塞1个月”于2018年6月10日来我院就诊。患者1个月前无明显诱因出现鼻塞,主要表现为右侧,持续性,偶有涕中带血,无发热,无头痛、面部麻木、复视,无耳鸣、耳闭、听力下降,无吞咽困难,为求诊治来我院就诊予以收入我院肿瘤科。自起病以来,患者精神状态一般,睡眠、饮食、大小便正常,体力体重无明显变化。既往无特殊病史,有吸烟史30年,每日约20支,10年前已戒烟。无饮酒史。体格检查:T 36.3 ℃,P 80次/分,R 19次/分,Bp 128/67 mmHg,神志清楚,营养中等,双中鼻道见息肉样新生物,双鼻腔狭窄,硬腭可见巨大肿物突出于口腔内,形状不规则,肿块左侧质地稍硬,右侧质地软,实性,无波动感,压痛不明显,活动度小,不可推动,表面黏膜呈青紫色;右鼓膜完整,鼓室可见积液征;心、肺、腹及神经系统体格检查无异常,双下肢无水肿。2018年6月15日行鼻咽磁共振检查结果提示右侧鼻咽-口咽部见等T1、稍长T2信号软组织肿块;向上方突入右侧上颌窦及鼻腔,向下突入口腔,向后累及鼻咽后壁,右侧累及翼腭窝、腭帆张肌及提肌;右侧咽鼓管开口及咽隐窝消失,右侧咽旁间隙明显变窄;右侧上颌骨翼板、上颌窦内外侧壁骨质结构显示欠清楚(图1A)。遂行“经鼻内镜鼻腔鼻窦新生物活检术+双鼻腔肿物切除术”。术后病理检查结果:(右上颌窦)肿瘤细胞大小一致,呈空泡样,小团状,小片状聚集,周边基质黏液样变性明显(图2)。免疫组化结果:AE1/AE3(+)、S-100(+)、MOM2(+)、Bcl-2(+)、CK8/18(+)、Vim(+)、P63(-)、Calponin(-)、EMA(-)、CK19(-)、CEA(-)、Des(-)、SMA(-)、CD56(-)、Syn(-)、CD99(-),P53:约5%区域、中等(+),Ki-67 LI:灶区20%。诊断:(右上颌窦)恶性肿瘤(瘤细胞上皮样,伴黏液软骨样基质)—脊索瘤。建议患者进一步行根治手术,家属拒绝,予上颌窦、下咽部肿瘤三维适形调强放疗,肿瘤原发灶(PGTV):2.1 Gy/33 F,计划靶区(PTV):1.8 Gy/33 F,放疗结束后予以甲磺酸伊马替尼靶向治疗。2018年10月20日患者复查鼻咽磁共振,结果显示:右侧上颌窦-口咽部见不规则等T1、稍长混杂T2信号软组织肿块,局部较前缩小,增强后明显不均匀强化,延迟期强化减低,局部咽腔狭窄,较前略减轻,右侧咽鼓管开口及咽隐窝消失,右侧咽旁间隙明显变窄;右侧上颌骨翼板、上颌窦内外侧壁骨质结构显示欠清楚;结合病史考虑治疗后改变(图1B)。按实体瘤的疗效评价标准(RECIST),该患者疗效评价为部分缓解之后每3个月复查一次评价为稳定。患者于2019年10月24日复查评价为进展,家属拒绝继续治疗,于2020年3月5日在家中死亡。
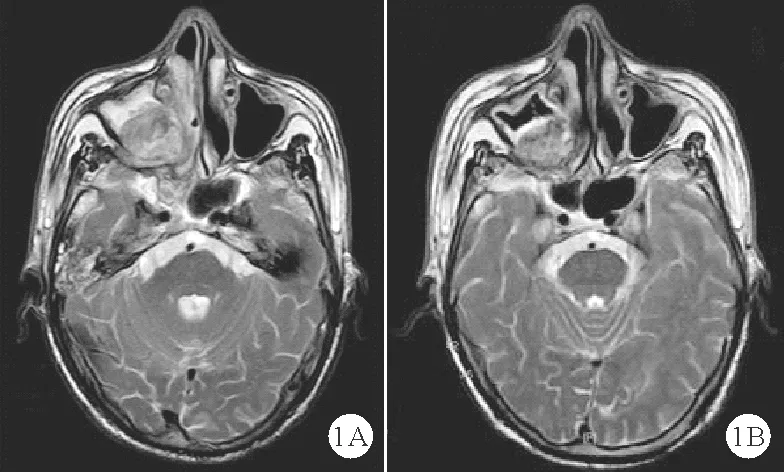
图1 患者鼻咽磁共振检查结果(A:2018年6月15日治疗前检查结果:右侧上颌窦、鼻腔可见团状等T1稍长T2信号,累及翼腭窝B:放疗及靶向治疗3个月后检查结果:右侧上颌窦见不规则等T1、稍长混杂T2信号软组织肿块,局部较前缩小)

图2 患者鼻窦新生物病理检查结果[A:肿瘤细胞大小一致,小团状,小片状聚集;苏木素-伊红(HE)染色,×10;B:瘤细胞上皮样,含单个或多个大小不一的空泡,伴黏液软骨样基质;HE染色,×40]
讨 论
脊索瘤是一种罕见的骨组织起源肿瘤,发病率约为0.08~0.09/10万[1],发病年龄为50~60岁,男性发病率高于女性。脊索瘤好发于脊柱两端,即颅底和骶椎,前者约占30%,后者约占50%,其他部位如椎骨约占20%[2],本例患者肿瘤发生于颅底。脊索瘤的生长过程虽然缓慢,且很少发生远处转移(晚期可转移),但其局部破坏性很强,可侵袭周围神经结构和中轴骨组织,手术后极易复发,故仍属于恶性肿瘤。脊索瘤主要分为4种病理类型,即经典型、软骨型和去分化型、肉瘤样[2]。经典型脊索瘤的特点为分叶状结构,小叶间为纤维间隔。肿瘤具有丰富的细胞外黏液样基质,其中可见柱状、条索状和簇状排列的大圆形或多角形肿瘤细胞,大多数病例病理类型为经典型。软骨样脊索瘤可见丰富的软骨样或软骨组织。去分化脊索瘤是双相性肿瘤,由典型的脊索瘤和高级别未分化梭形细胞肉瘤或骨肉瘤并存组成。几乎所有的脊索瘤患者均表达细胞角蛋白(CK)和brachyury,大部分患者表达上皮膜抗原(EMA)和S100蛋白,去分化脊索瘤中的去分化成分不表达CK、brachyury、EMA和S100蛋白。
脊索瘤的临床表现与其所在的部位相关,疼痛最为常见,颅底脊索瘤通常表现为头痛和(或)颅神经功能障碍,骶骨的脊索瘤患者常因神经损伤出现大便习惯的改变[3]。磁共振检查表现为T1WI低信号,T2WI明显高信号,能明确显示肿瘤的部位、范围及肿瘤对海绵窦、脑神经等重要结构的侵犯情况。本例患者肿瘤在磁共振上表现为等T1、稍长T2信号软组织肿块,侵犯邻近器官和组织。脊索瘤确诊需要依赖病理活检结果,镜下可见空泡样瘤细胞为脊索瘤的特征性细胞。
外科治疗是脊索瘤的主要治疗方法,需行充分手术切缘的广泛切除[4],因为完全切除肿瘤是影响预后最重要的因素。近年来随着颅底外科技术的快速发展,尤其是神经内镜经鼻颅底外科技术的进步,手术创伤和并发症发生率显著降低。但对于颅底广泛扩展的脊索瘤,尤其是大部分侵入颅底侧方硬膜下的肿瘤,仍然需要开颅手术或分期手术显微镜下手术切除。脊索瘤全切除率为26.7%~66.7%,针对手术未全切除的患者,术后辅助治疗很有必要。尽管脊索瘤对放射线不敏感,但对于非根治性切除患者,绝大多数术后需辅以放疗,可改善局部控制情况和无病生存期[5]。对于不能手术的患者,在活检后进行放疗也是选择之一。因为正常组织不能耐受高剂量的照射,所以脊索瘤术后放疗需选择各种精确放疗手段,包括三维适形放疗、三维适形调强放疗、X刀、伽玛刀、射波刀及新型的粒子放疗技术包括质子刀和重离子放疗等。本例患者为非根治性切除,术后我们给予三维适形调强放疗。
除了高度恶性去分化型脊索瘤的潜在去分化部分外,脊索瘤对传统化疗药物不敏感[6]。多种抗肿瘤药物包括蒽环类药物、烷化剂、拓扑异构酶抑制剂等曾被尝试用于治疗脊索瘤,效果均不理想。因此,研发或筛选有效的靶向药物对治疗脊索瘤具有重要的临床意义。目前,血小板源生长因子受体(PDGFR)、表皮生长因子受体(EGFR)、雷帕霉素靶蛋白(mTOR)等参与的信号通路与脊索瘤的发病机制密切相关,推动了靶向治疗的进展。伊马替尼、舒尼替尼、尼洛替尼等均能特异性抑制PDGFR-α和PDGFR-β。在一项多中心、非随机的伊马替尼的Ⅱ期临床研究中,对PDGF-β/PDGFR-β表达的脊索瘤患者临床获益率(RECIST疗效评价:完全缓解+部分缓解+稳定≥6个月)为64%,不良反应未见[7]。在一项临床试验中,给予舒尼替尼治疗后,44%的脊索瘤患者达到了至少16周的稳定效果及肿瘤负荷的减少[8]。在25例高级别或转移脊索瘤患者中,22例EGFR表达阳性;其中18例阳性患者行EGFR抑制剂拉帕替尼治疗的Ⅱ期临床研究发现,该抑制剂具有中等程度抗肿瘤疗效,33.3%的患者部分有效[9]。此外,对伊马替尼不敏感的脊索瘤患者进行mTOR抑制剂雷帕霉素治疗或伊马替尼和雷帕霉素联合治疗,可能显示出中等程度抗肿瘤疗效[10]。本例患者放疗结束后予以甲磺酸伊马替尼靶向治疗,3个月后复查疗效评价为部分缓解。
脊索瘤由于局部侵袭性强、手术切除不彻底等原因,极易复发,出现复发转移后患者预后较差。患者5年及10年生存率报道不一,70%~80%的患者在5~10年内死亡,有报道称其5年的总生存率为68.4%,10年总生存率为39.2%,中位生存期为7.8年[11]。因此,早诊早治对于改善脊索瘤预后具有重要意义。

