肠病性关节炎的诊断与治疗
王雷 魏智民 黄烽
脊柱关节炎(SpA)是一组以脊柱关节受累为特征的慢性炎症性风湿性疾病,具有特定的病理生理、临床、放射学和遗传特征[1]。临床上可有中轴脊柱骨关节受累,多表现为慢性腰背痛、晨僵等不适;也可有外周关节炎、指(趾)炎、韧带和肌腱末端在骨的附着点炎,并可有一定的关节外表现。在脊柱关节炎国际评价协会(ASAS)2009年的新分类标准中,将SpA按受累关节部位分为中轴型脊柱关节炎(ax-SpA)和外周型脊柱关节炎(p-SpA)两大类[2]。尽管如此,传统分类标准[3]将SpA按临床特征分为强直性脊柱炎(AS)、反应性关节炎(ReA)、银屑病关节炎(PsA)、肠病性关节炎(eSpA)和未分化脊柱关节炎(un-SpA),因其实用性,目前依然被临床广泛使用。
炎症性肠病(IBD)是免疫相关的胃肠道器质性疾病,主要包括溃疡性结肠炎(UC)、克罗恩病(CD)和未定型IBD,临床上以腹泻伴黏液或脓血、腹痛、体重减轻和发热等为主要表现[4]。eSpA也称作炎症性肠病相关的脊柱关节炎(IBD-SpA),是SpA传统分类中的一种亚型,通常指伴有IBD的SpA[5]。临床研究报道中,SpA与IBD的共患病率异质性强,欧美人群SpA患者合并IBD的患病率为0~30%不等,其中以CD更常见[6];我国一项临床调查报道称SpA患者合并IBD的比例为7.2%[7];而在IBD患者中,符合SpA诊断标准的患者比例为0~50%不等[6]。
IBD与SpA有一定的遗传和免疫因素重叠。在遗传方面,人类白细胞抗原(HLA)的等位基因如HLA-B27、HLA-B35和主要组织相容复合体(MHC)Ⅱ型的等位基因DRB1 0103等均与SpA、IBD的患病具有较强的相关性[8];在免疫方面,多种细胞因子,如肿瘤坏死因子(TNF)-α、白细胞介素(IL)相关的IL-23/17轴系统等均参与了两种疾病的发病,且针对细胞因子的生物制剂也对两种疾病病情有显著缓解和改善作用。环境因素也参与了两种疾病的发展,其中肠微生态相关因素如饮食和肠道菌群,是近年来的研究热点。研究发现,在HLA-B27转基因大鼠从无菌环境转到清洁环境后,能发展出肠道和关节的炎症,说明肠道菌群可能参与了两种疾病的发生和发展[9];而病例对照研究也发现,IBD和SpA患者的肠道菌群结构与健康人群相比有一定程度的重叠[10]。因此,越来越多的研究者认为,SpA与IBD可能是相似病因背景在不同外界环境刺激下引起的不同器官的临床表现。
尽管SpA和IBD有着相似的病因背景和较高的共患病率,但在临床工作中,以主要症状和体征为导向的就诊模式、患者选择性地向专科医生报告相关症状及风湿科医生和消化科医生在繁重的医疗工作中问诊和检查不充分都可能导致共患病的漏诊、学科间转诊合作的缺乏,并可能出现治疗分歧。因此,本文总结了SpA和IBD共患病的相关诊治文献,旨在提高医生的认知,增加学科间交流合作,为eSpA患者更好的诊治提供依据。
一、诊断
1.SpA
SpA的临床表现异质性较强,按ASAS标准将其分为ax-SpA和p-SpA,诊断标准也不同。
(1)ax-SpA的诊断
根据ASAS标准,患者若存在慢性(≥3个月)腰背痛,且发病年龄<45岁,应行进一步检查。
影像学方面,可行骨盆X线平片和(或)骶髂关节CT检查,确定有无骶髂关节炎;磁共振(MRI)检查有助于ax-SpA的早期诊断,若发现软骨下骨髓水肿,高度提示SpA相关的骶髂关节炎,但在运动后、女性分娩后等情况下也可能出现骨髓水肿,需要进行鉴别[11]。若存在骶髂关节炎症,同时确定有至少1项SpA特征,则可以考虑ax-SpA。
SpA特征包括:①炎性腰背痛:其特点为发病年龄<40岁、隐匿发病、夜间疼痛(起床后改善)、休息无改善、运动改善;②~④外周关节炎、趾/指炎、附着点炎(跟腱炎常见):根据有无红肿、疼痛或压痛判断,必要时可进一步行关节超声确认;⑤~⑦银屑病、葡萄膜炎、IBD:需要皮肤科、眼科、消化内科医生协助诊断;⑧HLA-B27阳性;⑨C反应蛋白升高;⑩SpA家族史;非甾体抗炎药(NSAIDs)治疗有效:若尚无法明确诊断,可尝试NSAIDs治疗。若影像学并未发现骶髂关节炎,但HLA-B27呈阳性,同时有至少两项SpA特征,也考虑诊断ax-SpA[2-3]。
(2)p-SpA的诊断
根据2011年ASAS标准,满足以下a或b其中一种情况即可考虑诊断p-SpA:a:以下5项中,满足至少3项:SpA特征的①(曾发生过)、②~④、⑩;b:SpA特征②~④中满足1项,同时有以下任意1项:SpA特征⑤~⑧、骶髂关节炎、前驱感染史[2,12]。
(3)IBD患者中SpA的识别与转诊
IBD患者合并SpA的比例较高,但这一情况经常被忽视,据报道IBD患者SpA的延迟诊断时间达5.2年。因此消化内科医生在IBD患者的诊疗中有必要对SpA进行鉴别和筛查,若存在以下不适,应将患者转诊至风湿科,明确诊断,有助于患者的治疗和病情长期控制[13]:①慢性(≥3个月)腰背痛;②外周关节肿胀或疼痛;③附着点炎(足跟疼痛或压痛);④趾/指炎。若消化内科医生对SpA的诊断有一定掌握,可进一步检查其他SpA特征如家族史、关节外表现、影像学检查和实验室检查,为患者转诊风湿科提供更充分的资料支持。
2.IBD
IBD的诊断缺乏金标准,需要根据临床表现、实验室检查、影像学检查、内镜检查、组织病理检查结果综合分析。尽管内镜检查需要在消化内科完成,但风湿科医生掌握IBD的内镜和活组织检查基本特征也是必要的。
(1)UC
临床上,UC患者以持续或反复发作的腹泻、黏液脓血便最为常见,还可伴腹痛、里急后重和不同程度的全身症状,病程多在4~6周以上。若患者存在上述临床特点,应首选结肠镜检查明确诊断。结肠镜检查结果是UC诊断的主要依据。结肠镜下,UC病变部位多始于直肠,连续弥漫分布,依据严重程度不同,可有黏膜红斑、糜烂、溃疡,甚至自发性出血。缓解期患者结肠镜下可为正常黏膜表现。病程较长患者的黏膜萎缩和瘢痕形成可导致结肠袋形态消失、肠腔狭窄及炎(假)性息肉。黏膜组织活检方面,UC有固有膜内炎性细胞浸润、隐窝结构改变,并可见黏膜表面糜烂、浅溃疡形成和肉芽组织;缓解期时,黏膜糜烂、溃疡可愈合,隐窝改变多保留,并可见帕内特细胞化生[14]。
根据改良Truelove和Witts分型标准[15],UC的严重程度主要从反应排便、贫血、炎症3个方面的以下6项指标判断:①排便次数;②便血;③脉搏;④体温;⑤血红蛋白;⑥红细胞沉降率。
(2)CD
CD的临床表现多样,消化道以腹泻、腹痛常见,可有血便、肛周病变(瘘管、脓肿、皮赘等);全身症状以体重减轻常见,也可有发热、食欲不振、疲乏等。若患者存在上述临床特点,首选结肠镜检查,以明确诊断。
结肠镜检查是CD诊断的主要依据,进镜应达末段回肠。镜下CD病变以阿弗他溃疡为主要表现,严重者溃疡融合可形成纵行溃疡;此外,还可见卵石征、肠壁可增厚甚至狭窄、团簇样息肉增生等;病变分布多不连续,病变间黏膜可完全正常。黏膜组织活检方面,CD镜下特点为局灶性的慢性炎症、局灶性隐窝结构异常和非干酪样肉芽肿。若结肠镜未能明确诊断,根据临床特点还可进行小肠镜、小肠CT/MRI成像、胃镜等检查辅助诊断[14]。
CD的严重程度评估通常采用克罗恩病活动指数(CDAI)或简化CDAI,主要评估以下方面:①一般情况;②腹痛;③腹泻;④腹部包块;⑤伴随疾病:关节痛、虹膜炎、结节性红斑、坏疽性脓皮病、阿弗他溃疡、裂沟、新瘘管和脓肿等[16]。
(3)SpA患者中IBD的识别与转诊
在SpA的诊疗过程中,风湿科医生应将IBD相关筛查纳入常规问诊中,若存在以下问题,应将患者转诊至消化内科,明确诊断,有助于患者的治疗和病情长期控制[13]:①IBD家族史;②临床症状:a.慢性腹泻;b.慢性腹痛;c.直肠出血;d.体重减轻;e.持续发热;③肛周瘘管/脓肿(既往/现症);④贫血。
若风湿科医生对IBD的诊断有一定掌握,在SpA患者有上述临床特点出现的同时,还需考虑实际情况进行初步鉴别:如NSAIDs的使用可能导致胃肠道损伤,出现腹痛、粪便潜血等表现;而TNF拮抗剂(TNFi)的使用有感染结核的风险,可能出现发热、体重减轻等表现。在排除用药等因素后,应将患者转诊至消化内科,尽早完成内镜检查,明确诊断,并调整治疗方案。此外,有条件的医院还应将粪便钙卫蛋白检测纳入到IBD的筛查中[17-18]。
二、治疗
1.SpA
根据“2016年更新的ASAS/欧洲抗风湿病联盟(EULAR)的强直性脊柱炎治疗推荐”[19],所有ax-SpA患者均应进行规律锻炼和戒烟,并考虑物理治疗。当出现症状时,以NSAIDs作为基础用药,并以TNFi作为症状不能控制时的补充用药。而p-SpA的治疗,目前尚缺乏共识意见,但在ax-SpA治疗指南中,若患者以外周关节为主要表现时,推荐使用柳氮磺吡啶(SSZ),并可局部注射糖皮质激素治疗。
2.IBD
根据2021年国际IBD研究组的报道[20]和我国炎症性肠病诊断与治疗共识的意见[14],IBD患者最重要的长期治疗目标是临床缓解、黏膜愈合、生活质量改善和致残率降低。临床上,UC的治疗主要以氨基水杨酸(ASA)制剂作为基础用药,包括SSZ、5-ASA(如美沙拉嗪);当ASA制剂控制不佳时,考虑加用糖皮质激素。用药方法依据严重程度而定。此外,也有小样本研究报道硫嘌呤类药物、沙利度胺和环孢素等可用于难治性UC。当糖皮质激素或上述免疫抑制剂不能控制症状时,考虑使用生物制剂治疗,首选TNFi,其中推荐英夫利昔单抗(IFX),有报道显示阿达木单抗(ADA)也可用于IBD的治疗。CD的治疗用药与UC相似,但考虑CD的病变部位差异,更推荐口服ASA而非栓剂。而布地奈德对病变局限在回肠末端、回盲部或升结肠者效果更优。此外,IBD的治疗依据具体情况,需考虑抗感染治疗、手术治疗等。
3.IBD-SpA
研究发现,AS伴随情况并不影响IBD预后[21],而IBD对AS有单向正相关的因果关系[22],提示在eSpA患者治疗中,需要优先考虑IBD的治疗。目前,鲜有针对eSpA而制定的国际共识。2014年Olivieri等[23]首次提出了意大利的eSpA治疗共识,并在随后被其他研究认可采用。ESpA的治疗将SpA分为ax-SpA和p-SpA,将IBD分为活动性IBD和缓解期IBD,设定不同的治疗方案(图1),特点如下:(1)NSAIDs:IBD活动期避免使用,缓解期可短期(<2周)使用环氧合酶(COX)2选择性抑制剂(COXIB),如艾瑞昔布控制SpA相关症状;(2)TNFi:推荐使用IFX和ADA;依那西普有诱发IBD的风险,应避免使用;其他TNFi也可尝试应用治疗eSpA。在IBD活动期,TNFi按照IBD的治疗方案使用,缓解期按照ASAS的SpA治疗方案逐渐减量;(3)糖皮质激素、ASA:按照IBD或p-SpA的治疗指南使用。
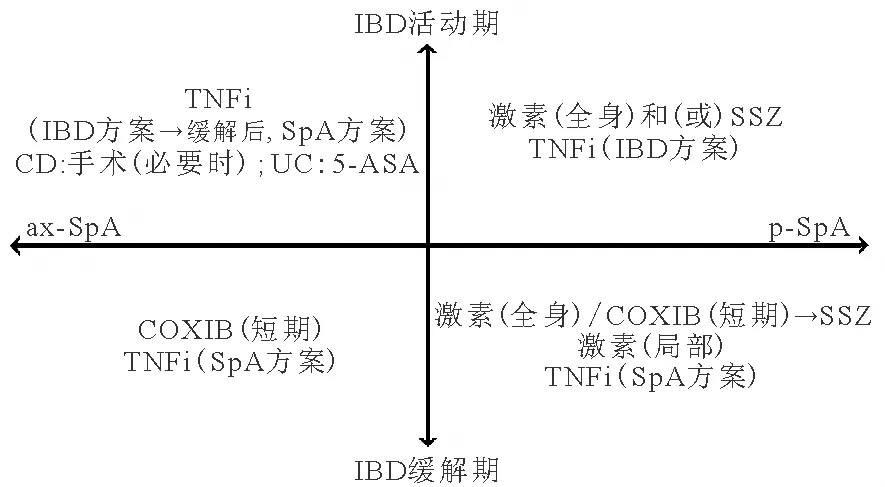
图1 eSpA的治疗策略
此外,值得一提的是,近年来肠道微生态相关研究给IBD和SpA的治疗带来了新希望。已有多项研究报道了肠微生态移植,即粪菌移植(FMT)对IBD有较好的治疗效果[24],而多项病例-对照研究也发现了SpA患者与健康人的肠道菌群差异,且SpA患者与IBD患者的肠道菌群部分重叠[10];另外还有研究发现,eSpA患者在FMT治疗后关节疼痛和晨僵的显著缓解[25]。若能通过改善患者肠道菌群,使有益的微生物定植于肠道并长期发挥抗炎治疗作用,或许能改变目前SpA和IBD患者长期用药或治疗不佳的现状。以上研究结果提示我们,通过肠道微生态可能为SpA(尤其是eSpA)的治疗带来革命性的进步。
三、总结
由于eSpA是相似病因在骨关节和肠道的共同表达,其诊断和治疗对专科医生的跨学科知识掌握有较高的要求,且目前尚无国际国内共识。因此我们总结了相关文献,为风湿科医生和消化内科医生对eSpA的诊断、转诊、治疗提供支持。未来,多学科会诊、远程会诊模式或SpA诊疗中心可能在eSpA的诊治中发挥良好的交叉衔接作用。

