应用CRISPR/Cas9技术制备Sema4D基因条件性敲除小鼠模型
伍晴,罗银河*,王孟清,马晓萌
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/CRISPR-associated 9)是一种由RNA 指导Cas 核酸酶对靶向基因进行特定DNA 修饰的技术[1]。CRISPR 是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。人工改造后的gRNA 与Cas9结合后,通过PAM 序列指导Cas9剪切DNA双链,造成DNA双链断裂。
CRISPR/Cas9 只需合成一个gRNA 就能实现对基因的特异性修饰,Cas 蛋白不具特异性。编码gRNA 的序列不超过100 bp,因此比构建TALENs 更简单方便。每一对TALENs 都需要重新合成,而用于CRISPR 的gRNA 只需要替换20 个核苷酸就行。较短的gRNA 序列也避免了超长、高度重复的TALENs 编码载体带来的并发症,且廉价,可操作性强[2]。
支气管哮喘的病理机制复杂,与气道上皮细胞损伤、T 细胞亚群的改变、气道炎症、气道高反应性、气道重塑、神经生长因子等因素密切相关,近年来,神经-内分泌-免疫(Neuroendocrine-immune,NEI)网络假说在哮喘发病机制研究中也逐渐得到重视。有研究发现,神经免疫信号蛋白4D(Sema4D)在神经和免疫系统中表达且作用。在免疫系统中,Sema4D 在T 细胞表面被发现,并调节T 细胞启动。Sema4D 作为免疫性脑信号蛋白,参与多种免疫,在细胞间通讯、细胞迁移、免疫调节中起关键作用,对气道重塑也有一定的促进作用[3-4]。此外,它还对巨噬细胞、DC 细胞、自然杀伤细胞和中性粒细胞有刺激作用,并被定义为Th2 驱动的肺病理和生理学的重要调节因子,导致气道炎症的产生[5]。由此可见,Sema4D 与哮喘病理密切相关,但具体机制尚不明确。
本研究拟利用CRISPR/Cas9 技术对小鼠Sema4D基因进行靶向敲除,并从基因组对小鼠进行鉴定和验证,以期构建Sema4D 基因敲除小鼠哮喘模型,为进一步研究Sema4D 在病毒诱发哮喘NEI 网络紊乱中的作用提供基础。
1 材料和方法
1.1 材料
实验所用的清洁级小鼠为C57BL/6J,体质量20~40 g,购自赛业生物有限公司,许可证号:SCXK(苏)2018-0003。小鼠饲养于赛业生物有限公司SPF级实验动物中心,恒温恒湿,12 h 光照,12 h 黑暗,自由采食。PCR 试剂购自LongAmp 公司,Taq DNA(货号:NEB M0323V)由Polymerase 提供,Qhick Ligase 连接酶和限制性内切酶由NEB 提供,Trition X-100 由Amresco0694 提供,鼠尾裂解提取基因组使用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0(Takara 9765):Cat#9765-1。
1.2 方法
1.2.1 靶序列的选择
从NCBI 小鼠基因组网站得到Sema4D 基因(NCBI参考序列:NM_013660.4)的序列和结构信息。分析Sema4D 基因的结构,该基因位于小鼠13 号染色体上,发现了16 个外显子,其中ATG 起始密码子在第3 外显子中,TGA 终止密码子在第16 外显子中(转录本:Sema4D-201 ENSMUST00000021900.13)。实验选择第4 外显子作为条件敲除区域,该区域的缺失会导致小鼠Sema4D基因功能的丧失。见图1。
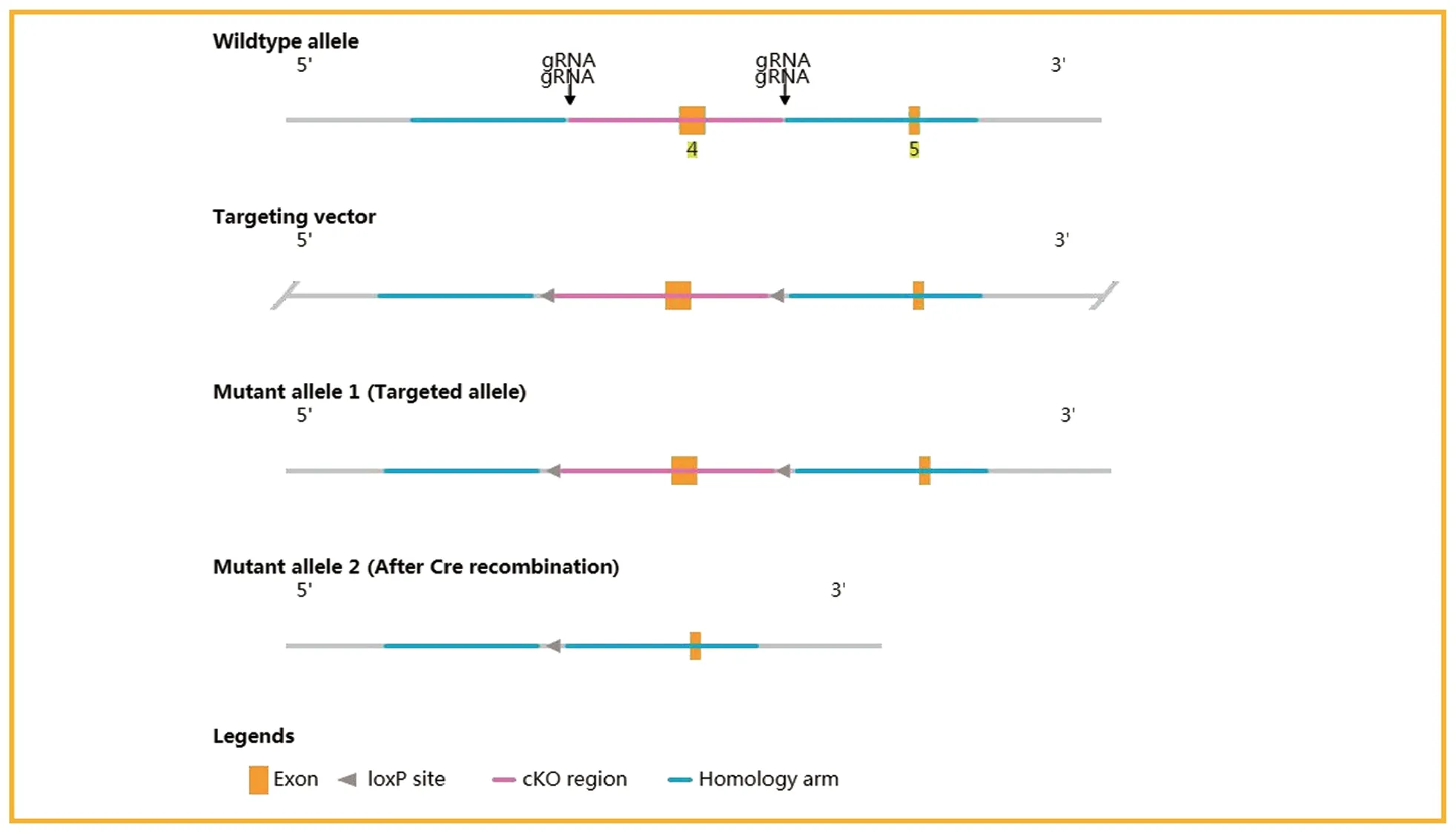
图1 小鼠Sema4D基因靶序列的选择
1.2.2 Cas9/gRNA的设计
基于gRNA的设计原则,在靶位点区域共设计4条gRNA。gRNA1(matching forward strand of gene):TATTTTGAGCCTACAGTGGGTGG;gRNA2 (matching reverse strand of gene):TGTCTTTAACCACCCACTG⁃TAGG;gRNA3(matching forward strand of gene):CG⁃TAATTGAGCACAAGGAGATGG; gRNA4 (matching forward strand of gene):TAAAGACGTAATTGAGCA⁃CAAGG。
1.2.3 载体构建
按照已设计gRNA 序列合成引物,合成gRNA 引物后退火,退火产物与基本载体连接,连接产物转化感受态,涂平板过夜培养,挑取单菌落,菌落PCR 筛选阳性克隆,鉴定的阳性克隆进行测序验证,测序正确,说明已成功构建CRISPR载体获得最终载体。
1.2.4 质粒制备
准备质粒制备所需试剂及物品,载体质粒转化大肠杆菌,摇菌提取适量质粒,质粒纯化试剂盒纯化质粒,测序验证质粒。
1.2.5 RNA的制备
准备转录所需试剂及物品,PX330质粒线性化,体外转录试剂盒把线性化的DNA 转录成RNA,PCR 扩增gRNA,胶回收PCR 产物,体外转录试剂盒把PCR 产物转录成RNA,电泳鉴定转录的RNA 是否降解,电泳合格的RNA用RNA纯化试剂盒纯化,电泳鉴定纯化后的RNA,纯化后的RNA用于后续受精卵注射。
1.2.6 RNA注射
从交配后0.5 d的供体母鼠子宫内获取受精卵,安装显微注射设备,准备所需试剂及物品,挑选形态良好、发育状态适中的受精卵,转移至注射皿的培养基内,将待注射RNA 进行稀释,吸入注射针,将其逐个注射入细胞核。
1.2.7 代孕鼠制备及胚胎移植
选取适龄的母鼠与结扎公鼠合笼,获取代孕母鼠,将注射RNA 的受精卵移植入代孕母鼠的子宫内,将代孕母鼠放在干净的笼盒中,并保温待其清醒后放回笼架饲养,受精卵移植完成,小鼠出生,待1 周龄左右剪小鼠脚趾送检PCR,编号,3周后进行分笼。
1.2.8 F0小鼠鉴定
基因组DNA 提取,Triton X-100 和蛋白酶混合物裂解液,裂解样品过夜,次日,高温灭活蛋白酶,离心收集上清,作为PCR 模板,PCR 扩增及电泳检测,胶回收PCR 片段及测序鉴定,分析测序结果,记录阳性鼠标号。
1.2.9 F1小鼠繁殖
阳性鼠出生满8 周,与8 周龄鼠合笼,出生小仔放入新的笼盒,并进行编号,待1 周龄左右剪小鼠脚趾送检PCR,进行鉴定。
1.2.10 F1小鼠鉴定
基因组DNA 提取,Triton X-100 和蛋白酶混合物裂解液,裂解样品过夜,次日,高温灭活蛋白酶,离心收集上清,作为PCR 模板,PCR 扩增及电泳检测,胶回收PCR 片段及测序鉴定,分析测序结果,记录阳性鼠标号。
1.2.11 Southern Blot验证
通过对F1 代动物尾部DNA 样本的Southern Blot分析,确定正确的基因定位,Southern Blot 分析策略如下所示。
Southern Blot预期的片段大小:
5'Probe-BglII:10.76 kb-WT,2.39 kb-MT
3'Probe-SspI:4.14 kb-WT,2.70 kb-MT
Primers for 5'Probe:
5' Probe forward primer:5'-AGCAGGCAG⁃GTTCAGACAGGATAGA-3'
5' Probe reverse primer:5'-AACACTACCAC⁃CAGGGCCAAGAAC-3'
Primers for 3'Probe:
3' Probe forward primer:5'-GTCCCAGAACAT⁃GAGGAAGCCCTAA-3'
3' Probe reverse primer:5'-GGCTCTTTGTACGT⁃GCGGTCAATTA-3'
1.2.12 后代小鼠繁殖
将F1 靶向小鼠与组织特异性Sftpc-CreERT2 删除小鼠杂交,生成F2 代小鼠,该F2 代小鼠为靶向等位基因杂合和Cre 转基因半杂合/杂合,自交扩繁后得到F3 代纯合子小鼠和杂合子、Cre+小鼠,得到F4 flox/flox,Sftpc-CreERT2 小鼠雌雄共31 只,见图2。
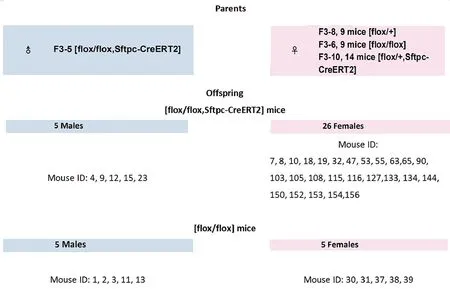
图2 扩繁后的F4代小鼠基因型
1.2.13 他莫昔芬诱导
Cre-ERT 位于广谱型启动子或组织特异性启动子下游,他莫昔芬可以在蛋白水平激活它。将Cre-ERT小鼠与flox小鼠进行交配繁殖,再使用他莫昔芬便可以实现特定时间的基因敲除。小鼠腹腔注射他莫昔芬40 mg/kg,连续注射5 d。
1.2.14 RT-qPCR检测
经他莫昔芬诱导后成功建立C57BL/6J小鼠Sema4D条件性剔除模型,取3 只诱导后的敲除小鼠模型、2 只flox 小鼠模型的肺组织做量化条件敲除区的基因组拷贝数表达并进行比对,本实验以小鼠TERT基因作为参考基因,用引物进行RT-qPCR检测,见图3。
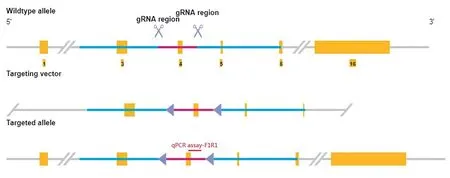
图3 RT-qPCR检测的引物设计
2 结果
2.1 CRISPR载体的构建
利用高保真度Taq DNA 聚合酶从BAC 克隆中扩增出含有同源臂(HAs)和条件敲除(CKO)区域的小鼠基因组片段,并将其与重组位点和选择标记一起序列组装成靶向载体。最终确认目标载体被限制性内切酶消化,下面的单位都是千碱基对(kb),见图4。
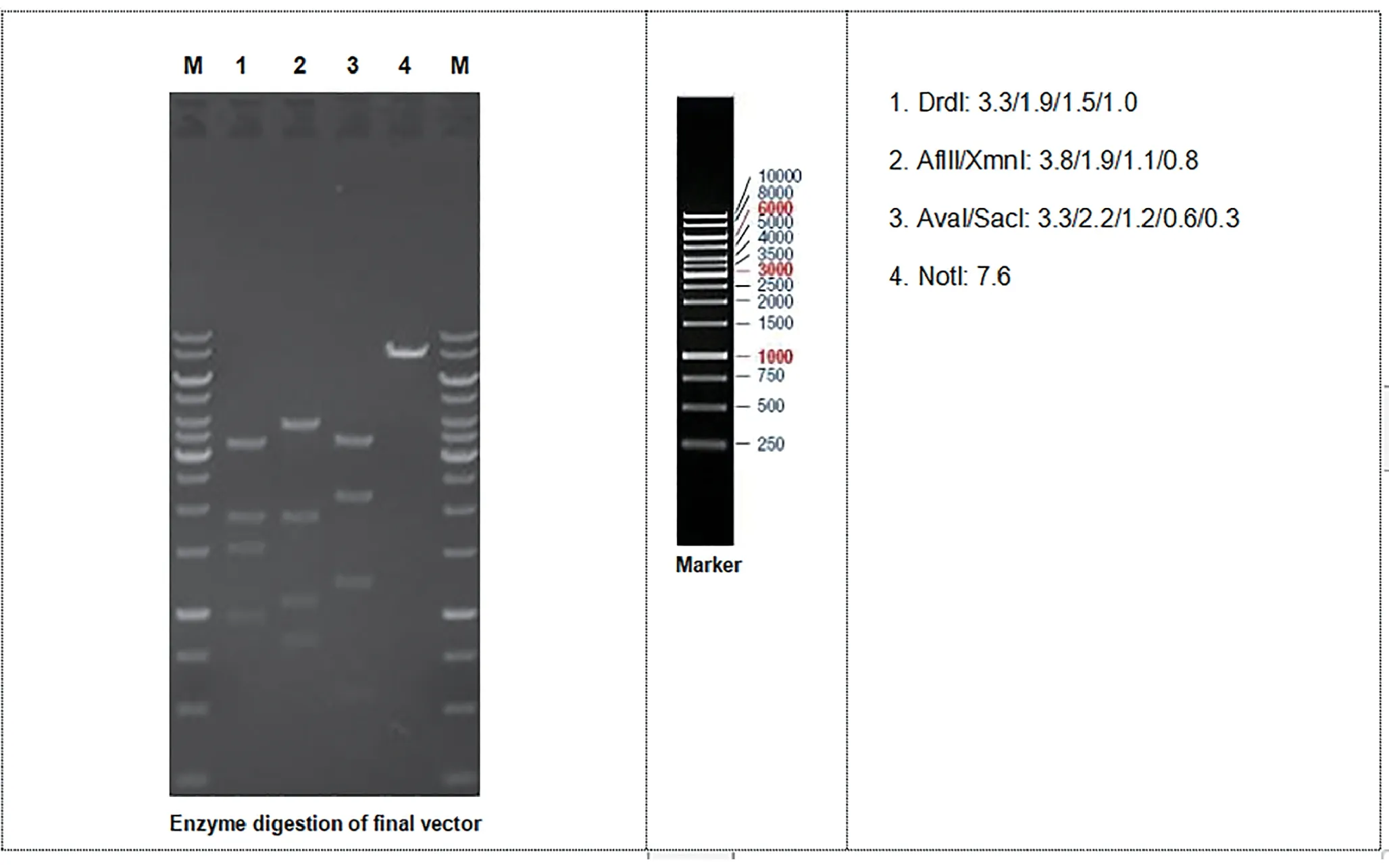
图4 酶切的最终载体
2.2 F1代小鼠基因型鉴定
在F0 代阳性小鼠中用胚胎测序筛选出稳定遗传的founder。让founder 与同品系的野生型杂交得到F1代,提取F1 代小鼠基因组DNA,经PCR 扩增后用琼脂糖凝胶电泳鉴定,通过PCR 筛选(引物信息见图5),F1动物15、16 和30 被鉴定为阳性,获得2 雄1 雌共3 只flox杂合子(见图6)。并对F1代小鼠进行基因组测序,其中小鼠15的测序结果见图7。

图5 引物信息
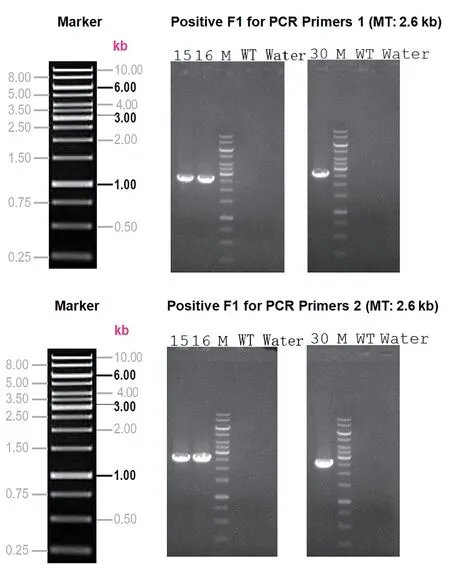
图6 F1代小鼠组织DNA PCR扩增后的基因型电泳鉴定结果
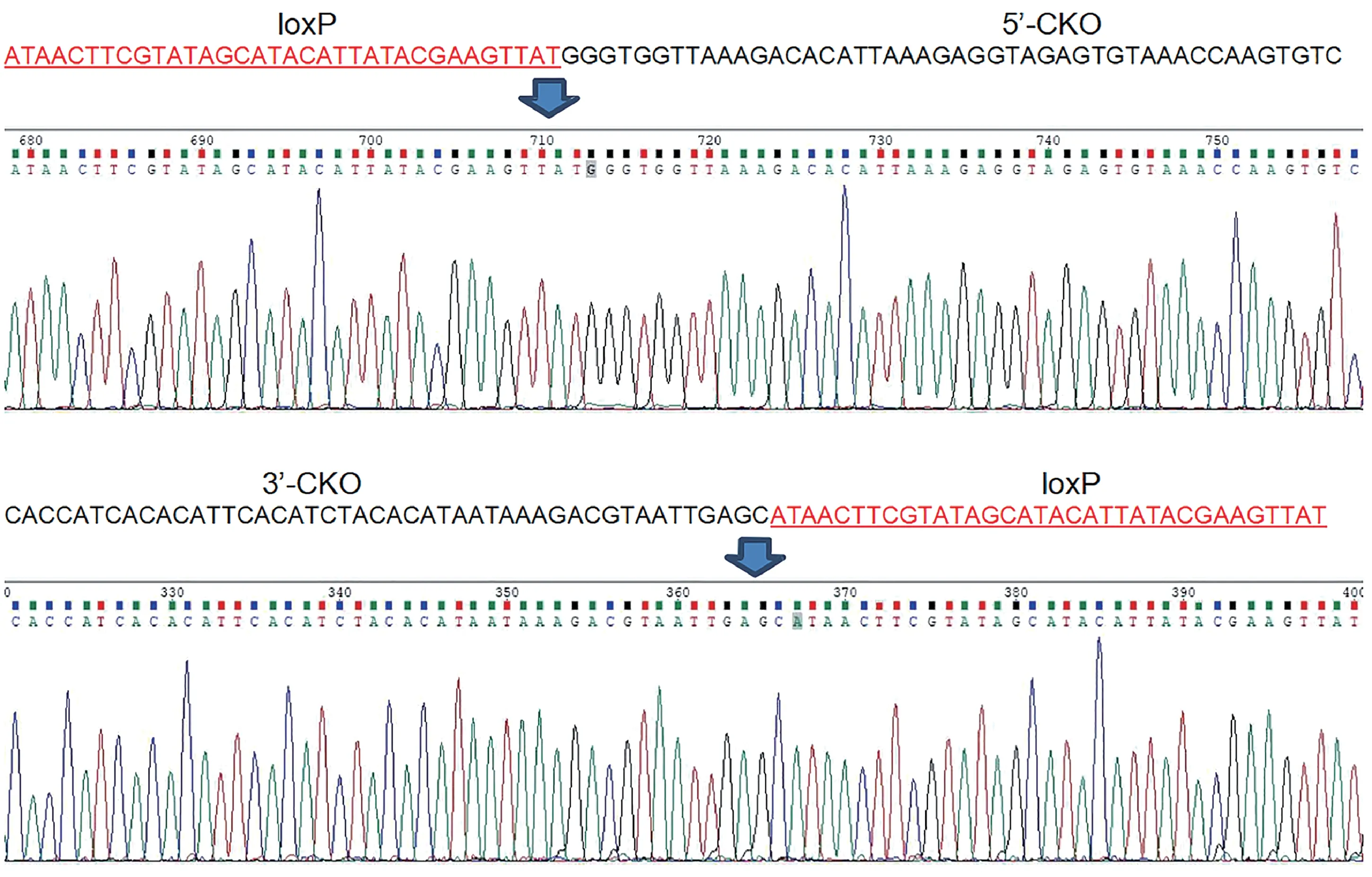
图7 F1代小鼠DNA基因组的测序结果
2.3 F1代小鼠Southern Blot结果
通过对3 只F1 代动物(15、16 和30)尾部DNA 样本的Southern Blot 分析,确定了正确的基因定位,证实F1 代flox 杂合子构建成功,可用于后续分析,结果见图8。

图8 F1代小鼠Southern blot结果
2.4 F4代小鼠PCR筛选结果
通过PCR 引物(Annealing Temperature 60.0 °C):F1:5'-CATGTTGCCAAGCCTAATGCTC-3',R1:5'-TTAGTGTAAGCTACCTCAATTCCCC-3' 得到F4 代flox/flox 小鼠筛选结果的结果见图9;通过对Sftpc-CreERT2 转基因PCR (Annealing Temperature 60.0 °C):Sftpc-M-F:TGCTTCACAGGGTCGGTAG Sftpc-M-R:ACACCGGCCTTATTCCAAG Sftpc-W-R:CATTACCTGGGGTAGGACCA 得到筛选结果见图10。综上所知,经PCR 筛选后可知F4 代flox/flox,Sftpc-CreERT2 小鼠雌雄共31 只。
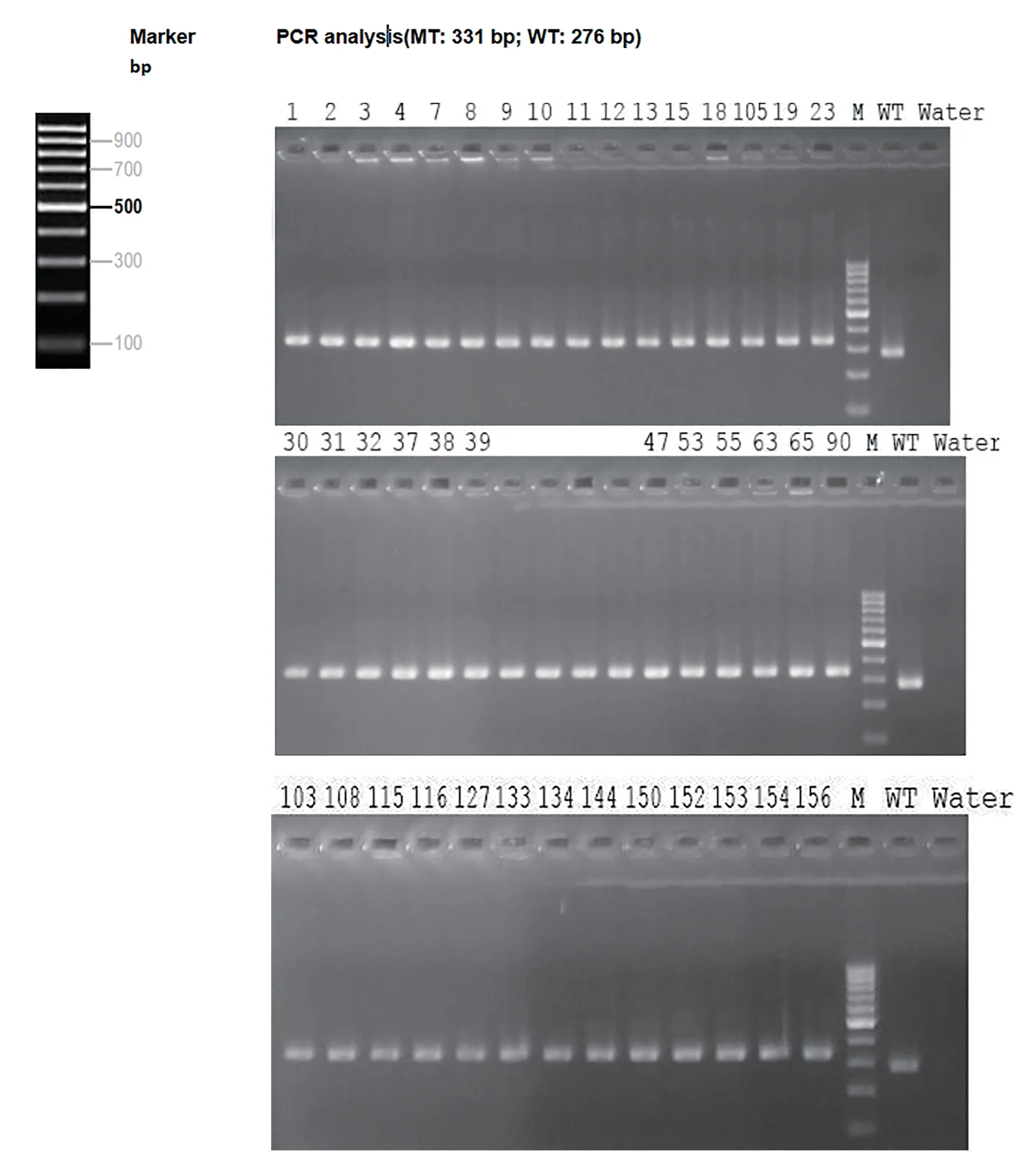
图9 F4代flox/flox小鼠PCR筛选结果
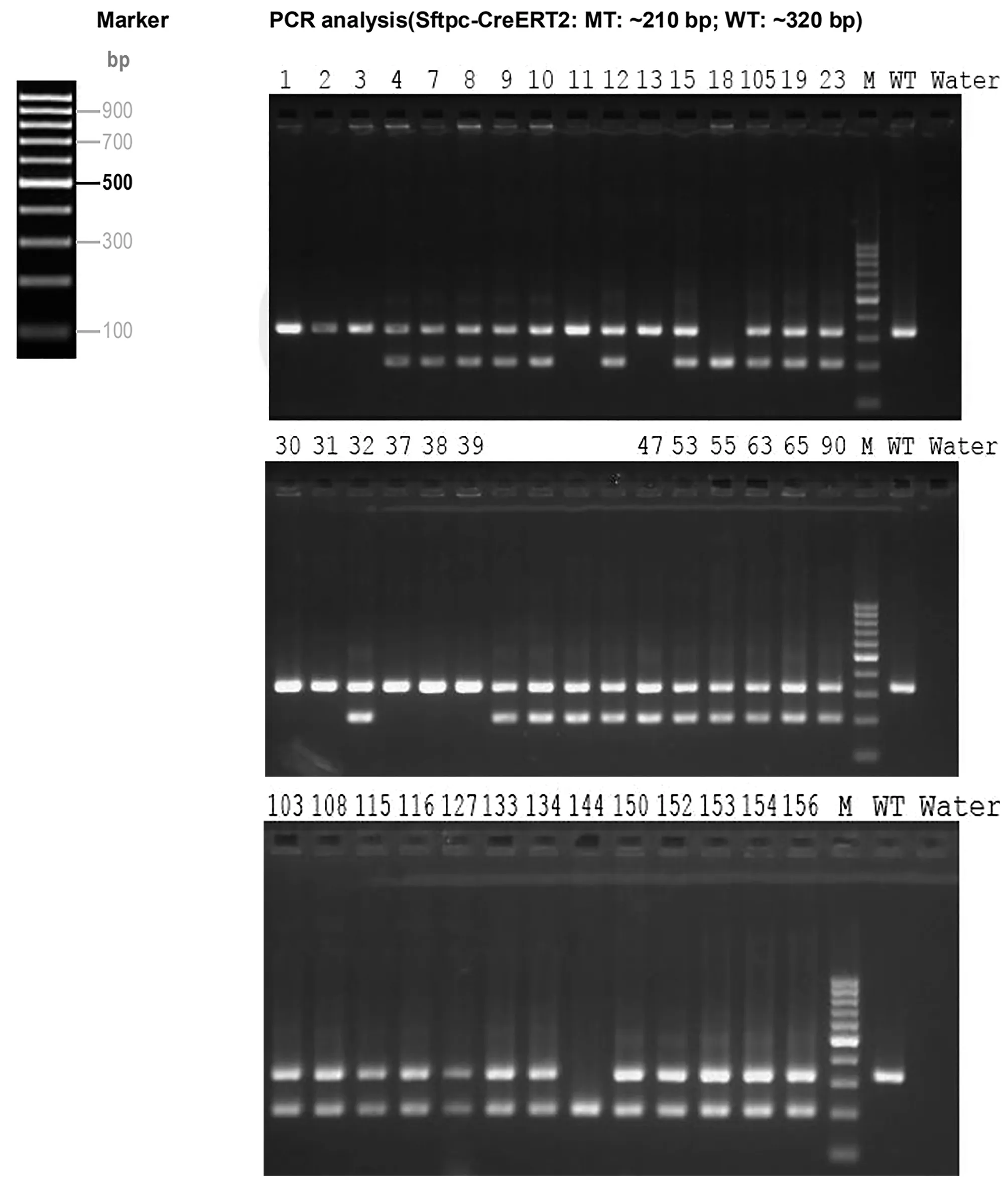
图10 F4代Sftpc-CreERT2小鼠PCR筛选结果
2.5 Sema4D基因敲除成功后的qPCR结果
mTert 基因熔解曲线和mSema4D 基因熔解曲线见图11,曲线上有一个单一且尖锐的峰,这表明引物具有很强的特异性,不存在非特异性条带或二聚体。以小鼠mTert 基因为参考基因,引物mSema4D-qPCRF1/R1 进行RT-qPCR 检测。比较CT 法,又称2-△△CT法,用于定量mSema4D 的基因表达。尾部样本分别以野生型样本5-7 作为基因表达的内对照,我们采用2-△△Ct方法分析mSema4D 条件敲除区的相对基因组拷贝数,结果显示敲除鼠的基因拷贝数降低,说明小鼠的Sema4D 基因含量较flox 小鼠低,提示Sema4D 基因敲除成功,见表1。

表1 条件敲除区的相对基因组拷贝数
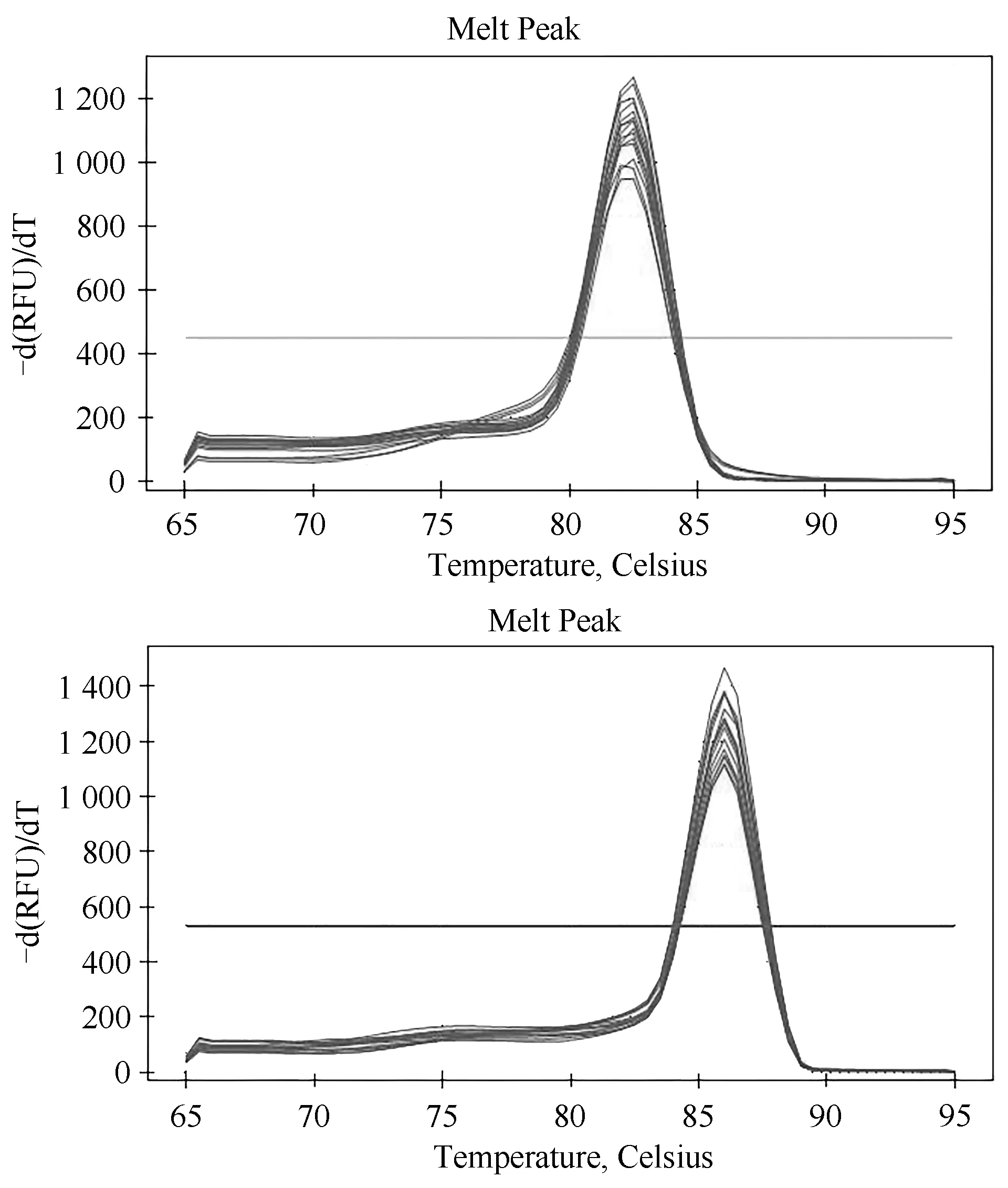
图11 熔解曲线
3 讨论
Sema4D 是轴突导向分子Semaphorin 第Ⅳ家族的成员之一,CD72 和Plexin-B1 是Sema4D 的两个主要受体,分别在淋巴组织和非淋巴组织优势表达。高亲和力的受体Plexin-B1 与Sema4D 结合可以抑制单核细胞、树突细胞,在内皮细胞中,还可通过促进组装成熟的粘联复合物(focal adhensions)和脯氨酸酪氨酸激酶2(Pyk2)导致磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)和蛋白激酶1/2(Erk1/2)的激活,是促进血管内皮细胞迁移的重要环节,提示Sema4D 通过PI3-K 通路可能与哮喘的气道重塑有关[6-7]。有研究发现Sema4D 和肺组织中的基质金属蛋白酶-2(matrix metalloprotein-2,MMP-2)、α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)蛋白表达呈现相同的作用趋势,说明Sema4D可能通过使MMP-2、α-SMA表达上调,从而参与气道重塑的形成,Sema4D 可能成为治疗哮喘气道重塑的新靶点[4]。Sema4D 广泛分布于人体内,在人类多种组织中都有表达,主要分布在神经系统和免疫系统中。在免疫系统中,受体CD72 以其低亲和力作用于B 细胞,对B 细胞的发育和分化起反向调控作用,Sema4D 与受体CD72结合可以消除CD72的抑制作用,说明Sema4D的参与增强、激化B细胞,提高B 细胞的聚集和生存能力[8-9]。当前研究也显示Sema4D 对T 细胞介导的免疫有活化作用,可以增强T 细胞应答,也可以通过提高树突状细胞的活性来实现抗原特异性的T 细胞的进一步分化。研究表明,Sema4D 可刺激炎症因子的产生,引起Th1/Th2 失衡,加重哮喘症状[10]。提示Sema4D 可能通过介导多种免疫功能参与了哮喘的发病。Sema4D 还显示对巨噬细胞、DC、NK 细胞和嗜中性粒细胞的刺激功能,这些细胞都参与哮喘病理,可知Sema4D在过敏气道反应中起着关键的非冗余调节作用[5]。近几年,有研究不断发现Sema4D 基因与哮喘的发生发展关系密切。哮喘发病时,Sema4D 还可促进NGF 的表达,加重哮喘发展[11]。Sema4D 可能通过刺激大鼠脑内c-fos 蛋白的表达及SP 的释放而进一步抑制机体HPA 轴内分泌激素的释放,从而加重哮喘[12]。
中医中药在支气管哮喘的治疗上积累了大量经验,有其独特的优势。《丹溪心法·喘论》首将“哮喘”进行命名,把支气管哮喘称之为哮病。哮喘发病因素有内因和外因,内因为体质特禀、正虚痰伏,外因多为外邪侵犯、气候骤变、饮食不当、情志刺激、活动过度等。内因为发病基础,外因为哮喘发作条件,外因作用于内因,引动伏痰,导致肺失宣肃,痰气相搏,阻塞气道,气道痉挛,升降失司,以致呼吸困难,喉间痰吼啸鸣,发为哮喘。西医机制与之对应即为激活神经-内分泌-免疫(NEI)“大网络”,受病毒侵袭,损伤Th1 的保护作用,激活T 细胞,Sema4D 表达增强,Th1/Th2 平衡被打破,刺激Th2 释放炎症因子,使支气管肥大细胞脱粒、组胺释放及嗜酸性粒细胞浸润,引起气道水肿、痰液积聚,诱发哮喘。
由上可知,Sema4D与哮喘发作的中医机制过程密不可分,要探知哮喘发病时,Sema4D 在肺部炎症的具体发病机制,需要通过研究基因敲除技术构建气道上皮Sema4D表达缺失的小鼠模型。
CRISPR/Cas9 技术因其操作简便、效率高而成为最热门的基因编辑技术,本研究选择小鼠Sema4D基因转录起始密码子附近第4 个外显子作为敲除区域,并将gRNA、Cas9 mRNA 和含有loxP 位点的供体载体混合物注入受精卵移植进同品系与雄鼠交配后超排的母鼠内。利用CRISPR/Cas9 介导的非同源末端连接途径获得的敲除小鼠,由于非同源末端连接DNA 修复的结果是随机发生的,因此笔者通过PCR 及Southern Blot结果进行筛选,最终获得3 只阳性F0 代founder 小鼠,F0 代雌雄小鼠之间不能相互交配,为了确保产生的突变并稳定遗传,将其与同背景的野生型小鼠进行交配,最终生产3 只雌雄混合的F1 代杂合小鼠。将F1 靶向flox 杂合小鼠与组织特异性Sftpc-CreERT2 工具鼠杂交,生成F2 代小鼠,该F2 代小鼠对于目标等位基因是杂合的,而对于Cre 转基因是阳性的。F2 代自交扩繁后得到F3 代的CKO(flox/flox,Sftpc-CreERT2)纯合子雄性小鼠和flox/+、flox/flox、flox/+Sftpc-CreERT2雌性小鼠交配后,得到31 只雌雄混合的F4 代CKO(flox/flox,Sftpc-CreERT2)小鼠。再经他莫昔芬的诱导敲除目标条件基因后,qPCR 检测mSema4D 的含量确认目标基因敲除成功,成功建立C57BL/6J 小鼠Sema4D条件性敲除模型。
Sema4D 基因敲除小鼠的模型的建立为研究Sema4D 表达缺失与哮喘气道免疫炎症的相关性提供了重要工具,也为深入研究Sema4D相关机制提供了较好的模型,对后续的中医治疗整体实验具有重要且深远的意义。

