淡色库蚊羧酸酯酶基因高表达与溴氰菊酯抗药性相关性研究*
吕 园 邱 樊 张红波 徐敬薇 沈 波**
(1.南京市第一医院,南京医科大学附属南京医院核医学科,江苏南京 210006;2.南京医科大学病原生物学系,江苏南京 210000)
蚊是重要的医学昆虫,能传播多种疾病,如疟疾、登革热、西尼罗河热、丝虫病、黄热病、寨卡病毒病等,严重危害人类健康。化学防制由于方便、高效和经济等特点,一直是蚊媒综合治理策略中的重要方法(陆宝麟, 2002)。拟除虫菊酯类杀虫剂具有广谱、高效、低毒和低残留的特点,是目前蚊媒防制现场应用最多的合成杀虫剂(Sahuetal., 2020)。然而,杀虫剂长期、大量的使用导致了抗药性的发生和发展。据报告,自 1947 年首例蚊抗药性报道以来,至今已有超过 125 种(亚种)蚊虫对一种或多种杀虫剂产生了抗性(CfD, 2010)。抗药性已经成为蚊媒和蚊媒病防制工作中的最大障碍(Inghametal., 2020)。
抗药性是多个基因、多重机制参与的生物进化现象,没有某一个基因或一类机制能够完整阐明抗药性(Ffrench-Constantetal., 2004)。全面系统地寻找蚊抗药性基因和调控因子、探寻其参与抗药性机制,一直是蚊媒防制研究中亟待解决的问题(Itokawaetal., 2019)。本课题组在前期工作中,利用高通量转录组测序,从我国分布广、种群密度高的重要家栖性淡色库蚊Culexpipienspallens中鉴定出一些溴氰菊酯抗药性相关基因,其中包括羧酸酯酶(CPIJ002786-RA,carboxylesterase)。根据高通量测序结果,其表达水平在实验室抗性选育品系较敏感品系高表达2.71倍(P<0.05),FDR(False Discovery Rate,假阳性率)<0.001。因此,我们预测淡色库蚊羧酸酯酶基因(CPIJ002786-RA)可能与溴氰菊酯抗药性相关,值得我们进一步探索。本研究采用荧光定量PCR方法检测羧酸酯酶基因(CPIJ002786-RA)在实验室抗性选育品系和敏感品系,及山东商河、山东孤岛、山东惠民、江苏江心洲现场抗性株和敏感株的表达水平,旨在探索羧酸酯酶基因(CPIJ002786-RA)作为蚊抗药性现场检测靶标的潜在应用价值。
1 材料与方法
1.1 供试蚊采集与饲养
淡色库蚊实验室敏感品系为采集于山东省济宁市唐口地区(35.12 N;116.50 E)的自然种群,长期饲养于本实验室,未接触任何杀虫剂。抗性选育品系是以敏感品系为初始种群,以半数致死浓度(LC50)的溴氰菊酯经多代筛选而成。淡色库蚊现场种群采集于山东省济南市商河镇(37.31 N;117.16 E,Shanghe,SH)、山东省东营市孤岛镇(37.85 N;118.81 E,Gudao,GD)、山东省滨州市惠民镇(37.49 N;117.51 E,Huimin,HM)和江苏省南京市江心洲(32.02 N;118.70E,Jiangxinzhou,JXZ)。WHO成蚊接触筒法(0.05%溴氰菊酯药膜)区分现场种群敏感株和抗性株。所有供试蚊饲养于平均温度 28 ℃, 平均相对湿度 75% 的房间内,光照时间为 14 h/d。
1.2 主要试剂和仪器
溴氰菊酯干粉和焦碳酸二乙酯(DEPC)购自美国 Sigma 公司,溴化乙锭(EB)购自中国 SunshineBio 公司,RNAiso Plus、DL2000 DNA Marker和PrimeScriptTM RT Master Mix (Perfect Real Time)购自日本Takara公司,Power SYBR®Green PCR Master Mix 购自美国 ABI 公司,0.05%溴氰菊酯药膜由马来西亚理科大学提供,丙酮、氯仿、异丙醇、乙醇、琼脂糖等为国产分析纯。
ABI Prism®7300型荧光定量 PCR 仪购自美国 ABI 公司,稳压电泳仪购自美国 Bio-Rad 公司,NanoDropTM2000/2000c分光光度计购自美国 Thermo Fisher Scientific 公司。
1.3 蚊幼虫浸渍法
将溴氰菊酯原药准确称重(50 mg),以丙酮(10 mL)作为溶剂配制成5 000 pmol/L(5 mg/mL)母液。实验前将母液梯度稀释至5个不同的浓度。以16 pmol/L为例,需将12.8 mL溴氰菊酯母液边滴边搅拌至4 L去离子水中;随后再梯度稀释至8、4、2、1 pmol/L。实验时分别将50 只四龄幼虫放入盛有200 mL 5个不同浓度溴氰菊酯稀释液的实验组瓷盆中处理24 h,同时设置无溴氰菊酯对照组。对照组和5个浓度的实验组分别设置3 次生物学重复。24 h 后记录幼虫死亡数量(幼虫不能逃避机械刺激则判定为死亡),实验按规定进行3次生物学重复。Abbott′s 方法校正死亡率后,通过 Probit 分析获得半数致死浓度(50% larval lethal concentrations,LC50)。
1.4 WHO成蚊接触筒法
将白纸卷贴于恢复筒内,连接好装置,用吸蚊管捕捉20~25只羽化3 d雌蚊,吹入筒内,关闭隔板;将0.05%溴氰菊酯药膜卷贴在接触筒内,然后与恢复筒连接;把隔板抽开,将恢复筒内蚊轻吹入接触筒,迅速关闭隔板,将筒竖直放置,开始计算接触时间;接触1 h后,再抽开隔板,将蚊吹回恢复筒,关闭隔板,取下接触筒(WHO, 2013) 。以 1 h 内击倒蚊作为敏感株(deltamethrin susceptible,DS),未击倒蚊作为抗性株(deltamethrin resistant,DR)(WHO, 2013) 。
1.5 蚊总 RNA 提取及质量检测
收集实验室和现场品系雌蚊,5只/管放入无RNA酶EP管中,每管加400 μL RNAiso Plus。加RNA研磨珠研磨,后补加RNAiso Plus到1 mL, 室温静置5 min。加200 μL氯仿,剧烈震荡30 s致溶液出现乳白色,室温静置10 min。离心机4℃,12 000 r/min, 离心15 min,取新无RNA酶EP管加400 μL异丙醇待用。小心吸取上清(约400 μL),移至新的EP管,管内有等体积的400 μL预冷的异丙醇,上下颠倒10次,温和充分混匀,室温10 min。离上清,避免倒掉沉淀,尽量将上清吸干,沿管壁加入1 mL预冷75%乙醇(乙醇∶DEPC=3∶1)。离心机4℃,7 500 r/min,离心5 min,弃乙醇,不要触及沉淀。将沉淀室温干燥5~10 min,加20 μL RNase Free dH2O溶解,即为RNA样本。
用NanoDropTM2000/2000c分光光度计测定 RNA 样本浓度和纯度(OD260 nm/OD280 nm);同时取 1 μL RNA 样本加入9 μL 0.1% DEPC 水中,混匀后用琼脂糖凝胶电泳仪鉴定 RNA 完整性。

表1 内参及目的基因引物序列Tab.1 List of primers of the reference and target gene
1.6 蚊第1链 cDNA 合成
实验按照 PrimeScriptTM RT Master Mix (Perfect Real Time)说明书操作。按照5×PrimeScript RT Master Mix 2 μL+总RNA 500 ng,并补充RNase Free dH2O至10 μL配置反转录体系。轻柔混匀后按如下条件进行反转录反应:37 ℃ 15 min;85 ℃ 5 s。将获得的反应液稀释 40 倍,用于后续荧光定量PCR 反应。
1.7 荧光定量PCR
实验按照 Power SYBR®Green PCR Master Mix 说明书操作。使用 Primer Express 3.0 软件,根据转录组测序提供的淡色库蚊羧酸酯酶基因序列设计荧光定量PCR引物,引物由华大公司合成。引物序列见表 1。荧光定量PCR 反应体系共20 μL:包含上游引物1 μL,下游引物1 μL,cDNA稀释液8 μL,2×power SYBR Green Master Mix 10 μL。荧光定量PCR 反应条件:步骤1:50℃,2 min,1个循环;步骤2:95℃,10 min,1个循环;步骤3:95℃,15 s,60℃,1 min,40个循环;步骤4:95℃,15 s,60℃,30 s,95℃,15 s,1个循环。
1.8 荧光定量PCR 数据分析
所有荧光定量PCR 反应在 ABI PRISM 7300 PCR 仪上进行。在每轮荧光定量PCR反应完成后,添加溶解曲线分析,判断 PCR 扩增反应的特异性。选择β-actin作为内参引物。使用 2-(ΔΔCt)的方法计算羧酸酯酶基因在敏感品系和抗性品系的相对表达量(Livaketal., 2001)。实验包含 3 次技术重复及 3 次生物学重复。
1.9 统计分析
所有实验数据用3次以上独立实验的平均值±标准差表示。组间比较采用Student′st-test分析。统计学显著差异的标准是P<0.05。
2 结果
2.1 淡色库蚊实验室抗性选育品系筛选
实验室长期饲养的淡色库蚊敏感品系,利用 WHO 推荐的蚊幼虫浸渍法,测定其对溴氰菊酯杀虫剂的半数致死浓度(LC50)为 0.03 mg/L,标记为“Lab-DS”(laboratory deltamethrin-susceptible)品系;抗性品系是以敏感品系为初始种群,以半数致死浓度(LC50)的溴氰菊酯经多代筛选而成,测定其 LC50为 2.00 mg/L,标记为“Lab-DR”(laboratory deltamethrin-resistant)品系。
2.2 淡色库蚊现场种群敏感株和抗性株区分
采集蚊幼虫,在实验室饲养至成蚊。选取羽化后3 d未吸血雌蚊,采用 WHO 成蚊接触筒法(0.05%溴氰菊酯药膜)区分敏感和抗性株。现场种群的平均死亡率和敏感株平均击倒时间见表2。
2.3 蚊总 RNA 提取及质量检测
2.3.1浓度与纯度检测:本研究分别提取淡色库蚊实验室Lab-DS/DR 品系及现场种群SH-DS/DR、GD-DS/DR、HM-DS/DR、JXZ-DS/DR品系羽化后3 d雌蚊的总 RNA,并对各样本进行 RNA 浓度和纯度的检测。所有样本总RNA浓度在700~1 500 ng/μL之间,OD260 nm/OD280 nm在1.8~2.0之间。
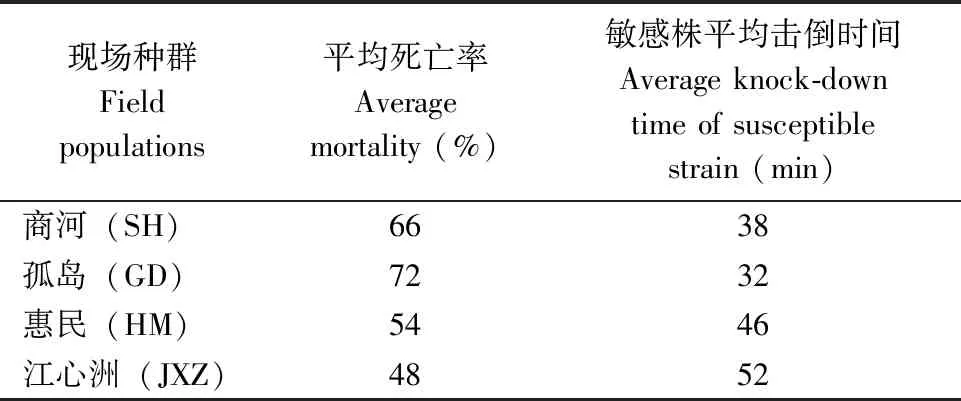
表2 现场种群平均死亡率和敏感株平均击倒时间Tab.2 The average mortality and average knock-down time of susceptible strain in field populations

图1 淡色库蚊总RNA 样本电泳图Fig.1 Total RNA electrophoretogram of Culex pipiens pallensM:DL2000 DNA Marker;1-3:实验室敏感株(Lab-DS);4-6:实验室抗性株(Lab-DR);7-9:商河敏感株(SH-DS);10-12:商河抗性株(SH-DR);13-15:孤岛敏感株(GD-DS);16-18:孤岛抗性株(GD-DR);19-21:惠民敏感株(HM-DS);22-24:惠民抗性株(HM-DR);25-27:江心洲敏感株(JXZ-DS);28-30:江心洲抗性株(JXZ-DR)。M: DL2000 DNA marker; 1-3: Laboratory deltamethrin-susceptible (Lab-DS); 4-6: Laboratory deltamethrin-resistant (Lab-DR); 7-9: Shanghe deltamethrin-susceptible (SH-DS); 10-12: Shanghe deltamethrin-resistant (SH-DR); 13-15: Gudao deltamethrin-susceptible (GD-DS); 16-18: Gudao deltamethrin-resistant(GD-DR); 19-21: Huimin deltamethrin-susceptible (HM-DS); 22-24: Huimin deltamethrin-resistant (HM-DR); 25-27: Jiangxinzhou deltamethrin-susceptible(JXZ-DS); 28-30: Jiangxinzhou deltamethrin-resistant(JXZ-DR).
2.3.2电泳鉴定:利用琼脂糖凝胶电泳鉴定所提取样本总RNA 的完整性。结果如图 1 所示,RNA 条带清晰,边缘锐利,未发生明显降解。
2.4 荧光定量PCR结果
实验室采用荧光定量PCR方法检测羧酸酯酶基因(CPIJ002786-RA)在淡色库蚊实验室品系和现场种群中的表达水平。结果显示羧酸酯酶基因(CPIJ002786-RA)在Lab-DR品系的表达水平是Lab-DS品系的2.77倍(P<0.01,图2)。在现场种群中(图3),羧酸酯酶基因(CPIJ002786-RA)在SH-DR株的表达水平是SH-DS株的3.63倍(P<0.05),在GD-DR株的表达水平是GD-DS株的5.67倍(P<0.05),在HM-DR株的表达水平是HM-DS株的2.75倍(P<0.01),而在JXZ-DR株的表达水平是JXZ-DS株的0.80倍(P>0.05)。以上结果提示淡色库蚊羧酸酯酶基因(CPIJ002786-RA)可能与溴氰菊酯抗药性密切相关,具有作为蚊抗药性现场检测靶标的潜在应用价值。

图2 羧酸酯酶基因(CPIJ002786-RA)在实验室敏感和抗性品系中的相对表达水平Fig.2 The relative expression level of carboxylesterase (CPIJ002786-RA) in laboratory deltamethrin-susceptible (Lab-DS) and -resistant (Lab-DR) strains
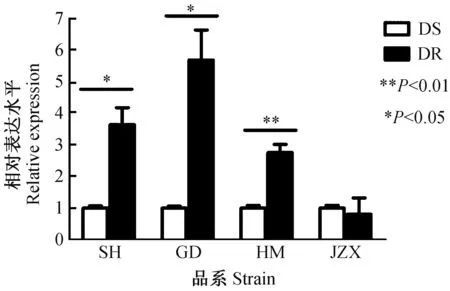
图3 羧酸酯酶基因(CPIJ002786-RA)在现场种群中的相对表达水平Fig.3 The relative expression level of carboxylesterase (CPIJ002786-RA) in field populationsDS: 敏感株; DR: 抗性株。SH: 商河; GD: 孤岛; HM: 惠民; JXZ: 江心洲。DS: Deltamethrin-susceptible strain; DR: Deltamethrin-resistant strain. SH: Shanghe; GD: Gudao; HM: Huimin; JXZ: Jiangxinzhou.
3 讨论
昆虫对杀虫剂抗药性机制一般分为代谢抗性、靶标抗性和表皮抗性(吴有刚等, 2019)。通常代谢抗性主要通过改变体内蛋白水平或增强解毒酶活性发挥作用,如细胞色素P450解毒酶、谷胱甘肽转移酶(GST)等(Zengetal., 2021);靶标抗性通过昆虫神经系统靶标位点的突变发挥作用,如钠离子通道突变(VGSC)等(Kareemietal., 2021);表皮抗性通过导致昆虫生理结构的改变,如表皮增厚,从而减少杀虫剂的吸收和渗透(Sohetal., 2021)。
在前期高通量转录组测序的研究中,我们发现羧酸酯酶基因(CPIJ002786-RA)在淡色库蚊溴氰菊酯抗性品系较敏感品系显著高表达(P<0.05)。许多昆虫羧酸酯酶被认为在催化有机磷、氨基甲酸酯类或拟除虫菊酯类杀虫剂降解过程中发挥重要作用。对3个新的羧酸酯酶基因进行分子和功能鉴定,发现其在致倦库蚊对氯菊酯抗药性过程中,通过转录过表达、代谢增强和解毒过程发挥作用。通过对两个羧酸酯酶基因CarE001A和CarE001H的功能鉴定,包括重组蛋白表达、代谢分析和同源建模与分子对接分析等,发现其在棉铃虫对拟除虫菊酯类杀虫剂的解毒过程中发挥重要作用(Lietal., 2020)。多个羧酸酯酶基因在氯菊酯抗性品系家蝇中显著高表达,同样利用同源建模与对接发现氯菊酯配体与羧酸酯酶蛋白的相互作用,进一步证实了羧酸酯酶在家蝇中的代谢功能(Fengetal., 2020)。结合本研究结果,我们预测淡色库蚊羧酸酯酶基因(CPIJ002786-RA),可能通过代谢增强参与溴氰菊酯抗药性。
前期蚊抗药性现场检测的主要方法是生物测试法。这需要从现场采集大量蚊虫样本带到实验室饲养,不仅操作复杂,且在繁殖子代进行测定时,难以控制各方面影响因素,可能降低检测结果的准确性。研究提示,CYP6AA9(Wangetal., 2015)、miRNA-278-3P(Leietal., 2015)等多个基因或调控因子可能作为蚊抗药性现场检测靶标,应用于蚊媒防治现场。
本研究证实了羧酸酯酶基因(CPIJ002786-RA)在实验室抗性选育品系较敏感品系显著高表达(P<0.01)。羧酸酯酶基因(CPIJ002786-RA)将作为潜在分子靶标,应用于蚊抗药性现场检测。在实践中,本研究发现羧酸酯酶基因(CPIJ002786-RA)在山东省商河镇、孤岛镇和惠民镇的抗性株较敏感株显著高表达(P<0.05),而在江苏省江心洲抗性株和敏感株无显著统计学差异。
不同遗传背景的蚊虫,在抗药性产生过程可能演变出不同机制,如代谢解毒基因或靶标位点突变的差异(Zhong, 2011)。由于各个国家、地区优势蚊种和使用杀虫剂种类的差别,蚊媒抗药性的产生和发展呈现不同水平,在分子水平则表现为不同抗药性相关基因的差异表达(Bonizzonietal., 2012)。本实验室筛选的实验室品系来源于山东唐口镇,与商河镇、孤岛镇和惠民镇同属于山东省,地理位置上相距较近,因此羧酸酯酶基因(CPIJ002786-RA)的表达趋势较为一致,即抗性株较敏感株显著高表达(P<0.05),而在江苏省江心洲无显著统计学差异,可能是抗药性机制不同所致,江苏省江心洲与上述4个地点地理位置上相距较远,蚊虫遗传背景差异较大,使用的杀虫剂种类差别也较大等因素,羧酸酯酶基因(CPIJ002786-RA)可能不是其主要的调控因素。
综上所述,淡色库蚊羧酸酯酶基因(CPIJ002786-RA)可能与溴氰菊酯抗药性密切相关,具有作为蚊抗药性现场检测靶标的潜在应用价值,但同时也受到不同地区蚊虫遗传背景差异的影响,需要综合考量。

