基于酶切探针等温扩增技术快速检测汉坦病毒S4亚型方法的建立*
李家樵 艾乐乐 朱长强 张灵玲 王华贵罗艺哲 唐 奇 周 杨 谭伟龙**
(1.东部战区疾病预防控制中心,江苏南京 210002;2.福建农林大学,福建福州 350002;3.江苏宏微特斯医药科技有限公司,江苏南通 226000)
汉坦病毒(hantavirus,HV)是在上个世纪 50 年代首次在朝鲜发现的,导致3 000 多名联合国士兵患上了“朝鲜出血热”,后确定为肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)。该病于1993年第二次暴发于美国四角地区,最初被称为四角病,现在被称为汉坦病毒肺综合征(hantavirus pulmonary syndrome,HPS)(Jonssonetal.,2010; Zhangetal.,2015)。HV 是一种人畜共患病病原体,以啮齿动物、蝙蝠、鼹鼠和地鼠等小型哺乳动物作为自然宿主和主要传染源 (Witkowskietal.,2016),仅在阿根廷的安第斯病毒(ANDV)中证实了人与人之间的传播(Martinez-Valdebenitoetal.,2014),能通过宿主的排泄物或飞沫向人类传播,其感染传播的风险覆盖全球大多数国家和地区,有报道表明,目前全球分布的汉城病毒是褐家鼠迁移传播的结果(Himsworthetal.,2013)。汉坦病毒引起的病例在全世界每年报告超过 20 万例,随着时间的推移和自然宿主的大量繁殖,这个病例数量还在不断的增加(Watsonal., 2014)。HFRS 的病死率在 5%~15% 之间,HPS 的病死率则高达40%(Liuetal., 2019),HFRS 是由汉滩型 (Hantan virus,HTNV)、汉城型 (Seoul virus,SEOV)、普玛拉型 (Puumala virus,PUUV)和多不拉伐型 (Dobrava virus,DOBV)等几种正汉坦病毒引起的,而无名病毒(Sin Nombre virus,SNV)和纽约病毒(New York virus,NYV)与 HPS 有关(Zelenetal., 2013; Reynesetal., 2015),其中 HFRS 多发于欧亚大陆,HPS 多发于美洲地区(Lietal.,2011)。在亚洲,主要流行的是汉滩型病毒(HTNV)和汉城型病毒(SEOV),其中 HTNV 型可分为 9 个亚型,SEOV 型则有 4~6 个亚型,其中S4亚型作为6个已知亚型种类的主要亚型之一,除了西藏高原地区,分布于我国国内的大部分地区,在新疆等沙漠地带也出现了该亚型引起的病例,并且作为东南沿海地区的主要HV流行亚型,其危害和肆虐程度在近年来逐渐引起人们的重视。目前,无论是HFRS还是HPS都没有有效的治疗方法,仅有的针对HTNV或SEOV的全病毒灭活疫苗虽然已经在国内实施接种,但偶尔发病率还是会出现一定幅度的波动(Tianetal.,2019)。所以及时发现并预防汉坦病毒的传播就尤为重要,而我国流行的部分 HV 基因型或相关亚型尚缺乏快速诊断检测方法,不能快速确定人群感染亚型并进行病原体溯源,有待对此建立特异灵敏的检测手段。
基因检测被广泛用于检测病毒和其他病原微生物(Tomitaetal.,2008),聚合酶链式作为最常用的检测手段,其复杂多样的操作过程却是一个不可忽视的缺点。随着技术的发展,近些年已经出现了一类成熟的等温扩增技术,不仅在实验操作和条件上的要求较低,其灵敏度和稳定性也非常可靠。酶切探针等温扩增技术(Enzymatic Probe Isothermal Amplification,EPIA)是一种能够在等温条件下实现核酸扩增的新型分子生物学检测方法,该方法依据靶序列设计特异性的等温扩增引物和 rProbe 探针,其中 rProbe 两端分别设计荧光基团和淬灭基团。利用 DNA 聚合酶的活性扩增待测目标核酸序列,同时 rProbe 结合到相应的待测目标序列上,形成探针-目标核酸杂交双链,再通过 RNaseH 切割探针-目标核酸杂交双链中的 RNA 碱基,使得 RNA 碱基及其右侧含有淬灭基团的探针片段游离出去,而在 RNA 碱基左侧的含有荧光基团的片段仍然保持形成杂交链且可作为引物继续延伸,同时荧光基团发出荧光(图1)。通过判断扩增信号来指示靶标核酸的有无。它具有检测效率高、操作简便、不依赖于复杂昂贵的PCR仪等设备的技术优势,有望成为特异、灵敏的HV检测技术。本文基于该技术原理,针对汉城病毒 S4 亚型的核酸保守S区域设计了特异性的等温扩增引物和 rProbe 探针,用靶基因合成质粒梯度稀释对该方法进行灵敏度和重复性验证,并用人源其他亚型HV进行特异性验证。

图1 EPIA扩增原理(Tomita et al., 2008)Fig. 1 Principle of Enzymatic Probe Isothermal Amplification(Tomita et al., 2008)A: 起始结构的产生; B: 循环起始复合物形成; C: 循环扩增阶段。A: The creation of the starting structure; B: Cycle initiation complex formation; C: Cycle amplification stage.
1 材料与方法
1.1 样本选择及基因合成
采用实验室保存并完成测序的SEOV 80~39 的 S、M、L 三段序列作为研究的靶序列,另外从 GenBank 下载 SEOV S4 亚型不同毒株的3段序列,应用生物学软件分别进行比对,发现 S 段由于在3段中保守性最高且序列信息最全,因此选择汉城 S4 亚型 S 基因作为本检测体系的靶基因(GenBank:AY273791.1,位置:850~1 769 bp)。 临床样本的验证选用来自实验室保存的8例阳性病毒作为临床样本(表4)。
1.2 主要试剂
Bst X DNA聚合酶(TIANSeq Bst X DNA Polymerase)、dNTP Mixture(10 mmol/L)、RNA 酶(RNaseH)、甜菜碱溶液(PCR级)(5 mmol/L Betaine Solution(PCR Grade))、逆转录酶(Hiscript II Reverse Transcriptase)和去离子水(deionized water)均购自天根生化科技(北京)有限公司;0. 22 μm针头滤器和1.5 μL 离心管购自 Millipore 公司;DMEM 培养基购自赛百慷(上海)生物技术股份有限公司;RNA 提取试剂盒(RNeasy RNA 纯化试剂组-Mini,Cat no.74106)购自QIAGEN公司。
1.3 样本处理
将编码 MS2 噬菌体相应蛋白的 cDNA 序列连接到原核表达载体(PET-42a)启动子下游,成功构建了表达载体 pNCCL(pET42-CP),然后将汉城病毒 80~39 的 cDNA 序列构建于表达载体中的 MS2 噬菌体包膜蛋白基因序列下游。取 50 μL 菌液加入到 5 mL 的 LB 液体培养基中,37 ℃,220 r/min,震荡培养3 h到对数生长期,向其中加入 IPTG,使其终浓度为 1 mmol/L,37 ℃,200 r/min,孵育 3 h;收集细胞,加入 0.5 mL 超声缓冲液,冰上超声:350 W,停 5 s,超声 5 s,30 个循环。随即 6 000 r/min,离心 10 min,收集上清,得到假病毒溶液,使用 RNA 提取试剂盒提取具有耐 RNase 特性的内含外源 RNA 序列的病毒样颗粒,用于后续靶标检测的验证。
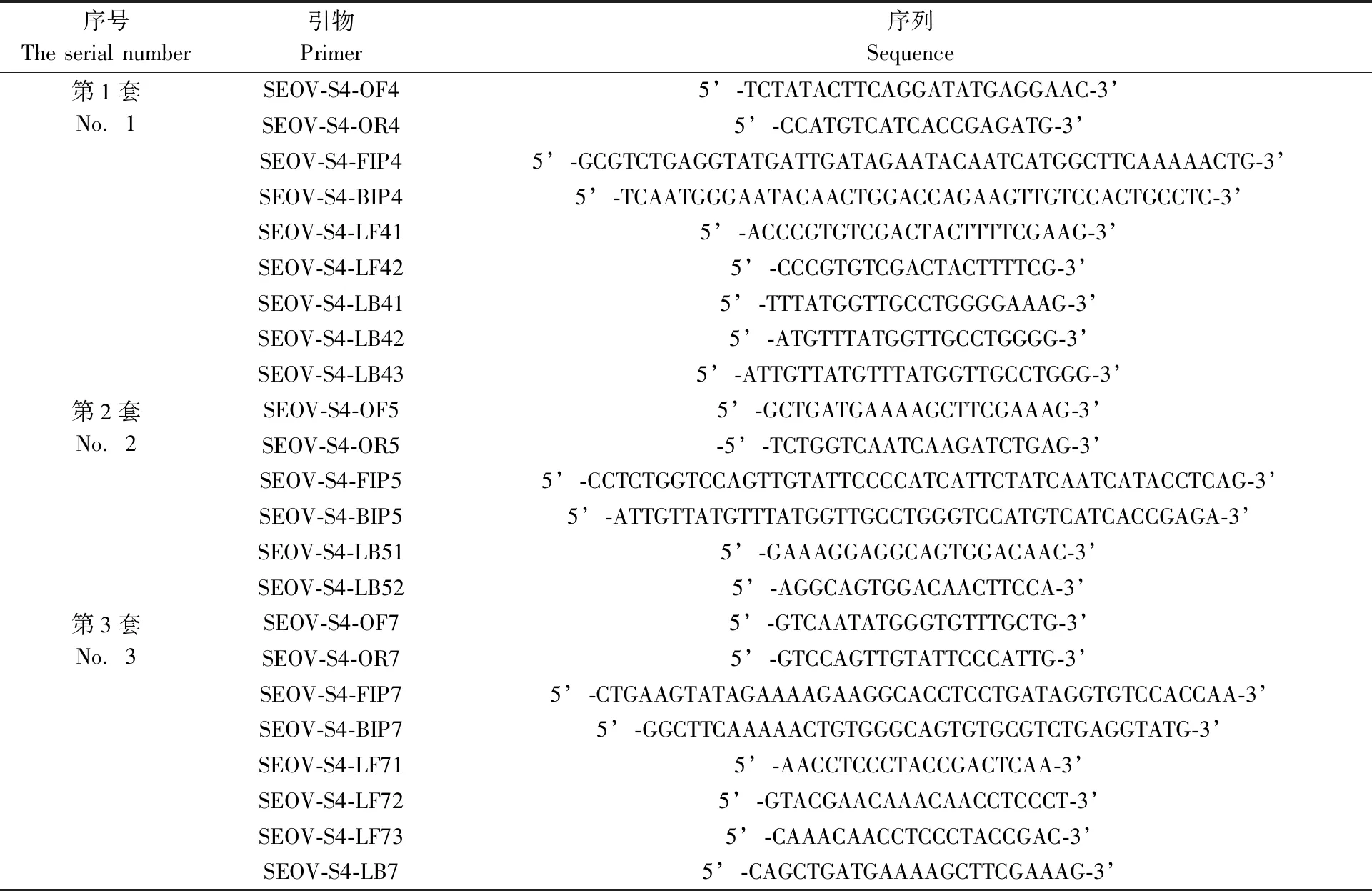
表1 酶切探针等温扩增技术使用的引物Tab.1 The primers used in the Enzymatic Probe Isothermal Amplification

表2 用以优化筛选结果的外源内参引物探针Tab.2 Exogenous internal reference primer probe to optimize screening results
1.4 引物设计与筛选
根据选定的汉坦病毒 S4 靶序列进行引物设计,共设计8套引物,经灵敏度与特异性验证,最终筛出3套引物(表 1)的灵敏度与特异性相较于其他引物具有更好的数值。并针对设计的3套引物体系设计4 条探针,经灵敏度和特异性验证,筛选出探针SEOV-S4-S-RNHLB51(5’-GAAAGGAGGCAGTGGACAAC-3’)的灵敏度与特异性好于其他 3 条探针,其灵敏度可以达到 10 copies/μL,且无非特异扩增。
1.5 实验体系的优化
以实验室已有的外源内参体系(表 2)做为体系内参,通过内参引物的校正作用进行优化筛选。由于本实验所用内参为外源内参,所以在样本提取时需要向样本中加入外源内参的假病毒进行共提取,最后提取浓度为 2 000 copies/mL 的 RNA,并取3条内参引物(WNC-FIP/WNC-BIP/WNC-LB)及1条探针(WNC-RNHP)的形式组建二重检测体系里的内参扩增(表 3)。利用荧光定量 PCR 仪进行实验,温度经过前期 EPIA 技术建立时在(60~65)℃之间的温度优化,确立了最优温度 63℃,反应程序设置为 63℃ 1 min,40 个循环,收集荧光(FAM,CY5),结果分析时根据其Ct值进行判定。结果判定的规则:靶标阳性:FAM 通道Ct≤ 38,CY5 通道无需参看;靶标阴性:FAM通道Ct> 38,且 CY5 通道Ct< 40;检测无效:FAM 通道Ct> 38 或者无扩增信息,且 CY5 通道无扩增信号,此种情况时,需要重新提取样本,进行复测。

表3 加入外源内参组建形成的二重反应液体系Tab.3 Double reaction liquid system formed by adding exogenous internal reference
1.6 灵敏度稳定性检测与特异性检测
灵敏度稳定性检测:将检测的靶基因进行质粒合成,提取质粒,计算浓度后,将其梯度稀释成10和 5 copies/μL,用体系检测质粒各梯度稀释液,观察其检测结果并筛选优化;特异性检测:通过所建立的 EPIA 二重反应液体系对人源、金黄色葡萄球菌、鲍曼不动杆菌、结核分枝杆菌、人源冠状病毒(OC43、NL63、HKU1、229E)等物种与其他病原体的RNA核酸进行特异性检测,其中包括 6 株汉滩病毒和两株其他相关病毒(表4)。
2 结果
2.1 EPIA检测的灵敏度
提取靶基因构建质粒作为模板在 LOD 处进行20次重复灵敏度实验,结果发现,在 63 ℃恒温条件下,随着时间的推移,其内部反应探针均在 35 min内开始水解产生荧光,并随时间推移强度逐步增加;在 10 copies/μL 下可稳定扩出结果。EPIA 技术为非线性扩增,低限检测时,扩出Ct值范围较大,20次最低检测限的扩增如图3所示。

表4 八例阳性临床病毒样本信息Tab.4 Information on 8 positive clinical virus samples
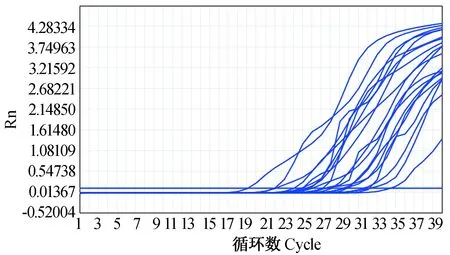
图2 假病毒20次重复灵敏度稳定性检测结果Fig. 2 Fake virus 20 repeated sensitivity and stability test results
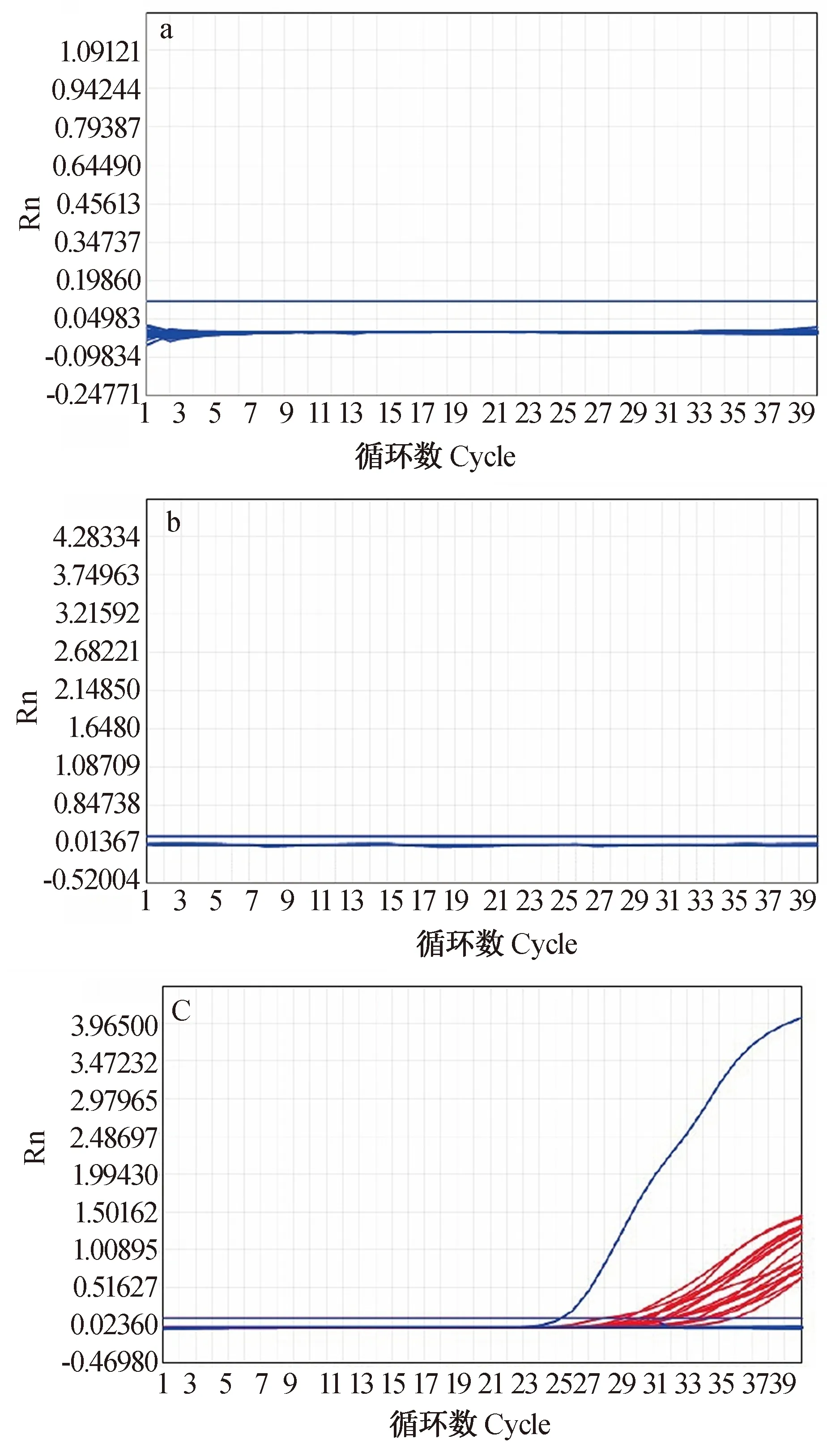
图3 特异性检测结果Fig. 3 Specific test resultsa: 人源基因对照检测结果;b: 空白对照检测结果;c: 8 例阳性临床样本检测结果a: Human gene control results;b: Blank control result;c: Results of 8 positive clinical samples
2.2 EPIA检测的特异性
利用人源基因组作为对照验证 EPIA 法的特异性,选取了等量的人源基因组作为模板进行特异性检验(图3),另外设立空白对照组,同时对 8 例阳性临床样本进行临床验证(图4),靶标通道(FAM)均无扩出。

图4 阳性对照检测结果Fig.4 Positive control test result
2.3 阳性质控验证
将获得的假病毒溶液梯度稀释后,提取 RNA,选择 Tt 值在 15~20 的假病毒稀释度作为阳性质控品中假病毒溶液的浓度。将假病毒溶液与内参质粒混合,此混合溶液中假病毒溶液的终浓度需与上述的假病毒的稀释度一致,此混合溶液中内参质粒的终浓度为 103copies/μL,则此混合溶液即为最终获得阳性质控。利用内参引物建立二重检测体系,以构建的假病毒颗粒作为阳性质控提取的 RNA 做为模板进行实验检测,靶标通道扩增结果如图4所示,在 20 min左右的时间内探针开始溶解产生荧光,经过校正的阳性信号从 0 增至 0.42。
3 讨论
基因诊断技术因其灵敏度和特异性高,在被发明后的数十年间迅速发展,已经替代基于蛋白质的技术,成为病原体诊断的主流检测手段(Gaoetal.,2008)。核酸检测不但能够检测微量的 DNA 或 RNA,而且可以对那些难以用标准组织学方法培养或确定的生物进行有效且准确的鉴定。相较于抗原和抗体的检测,核酸检测更具有能够识别感染性生物的抗病毒抵抗力和基因组序列的优势,对生物领域和预防控制流行病方面都具有非常重要的意义。聚合酶链式反应(Polymerase chain reaction,PCR)是目前使用最为广泛的核酸扩增技术,PCR 技术包括常规 PCR、nPCR、qPCR 和多重 PCR(Ockeretal.,2016),但这些方法需要使用 PCR 仪、 电泳仪等仪器,并且在实验过程中需要对温度进行升降调节,不够便捷且成本高,难以在条件不充分的现场大规模快速应用,这也是目前普通 PCR 技术所无法逾越的局限性。经过长时间的沉淀和发展,等温扩增技术(Isothermal amplification technology)是一种可在恒定温度下,通过一些特殊的酶使 DNA 双链解旋,并促使特异性 DNA 片段扩增,以达到核酸体外扩增效果的技术。该技术消除了对热循环仪的需求,从而简化和加快了诊断过程(Huangetal.,2020),对于核酸的检测具有相当高的灵敏度。各种分支技术包括依赖核酸序列扩增(NASBA)、依赖解旋酶扩增(HDA)、环介导等温扩增(LAMP)和近年来较为新颖且更具优势的 RPA 、 RAA等,其中环介导等温扩增技术在近些年已经应用于病毒、细菌和疟疾等病原体检测(Subsoontornetal.,2020)。
中国是汉坦病毒流行的重要疫区,在东南沿海广泛流行的汉城病毒 S4 亚型更是依靠着其地理环境条件的优越性不断肆虐,由于沿海地区港口发达、社会发展迅速和老鼠、蝙蝠等宿主的繁殖扩张,病毒的传播风险也大大增加,其潜在的威胁值得我们去关注。本研究利用酶切等温探针检测技术的原理,选取了汉城病毒 S4 亚型中序列信息较为保守的 S 片段建立了一种快速检测汉城病毒 S4 亚型的方法,该方法的灵敏度可达到 10 copies/μL,相较于普通的 PCR 方法其检测极限要高 100 倍,同时扩增稳定且具有反应速度快、条件简单的特点。EPIA 技术的本质是酶促反应,通过酶的作用来推动多重 PCR 中模板链的反复扩增。而这个方法与 LAMP 技术相类似,由于特殊的设计思路,其实验体系的一套引物中含有多对引物,分别对应不同的区域,所以当任一对引物与靶标模板不匹配时,反应就无法顺利进行。而且,反应中的环境和操作等相关因素也会影响结果的准确性,为了减少误差并校准实验结果,避免不必要的假阳性,本研究通过加入外源内参引物调整并降低不同因素所带来的影响,进行二重检测体系的优化筛选很好的解决了这一问题。
本研究进行了灵敏度稳定性的检测,并对人源基因和8 例阳性临床样本进行了特异性验证,检测结果除阳性对照外靶标通道(FAM)均无特异性扩出(图3),表明本体系无人源非特异扩出,排除了本设计与人源基因组的交叉反应。临床样本中包含了汉滩病毒和其他相关病毒,进一步表明了该方法检测的特异性,具有一定的临床应用价值,符合实际情况。
本研究证实了 EPIA 法是一个简便高效的针对汉城病毒 S4 亚型进行的检测方法。通过科学地探针设计,本技术还可推广应用至生物传感器、免疫层析胶体金等多种技术领域(Gaoetal.,2008),使该方法在分子生物学中得到更广泛的应用。

