溴氰菊酯降解菌的分离与鉴定及其降解特性
(西华大学生物工程学院,四川 成都 610039)
溴氰菊酯(Deltamethrin),又名“敌杀死”,是目前拟除虫菊酯类杀虫剂中用量增长最快的杀虫剂之一[1],也是其中毒力最高的一种。溴氰菊酯在杀灭害虫方面具有广谱、高效等特点,所以广泛用于农业灭害、卫生除虫等方面[2];但其在农业或环境中的长期广泛施用易造成在农产品或土壤中的蓄积及残留[3-4],因此,消除或减少溴氰菊酯农药在环境及农产品中的残留非常有必要。由于利用微生物降解农药残留具有安全、高效、无二次污染等优点[5-6],拟除虫菊酯类农药尤其是溴氰菊酯的生物降解特性因而成为研究热点。目前,已分离得到的溴氰菊酯降解菌有荧光假单胞菌(P.Fluorescens)、普成沙雷氏菌(Serratiaplymuthica)、产碱杆菌(Alcedinidae)等[7-10]。本研究以长期施用溴氰菊酯的茶园土壤作为菌源,分离驯化得到一株能有效降解溴氰菊酯的菌株DXQ018,通过生理生化和16S rDNA分析进行菌株鉴定,并对菌株DXQ018降解溴氰菊酯的特性进行研究。研究结果丰富了溴氰菊酯降解菌资源库,同时为进一步研究其降解机制奠定了基础。
1 材料与方法
1.1 材料与仪器
1.1.1 菌源
以长期施用溴氰菊酯农药的茶园土壤作为菌源。
1.1.2 试剂
溴氰菊酯标准品(质量分数99.7%,国家标准物质中心),溴氰菊酯原农药(质量分数96.8%,南京荣诚化工公司),乙腈(色谱纯,Adamas试剂公司),溶菌酶、Bacteria DNA Kit提取试剂盒等(天根生化科技有限公司),其余试剂为国产分析纯。
1.1.3 农药母液
用无水乙醇将一定量的溴氰菊酯原农药溶解并定容至质量浓度为10 g/L的溶液。
1.1.4 仪器
Waters高效液相色谱仪(美国Waters公司),MyCycler PCR仪,凝胶成像系统(Bio-RAD),PowerPac Basic电泳仪。
1.2 培养基
1.2.1 基础盐培养基(MM)[11]
KH2PO40.5 g,K2HPO41.5 g,NaCl 0.5 g,(NH4)2SO41.5 g,MgSO40.2 g,蒸馏水 1 000 mL,添加适量溴氰菊酯母液至所需浓度,pH 7.5,121 ℃灭菌15 min,添加1.5%(质量分数)琼脂粉为对应固体培养基。
1.2.2 LB培养基[11]
酵母膏5.0 g,胰蛋白胨10.0 g,氯化钠 10.0 g,蒸馏水1 000 mL,添加适量溴氰菊酯母液至所需浓度,pH 7.0,121 ℃灭菌15 min,添加1.5%(质量分数)琼脂粉为对应固体培养基。
1.3 降解菌的分离与筛选
1.3.1 降解菌的分离
取5.0 g菌源土样加入分别含100 mg/L溴氰菊酯的MM和LB培养基中(三角瓶装液量为20 mL/100 mL)30 ℃恒温振荡(180 r/min)培养5 d。按5.0%(体积分数)的比例,将培养液接入溴氰菊酯质量浓度为200 mg/L的MM或LB培养基中恒温振荡(30℃,180 r/min)培养5 d。重复前述操作,顺次于含400、600 mg/L溴氰菊酯的同类型培养基中继代培养。取最末级培养液进行适当稀释,于MM和LB平板上(溴氰菊酯质量浓度为100 mg/L)涂布,恒温(30 ℃)培养3 d后挑取单菌落进行划线分离直至得到单菌落,将得到的纯化菌株用甘油于-80 ℃冷冻保存。
1.3.2 降解菌的筛选
降解体系中溴氰菊酯的残留量通过HPLC法检测,空白对照为添加同浓度溴氰菊酯未接菌的培养液,通过计算溴氰菊酯的降解率,筛选得到对其有降解作用的菌株。
降解率/%= [(x0-x1)/x0]×100
(1)
式中:x0为空白对照中溴氰菊酯质量浓度(μg/mL);x1为降解体系中溴氰菊酯残质量浓度(μg/mL)。
1.4 降解菌的鉴定
理想降解菌株的形态学和生理生化特征参照《常见细菌系统鉴定手册》进行检测[12];其16S rDNA系统发育分析参照文献[11]方法进行,菌株系统发育树的构建采用MEGA 4.0软件。
1.5 溴氰菊酯的检测
样品前处理参照文献[13]方法进行,样品检测采用HPLC;色谱条件为[11]:Comatex C18柱(5.0 μm,150 mm×4.60 mm),流动相为乙腈-超纯水(85∶15,V/V),流速为1.1 mL/min,柱温为25 ℃,检测波长为210 nm,进样量为10 μL。根据标准曲线方程Y=9 664.6X-5 186.1(R2=0.999 9)计算溴氰菊酯的降解率。
1.6 理想降解菌株对溴氰菊酯的降解特性研究
1.6.1 培养温度对菌株降解溴氰菊酯能力的影响
取理想菌株的菌悬液(OD600=1.5),以5%(体积分数)的接种量接种在溴氰菊酯质量浓度为20 mg/L的LB培养基中,采用不同培养温度(28、30、35、37、40 ℃)恒温摇床(180 r/min)培养3 d,以不接菌的空白培养基作对照;通过检测菌株的生长量OD600和溴氰菊酯的降解率,以考察培养温度对其降解能力的影响。
1.6.2 培养基初始pH对菌株降解溴氰菊酯能力的影响
调节LB培养基初始pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0,取理想菌株的菌悬液(OD600=1.5),以5%(体积分数)的接种量接种在溴氰菊酯质量浓度为20 mg/L的LB培养基中,37 ℃恒温摇床(180 r/min)培养3 d,以不接菌的空白培养基做对照;检测培养终点降解体系中菌株生长量OD600及溴氰菊酯降解率。
1.6.3 不同底物质量浓度对菌株降解溴氰菊酯能力的影响
取理想菌株的菌悬液(OD600=1.5),以5%(体积分数)的接种量分别接种到溴氰菊酯质量浓度为10、20、40、50、100、200 mg/L的LB降解体系中,37 ℃恒温摇床(180 r/min)培养3 d,以不接菌的空白培养基作对照;检测培养终点降解体系中菌株生长量OD600及溴氰菊酯降解率。
2 结果与讨论
2.1 降解菌的形态及生理生化特性
通过溴氰菊酯降解率的测定,从经富集驯化后的菌源微生物中筛选得到8株对其有较高耐受性且有一定降解作用的菌株,其中菌株DXQ018对MM和LB降解体系中20 mg/L溴氰菊酯的降解率在培养5 d后分别达到28.7%和49.6%。该菌株的菌落表面光滑、湿润、不透明,边缘较整齐,菌落突起呈白色。菌株DXQ018的生理生化特征如表1所示。

表1 菌株DXQ018 的生理生化特征
注:“+”为阳性;“-”为阴性。
2.2 菌株的系统发育树
将菌株DXQ018经PCR扩增的16S rDNA片段提交到GenBank数据库,经BLAST比对发现,该菌株的16S rDNA与醋酸钙不动杆菌(Acinetobactercalcoaceticus)相似度达99%以上,选取Genbank数据库中与菌株DXQ018的16S rDNA基因序列相似性较高菌株的序列,采用邻近法构建菌株DXQ018的系统发育树(如图1所示),结合菌株形态学及其生理生化特征将其鉴定为醋酸钙不动杆菌(Acinetobactercalcoaceticus)。醋酸钙不动杆菌多被报道为苯酚等芳香族化合物的降解菌[14-15];刘婷婷等[16]筛选到一株醋酸钙不动杆菌S8可高效降解联苯菊酯;实验筛选得到的醋酸钙不动杆菌DXQ018是首次报道的可降解溴氰菊酯的不动杆菌。

图1 菌株DXQ018的系统发育树
2.3 醋酸钙不动杆菌DXQ018对溴氰菊酯的降解特性
2.3.1 醋酸钙不动杆菌DXQ018降解溴氰菊酯的适宜培养温度
不同培养温度对菌株DXQ018降解溴氰菊酯的影响如图2所示。由图2可知,菌株DXQ018在不同培养温度下的生长量与溴氰菊酯的降解率基本成正比关系,即菌株生长量最大时,溴氰菊酯的降解率最大。在28~40 ℃培养温度范围内,温度过低或过高均不利于菌株DXQ018的生长,因而会影响其降解酶的分泌导致其降解率偏低;因此,当培养温度为37 ℃时,菌株DXQ018对溴氰菊酯的降解率最大为55.63%,此培养温度是其适宜的培养温度。

图2 培养温度对醋酸钙不动杆菌DXQ018降解溴氰菊酯的影响
2.3.2 醋酸钙不动杆菌DXQ018降解溴氰菊酯的适宜pH
培养基初始pH对菌株DXQ018降解溴氰菊酯的影响如图3所示。由图可知,菌株DXQ018在不同pH环境中对溴氰菊酯的降解呈现先增加后减小的趋势。当培养基初始pH偏酸(pH 3~4)或偏碱(pH 8~9)时,菌株DXQ018的生长量和溴氰菊酯的降解率都偏低。菌株DXQ018较适宜的生长pH范围为5~7,而当培养基初始pH为7时,菌株DXQ018的生长量最大,同时溴氰菊酯的降解率最高为56.15%;因此,培养基初始pH 7是菌株DXQ018降解溴氰菊酯的适宜pH。
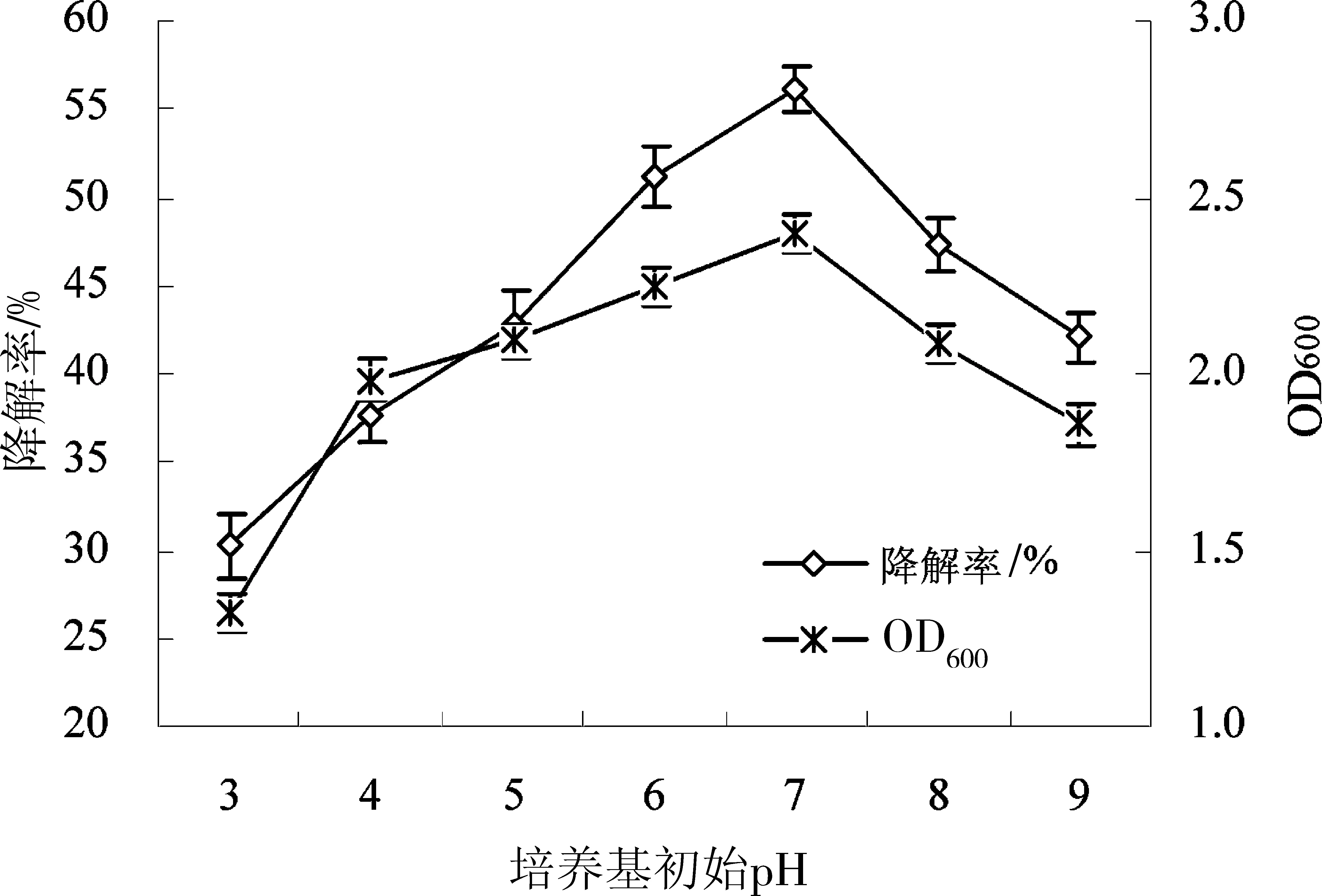
图3 培养基初始pH对醋酸钙不动杆菌DXQ018降解溴氰菊酯的影响
2.3.3 醋酸钙不动杆菌降解溴氰菊酯的适宜底物质量浓度
不同底物质量浓度对菌株DXQ018降解溴氰菊酯的影响如图4所示。由图4可知,当底物质量浓度为10~50 mg/L时,菌株DXQ018的生长量差异不大;当底物质量浓度为100 mg/L以上时,溴氰菊酯对菌株DXQ018的生长表现出一定的抑制作用。当底物质量浓度为20 mg/L时,菌株DXQ018对溴氰菊酯的降解率最高为58.27%。当溴氰菊酯质量浓度过低时,底物对菌株分泌降解酶的诱导能力不足,而过高的底物质量浓度可能会对菌体生长产生抑制作用从而减少降解酶的分泌;因此,20 mg/L是菌株降解氯氰菊酯较适宜的底物质量浓度。

图4 底物质量浓度对醋酸钙不动杆菌DXQ018降解溴氰菊酯的影响
3 结论
从茶园土壤中分离到一株能高效降解溴氰菊酯的菌株DXQ018,通过对菌株的形态、生理生化及16S rDNA特征进行分析,将其鉴定为醋酸钙不动杆菌。菌株DXQ018在不同条件下表现出对溴氰菊酯不同的降解特性,培养温度、培养基初始pH和底物质量浓度对其降解溴氰菊酯表现出不同影响;实验结果显示,醋酸钙不动杆菌DXQ018降解溴氰菊酯的适宜培养温度为37 ℃,适宜培养基初始pH为7,适宜底物质量浓度为20 mg/L;在此条件下培养3 d,菌株DXQ018对溴氰菊酯的最高降解率达到58.27%;其降解效率高于已报道的溴氰菊酯降解菌阴沟肠杆菌X09[17]、荧光假单胞菌X20[17]和地衣芽孢杆菌qw5[18],表明菌株DXQ018在未进行条件优化的情况下已具备较好的溴氰菊酯降解能力。
[1]迟恒,李健,王吉桥,等. 水环境中低浓度溴氰菊酯的降解规律及其动力学研究[J]. 农业环境科学学报, 2007,26(5):1725-1728.
[2] 王险峰. 进口农药应用手册[M].北京:中国农业出版社,1989:141- 147.
[3]Emmanouil C, Euphemia P. Occurrence of Pesticides in Rain of the Axios River Basin, Greece[J]. Environmental Science and Technology, 1999, 33 (14): 2363-2368.
[4]Zhang Z Y, Liu X J, Yu X Y, et al. Pesticide Residues in the Spring Cabbage (Brassica oleracea L. var. capitata) Grown in Open Field[J]. Food Control, 2007, 18 (6): 723-730.
[5]Singh B K, Walker A. Microbial Degradation of Organophosphorus Compounds[J]. FEMS Microbiology Reviews, 2006, 30 (3) : 428-471.
[6]岳松. 微生物絮凝剂在废水处理中的应用[J]. 西华大学学报:自然科学版, 2006, 25(4):44-46.
[7]Grant R J, Daniell T J, Betts W B. Isolation and Identification of Synthetic Pyrethroid-degrading Bacteria [J]. Journal of Applied Microbiology, 2002, 92(3): 534-540.
[8]Grant R J, Betts W B. Biodegradation of the Synthetic Pyrethroid Cypermethrin in Used Sheep Dip[J]. Letters in Applied Microbiology, 2003, 36(3): 173-176.
[9]Grant R J, Betts W B. Mineral and Carbon Usage of two Synthetic Pyrethroid Degrading Bacterial Isolates [J]. Journal of Applied Microbiology, 2004, 97(3): 656-662.
[10]Bolognesi C, Morasso G. Genotoxicity of Pesticides: Potential Risk for Consumers[J]. Trends in Food Science &Technology, 2000, 11(5): 182-187.
[11]唐洁, 姚开, 贾冬英,等. 高效氯氰菊酯降解菌的分离与鉴定及其降解条件优化[J]. 四川大学学报:工程科学版, 2013, 45(4):176-180.
[12]程仕伟, 崔海洋, 黄田红,等. 产纤维素酶枯草芽孢杆菌B29 的鉴定与培养条件研究[J]. 西华大学学报:自然科学版, 2013, 32(3):94-97.
[13]刘书亮, 姚开, 贾冬英,等. HPLC法检测米曲霉降解体系中氯氰菊酯前处理方法的研究[J]. 四川大学学报:工程科学版, 2011, 43 (7) : 179-183.
[14]陈明, 张维, 徐玉泉,等. 醋酸钙不动杆菌PHEA-2对苯酚的降解特性研究[J]. 中国环境科学,2001, 21(3): 226-229.
[15]彭子欣, 于海英, 战嵛华,等. 醋酸钙不动杆菌PHEA-2苯酚降解调控蛋白MphR化学信号域的研究[J]. 生物技术通报, 2010(10):86-91.
[16]刘婷婷, 董昆明, 缪莉,等. 联苯菊酯降解菌的筛选、鉴定及降解特性研究[J]. 农业环境科学学报, 2012, 31(6):1147-1152.
[17]杨晓棠. 溴氰菊酯降解菌的筛选及降解特性研究[D]. 长春:吉林农业大学, 2008.
[18]丁海涛, 李顺鹏, 沈标,等. 拟除虫菊酯类农药残留降解菌的筛选及其生理特性研究[J]. 土壤学报, 2003, 40(1):123-129.

