一株溴氰菊酯降解菌的分离鉴定及降解特性研究
苏志俊,刘永涛,徐春娟,丁 浩,余琳雪,艾晓辉
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院长江水产研究所,武汉 430223;3.农业部水产品质量安全控制重点实验室,北京 100141;4.淡水水产健康养殖湖北省协同创新中心,武汉 430070)
溴氰菊酯(Deltamethrin,DM)又名敌杀死,是拟除虫菊酯中杀虫活性最大的一个品种[1]。因其具有较高的生物活性,自1974年开发生产以来在世界范围内应用广泛,在国内是用量增长最快的农药之一[2]。溴氰菊酯凭借其广谱、高效、对哺乳动物低毒等优点,普遍应用于农业灭害、卫生除虫[3],其通过雨水、生活废水等途径进入天然水体中,造成污染。近年来水产养殖生产中利用溴氰菊酯防治常见淡水鱼类体表锚头鳋(Lernaeacyprinacea)、中华鳋(Sinergasilus)、鱼虱(Argulusjaponicus)等寄生虫[4],效果显著。随着溴氰菊酯用量的增加,其在渔业水域中的残留也越来越大,对水环境造成很大危害,且第二代拟除虫菊酯类杀虫剂具有耐光、耐热等特点,在环境中残留时间更长,对鱼类等水生生物高毒[5],很容易导致养殖事故。因此,消除或减少溴氰菊酯农药在水环境中的残留非常有必要。
微生物修复具有高效、无毒、无二次污染等优点,且易于操作,成本较低,目前已成为去除农药残留污染的一种重要方法[6]。已分离得到的溴氰菊酯降解菌有荧光假单胞菌(P.Fluorescens)、普成沙雷氏菌(Serratiaplymuthica)、产碱杆菌(Alcedinidae)等[7-9]。通过降解菌对蔬菜、土壤的农药残留进行生物修复的研究较为普遍。丁海涛等[10]发现菌株qw5对青菜中残留的氯氰菊酯和氰戊菊酯有明显去除效果。杨晓棠[11]将菌株X20与溴氰菊酯混和喷施油菜盆栽处理7 d,降解率达65%以上。Hong等[12]发现甲氰菊酯降解菌Sphingomonassp.能够高效降解土壤中的甲氰菊酯。然而,淡水环境及沉积物中拟除虫菊酯类农药降解菌的筛选、降解机制等尚未有系统研究。本研究通过富集筛选的方法分离得到一株溴氰菊酯降解菌SW,研究温度、pH、接种量、药物初始浓度等因素对其降解特性的影响,并进一步研究此菌株对养殖淡水中溴氰菊酯的生物修复效果,为建立有效地去除淡水养殖环境中溴氰菊酯残留的微生物修复技术,保护淡水环境、治理养殖环境农药残留污染提供理论和技术支持。
1 材料与方法
1.1 实验材料
1.1.1 培养基和养殖淡水
基础盐培养基(g/L):NaCl 1.0,(NH4)2SO41.0,K2HPO41.5,KH2PO40.5,MgSO4·7H2O 0.1,FeSO4·7H2O 0.01,蒸馏水1 000 mL,调pH 7.0左右。使用前均用高压蒸汽灭菌30 min。
供试水样:取自于中国水产科学研究院长江水产研究所养殖池塘表层水。
1.1.2 主要试剂和仪器
溴氰菊酯溶液(规格2.5%,宜兴市苏亚达生物技术有限公司);正己烷(色谱纯,美国J.T Baker公司);氯化钠(国药集团化学试剂有限公司);LB肉汤(青岛高科园海博生物技术有限公司);BHI脑心浸出液肉汤(青岛高科园海博生物技术有限公司)。
主要仪器:Varian CP-3800气相色谱仪(美国Varian公司)、UV-2802PC 紫外分光光度计(杭州库仑科技有限公司)、QHZ-98B全温光照振荡培养箱(TESUC TS-2102)、Himac CR-21高速冷冻离心机(日本日立公司)等。
1.2 试验方法
1.2.1 降解菌的分离筛选
用于降解菌筛选的样品采自武汉郊区某长期受菊酯类农药污染菜园耕地土壤。经检测,土样中含溴氰菊酯(9.21±0.05)μg/kg。
富集培养:在锥形瓶中加入100 mL LB肉汤,121 ℃灭菌。无菌条件下取10 g土壤于上述培养基中,于30 ℃、180 r/min振荡培养3 d。
驯化培养:在锥形瓶中加入基础盐培养基100 mL,121 ℃灭菌后,加入0.5 mL已过滤的10 000 mg/L溴氰菊酯母液(丙酮为溶剂)和适量吐温80,使溴氰菊酯的最终质量浓度为50 mg/L,随后无菌接入富集培养3 d后的土壤培养液上清液,于30 ℃、180 r/min振荡培养5 d。5 d后按10%的接种量取培养液上清液,接入到溴氰菊酯农药浓度为100 mg/L新鲜的基础盐培养基中,同法培养5 d。逐次提高溴氰菊酯的浓度,每次提高50 mg/L,使基础盐培养基中溴氰菊酯终浓度为300 mg/L。以相同培养条件下不含溴氰菊酯的基础盐培养基作为空白对照。从最后一次驯化培养液涂布得到的平板挑取单菌落,进行划线纯化,对在培养基上生长良好,传代稳定的不同菌株进行编号后,于4 ℃冰箱保存,以进行下一步降解能力的测定[13]。
1.2.2 降解菌降解能力的测定
挑取经驯化培养得到的单菌落分别接种于 LB液体培养基中,30 ℃、180 r/min摇床培养48 h,4 000 r/min离心10 min收集菌体,弃去上清液,用0.02 mol/L磷酸盐缓冲液(PBS)洗涤菌体沉淀2次,再用相同PBS调节菌体浓度OD600=1.5作为种子液备用。以10%的接种量,将种子液接种到含有0.5 mg/L 溴氰菊酯的基础盐培养基中,于30 ℃、180 r/min摇床培养5 d,5 d后经气相色谱测定溴氰菊酯的浓度,以相同培养条件下含相同浓度的溴氰菊酯不接种细菌的培养基为对照,每个处理重复3次,计算不同菌株对溴氰菊酯的降解率,选取降解能力最大的菌株SW作为研究对象进行后续实验。降解率的计算方法:
降解率= [(A0-A1)/A0] ×100%
式中,A1为降解菌处理后溴氰菊酯残留浓度(mg/L),A0为对照中溴氰菊酯残留浓度(mg/L)。
1.2.3 降解菌生长量(OD600)与溴氰菊酯降解关系曲线的制作
加基础盐培养基100 mL于250 mL锥形瓶中,并添加溴氰菊酯样品母液使其终浓度为0.5 mg/L。按10%的接种量接种1.2.2节所述条件下降解菌SW种子液,在30 ℃、180 r/min摇床培养72 h。以含相同浓度的溴氰菊酯不加降解菌的培养基为对照。每24 h从培养基中取样,每个处理重复3次,用分光光度计测定600 nm下的吸光值,同时用气相色谱仪测定溴氰菊酯残留量,最后绘制菌株生长(OD600)和溴氰菊酯降解关系曲线。
培养基中溴氰菊酯的提取与测定:参照刘丽等[14]的方法作如下改进:取1 mL培养液加入0.1 g NaCl,再加入4 mL正己烷萃取,涡旋振荡3 min,8 000 r/min离心5 min后,收集上层有机相,重复提取一次,合并两次提取液,混匀,于35 ℃氮吹至干,用1 mL正己烷定容,上机待测。气相色谱分析条件:色谱柱Agilent DB-5(30 m× 0.25 mm,0.25 μm);载气:高纯氮气(99.999%),流速1 mL/min;检测器ECD;柱温260 ℃;检测温度310 ℃;进样口温度260 ℃。升温程序:初始温度160 ℃保持1 min,以10 ℃/min升到250 ℃,保持2 min,然后再以10 ℃/min升到280 ℃,保持10 min;进样方式:不分流进样;进样量1 μL。
1.2.4 菌种鉴定
对分离得到的菌株SW培养至对数生长期进行形态观察、生理生化实验,试验方法参照文献[15],菌株16S rRNA基因序列测定及系统发育分析委托武汉擎科创新生物科技有限公司测序,将测序结果在GenBank数据库中利用BLAST进行比对分析,使用MAGE 4.0软件采用邻接法进行关系分析和系统进化树的构建。
1.2.5 溴氰菊酯降解菌的降解特性研究
降解试验基本条件:100 mL的基础盐培养基中加入溴氰菊酯0.5 mg/L作为碳源,菌株接种量10%、pH 7.0、30 ℃、振荡速率180 r/min;最佳条件降解试验:通过分别改变降解基本条件中的温度(20、25、28、30、35 ℃),pH(5.0、6.0、7.0、8.0、9.0),菌株接种量(1%、2%、4%、6%、8%、10%),在其他条件保持不变的情况下培养5 d后,取样测定溴氰菊酯的降解率;改变降解基本条件中溴氰菊酯初始浓度(0.1、0.5和1.0 mg/L),在其他条件保持不变的情况下培养7 d,定期取样测定溴氰菊酯残留量,并每隔1 h测定培养液的OD600值,研究菌株SW在不同溴氰菊酯无机盐培养基中的生长状况以及对不同浓度溴氰菊酯的降解规律。各因素设计以相同条件下加药不加降解菌的处理作为空白对照,每处理重复3次。
1.2.6 菌株对养殖淡水中溴氰菊酯的降解
准备装有30 L养殖淡水的水族箱(49 cm×30 cm×40 cm)6个,将溴氰菊酯溶液用丙酮稀释100倍,采用单次泼洒药浴的方法,使水中溴氰菊酯的理论质量浓度分别为0.5、5.0和50 μg/L,药物充分混匀后2 h取200 mL水样,测定养殖淡水中不同浓度组的实际药物浓度。将菌株SW种子液稀释制成液体菌剂,调节液体菌剂OD600=0.6(菌浓度为6.5×108cfu/mL)。试验共设3 个处理:(T1)在含0.5 μg/L溴氰菊酯的养殖淡水中按照水族箱蓄水量的4%加入降解菌剂;(T2)在含5.0 μg/L溴氰菊酯的养殖淡水中按照水族箱蓄水量的4%加入降解菌剂;(T3)在含50 μg/L溴氰菊酯的养殖淡水中按照水族箱蓄水量的4%加入降解菌剂;以相同药物浓度下不加菌剂处理为空白对照,各处理重复3次。自然光照,全天曝气,使得水体中的溶氧量在5 mg/L以上,pH 6.2~6.4,水温18~20 ℃。于给药后每隔24 h取水样,连续采集5 d,测定各浓度组不同时间点水样中溴氰菊酯的残留量。
1.2.7 不同浓度SW菌剂对养殖淡水中低浓度DM的降解效果
根据1.2.6的结果,准备装有30 L养殖淡水的水族箱(49 cm×30 cm×40 cm)8个,将溴氰菊酯溶液用丙酮稀释100倍,采用单次泼洒药浴的方法,使水中溴氰菊酯的理论质量浓度分别为0.5 μg/L(T1组)和5.0 μg/L(T2组),药物充分混匀后2 h取200 mL水样,测定养殖淡水中不同处理组的实际药物浓度。将菌株SW种子液稀释制成液体菌剂,调节液体菌剂OD600=0.6(菌浓度为6.5×108cfu/mL)。T1组设置4个处理,编号为T1-0、T1-1、T1-2、T1-3,其中T1-0为空白对照。T2组同样设置4个处理,编号为T2-0、T2-1、T2-2、T2-3,其中T2-0为空白对照。分别向T1和T2组投放降解菌剂,其投放量占各水族箱的蓄水量依次为0、0.004%、0.04%、0.4%(对应的SW菌浓度分别为0、2.6×104、2.6×105、2.6×106cfu/mL)。以同一条件下含相同药物浓度不加菌剂的处理为空白对照,各处理重复3次。自然光照,全天曝气,使得水体中的溶氧量在5 mg/L以上,pH 6.2~6.4,水温18~20 ℃。于给药后每隔24 h取水样,连续采集5 d,测定各浓度组不同菌剂浓度处理条件下水样中溴氰菊酯的残留量。
1.2.8 数据处理
溴氰菊酯的降解方程采用SPSS17.0进行拟合,拟合模型为:
Ct=C0e-kt
其中Ct表示t时刻药物浓度,C0为溴氰菊酯农药的初始浓度(mg/L),k表示降解速率常数(d-1)。
降解半衰期通过下列公式计算:
T1/2=ln2 /k
式中,T1 /2为降解半衰期(d),k为降解速率常数(d-1)。
2 结果与分析
2.1 菌株的筛选与鉴定
通过初步的富集驯化培养,分离纯化得到1株溴氰菊酯降解菌株,命名为SW。SW在BHI琼脂平板上30 ℃培养24 h后形成灰色、光滑不透明的菌落,直径2~3 mm、菌落中央突起、边缘整齐光滑。革兰氏染色阴性,接触酶、氧化酶阳性。不产生H2S和吲哚,硝酸盐还原阴性,不能利用甘露醇、鼠李糖和蔗糖,可以利用密二糖、苦杏仁苷和阿拉伯糖(见表1)。菌株SW的16S rRNA测序后在GenBank上登录,根据GenBank同源性比较,发现菌株SW与SphingobacteriummultivorumGZT-2(GenBank登录号为JX035964.1)同源性99%。根据降解菌株形态学特征、生理生化试验结果及16S rRNA基因系统发育分析,将菌株SW初步鉴定为多食鞘氨醇杆菌(Sphingobacteriummultivorum)。根据菌株SW的16S rRNA及相关菌株的16S rRNA序列构建的系统发育树见图1。
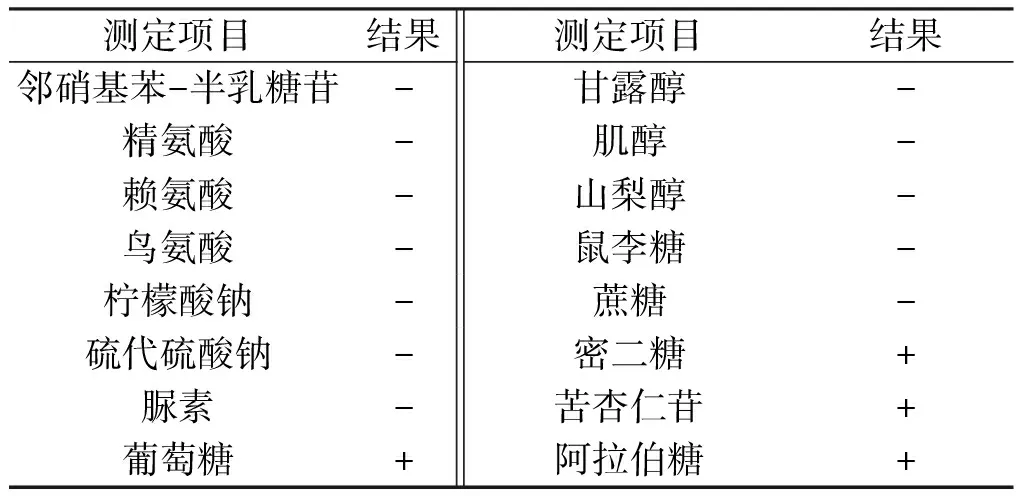
表1 SW的生理生化特征Tab.1 Physiological characteristics of strain SW

图1 根据菌株SW及相关菌株的16S r RNA构建的系统发育树Fig.1 The phylogenetic tree based on the 16S r RNA sequences of strain SW and related strains
2.2 菌株生长与降解溴氰菊酯的关系
将SW种子液(OD600=1.5)按10%的接种量接种在基础盐培养基中(溴氰菊酯浓度为0.5 mg/L)摇床培养。如图2所示,SW能够以溴氰菊酯为唯一碳源缓慢生长。在接种SW后0~24 h内菌株生长较快,溴氰菊酯的降解速率与菌株生长近乎呈正相关。在24~48 h内,SW的生长速度与溴氰菊酯的降解速度均趋于平缓,菌株的生长和农药的降解呈现出良好的同步关系。菌体培养至72 h时降解率达66.3%。

图2 菌株SW生长与溴氰菊酯降解的关系曲线Fig.2 Relationship between strain SW growth and deltamethrin degradation
2.3 不同条件对降解菌降解特性的影响
菌株SW在不同温度下降解溴氰菊酯的效率如图3-A所示,当温度在28~30 ℃时,随着温度升高,SW对溴氰菊酯的降解率上升,最适降解温度为30 ℃。整体来看,温度过高或者过低对菌株SW降解溴氰菊酯影响不大(P>0.05),说明此菌株能够适应较广的温度范围,具备一定的应用潜力。
菌株SW在不同pH下降解溴氰菊酯的效率如图3-B所示,pH 在5~6之间,菌株对溴氰菊酯的平均降解率最高,降解最适初始pH为6。这可能与菌种自身的性质有关,菌株SW在弱酸性条件下可能有利于降解酶的合成与表达,并保持较高的降解活性[16]。
菌株SW在不同接种量下降解溴氰菊酯的效率如图3-C所示,溴氰菊酯的降解率随接种量的增加(2%~4%)而增加。在接种量为4%时降解率最大,当接种量继续增大时,降解率反而下降。这可能是由于随着接种量的增加,微生物会产生竞争作用导致生长所需的碳源相对不足,抑制菌体本身对药物的利用,从而影响降解效果[16]。因此以4%接种量为宜。
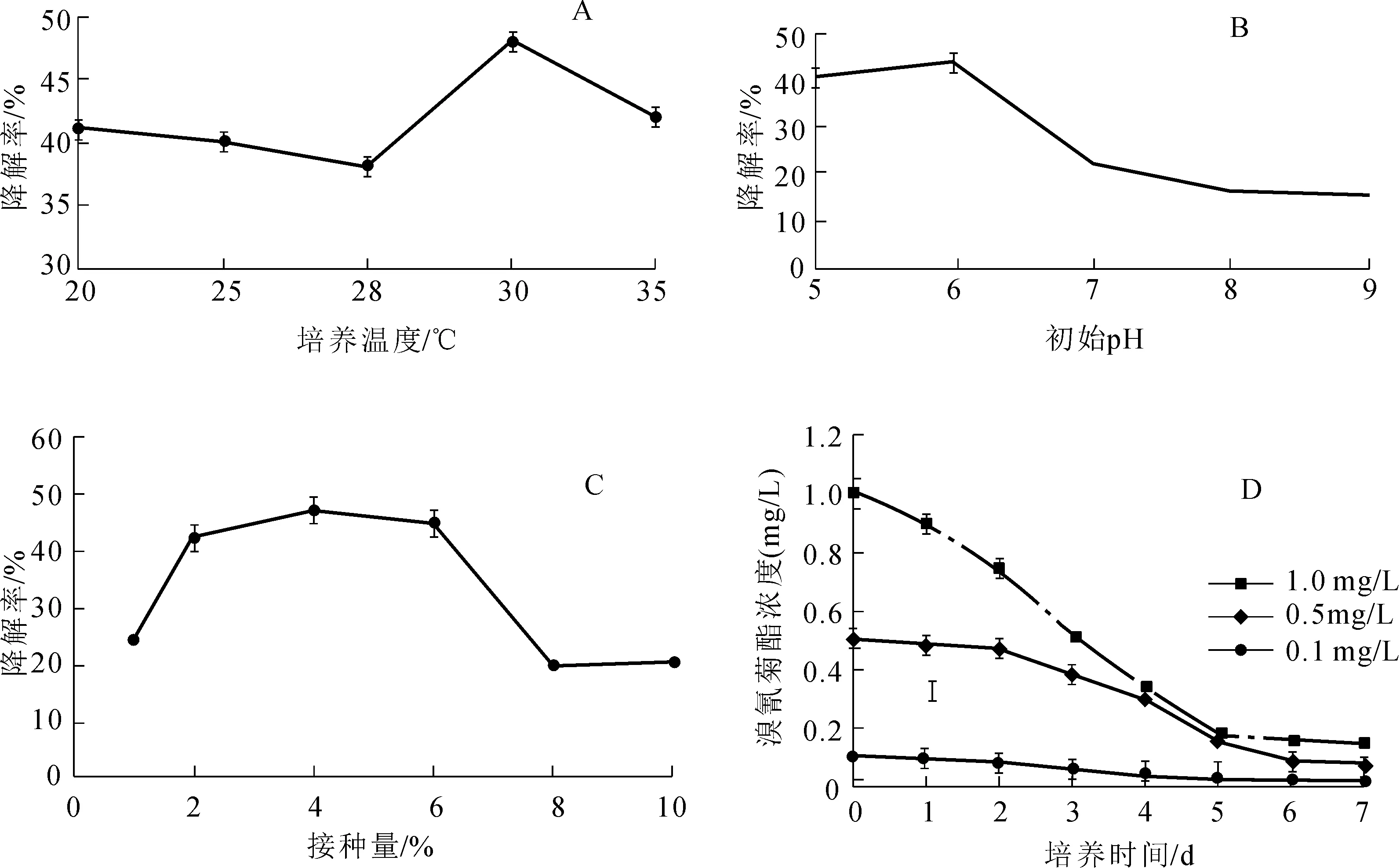
图3 菌株SW降解溴氰菊酯的特性Fig.3 Degrading characteristics of deltamethrin by SWA:温度;B:pH;C:接种量;D:和溴氰菊酯不同起始浓度降解动态
菌株对不同浓度溴氰菊酯(0.1~1.0 mg/L)的降解曲线如图3-D所示,SW对0.1和0.5 mg/L溴氰菊酯的降解到第6天才趋于平稳;对1.0 mg/L溴氰菊酯的降解到第5天便趋于平稳,降解过程均基本符合一级降解动力学模型(表2)。0.1、0.5和1.0 mg/L溴氰菊酯在基础盐培养基中的自然降解半衰期(T1 /2)分别为5.4、10.7和11.5 d。SW对0.1、0.5和1.0 mg/L溴氰菊酯的降解半衰期(T1/2)分别为4.5、2.3和2.0 d,相比同浓度下的自然降解半衰期大大缩小,表明SW是一株溴氰菊酯高效降解菌株。同时发现SW对高浓度溴氰菊酯的降解比低浓度快:培养至第5天时,SW对1.0 mg/L 溴氰菊酯降解率达76.4%,而对0.1 mg/L溴氰菊酯降解率为63.2%。如图4可知,菌株SW的生长速率随无机盐培养基中溴氰菊酯浓度(0.1~1.0 mg/L)的增加而增大,这一结果与陈少华等[13]所研究的无色杆菌属菌株P-01在不同浓度DM(100~500 mg/L)中的生长趋势相似,这可能是由于溴氰菊酯作为菌株生长的唯一碳源,对菌体的生长代谢起重要作用,当溴氰菊酯浓度相对较低时限制了菌株的生长从而影响降解效率。
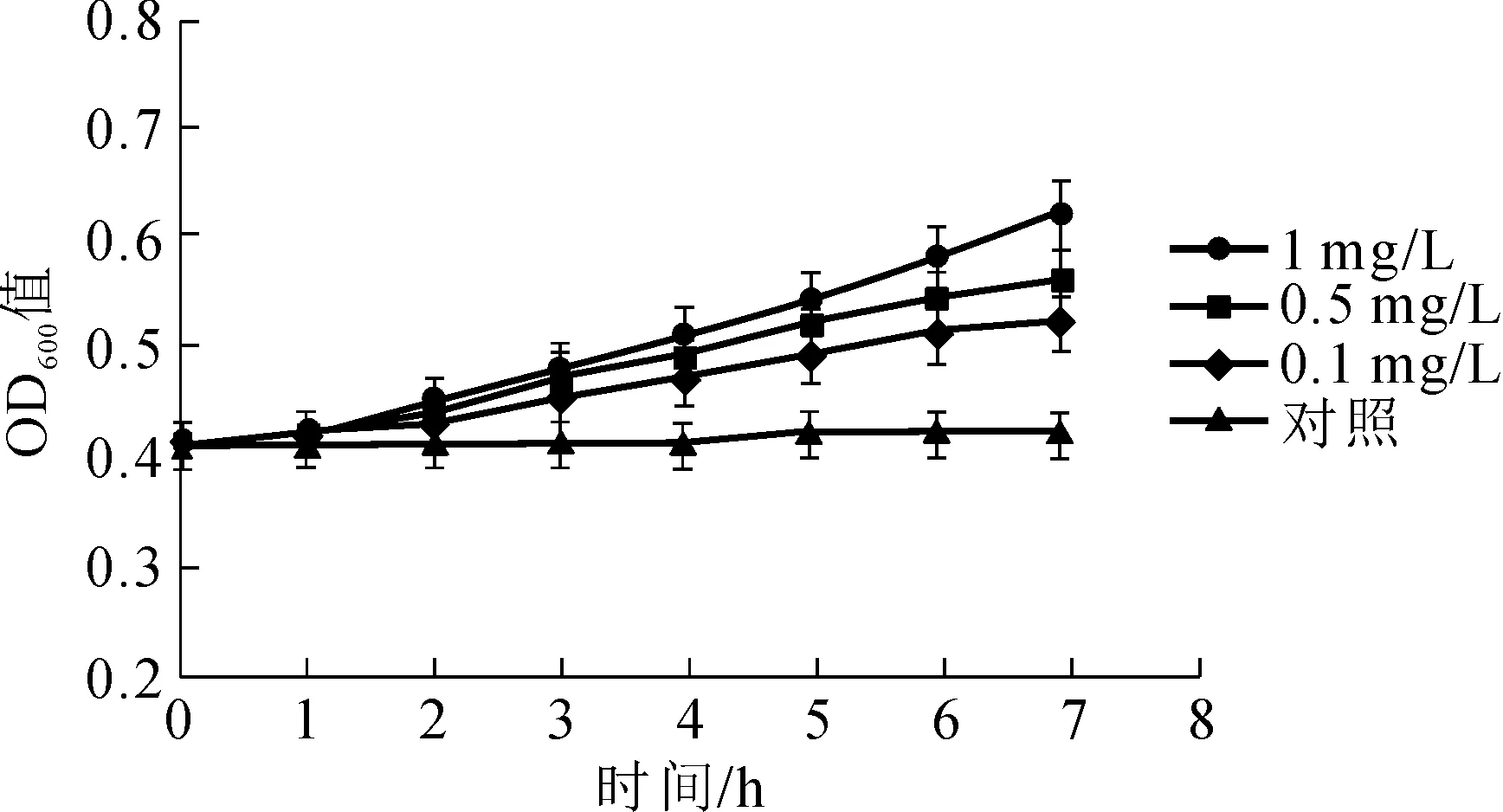
图4 不同溴氰菊酯浓度下菌株SW的生长曲线Fig.4 Growth curve of SW with different deltamethrin concentrations
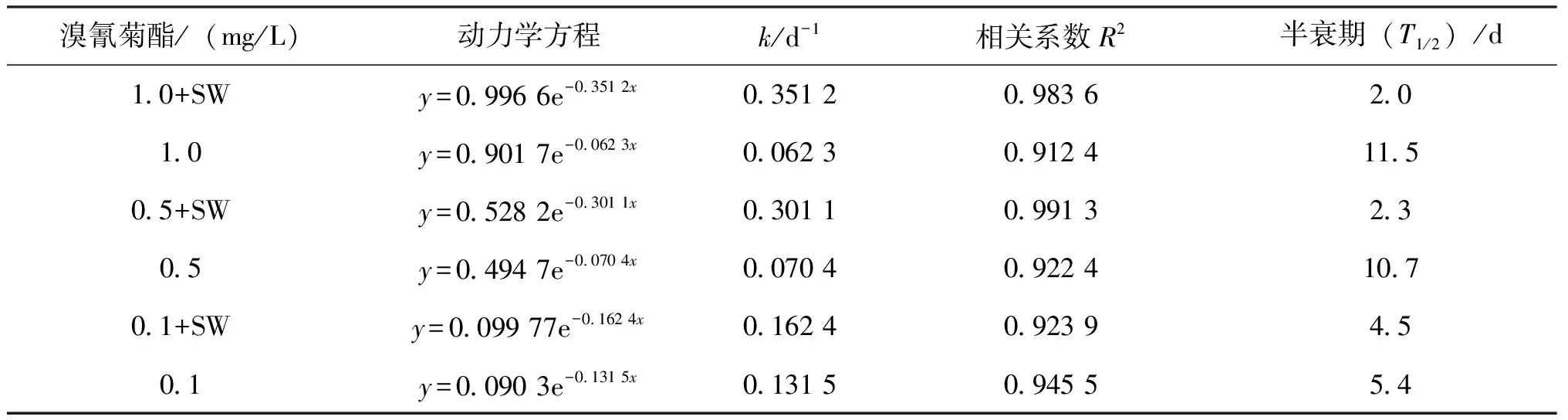
表2 菌株 SW对不同浓度溴氰菊酯的降解动力学参数Tab.2 Kinetic parameters of degradation of different content of deltamethrin by strain SW
注:y为溴氰菊酯残留量(mg/L);x为降解时间(d)
2.4 SW对养殖淡水中溴氰菊酯的降解效果
SW对养殖淡水中较低浓度的溴氰菊酯(0.5~50 μg/L)的降解过程基本符合一级降解动力学模型(图5,表3)。0.5、5.0和50 μg/L 溴氰菊酯在养殖淡水中的自然降解半衰期(T1 /2)分别为5.0、5.3和6.9 d。SW对0.5、5.0和50 μg/L溴氰菊酯的降解半衰期(T1/2)分别为4.6、4.1和2.5 d。与在基础盐培养基中的降解过程相似,SW在养殖淡水中对高浓度溴氰菊酯的降解比低浓度快:培养至第5天时,SW对0.5、5.0和50 μg/L溴氰菊酯的降解率为21.6%,26.4%和53.8%。
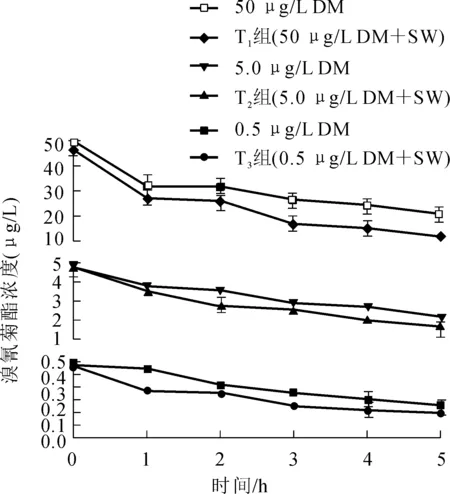
图5 SW对养殖淡水中不同浓度溴氰菊酯的降解Fig.5 Degradation on different content of deltamethrin in freshwater by SW
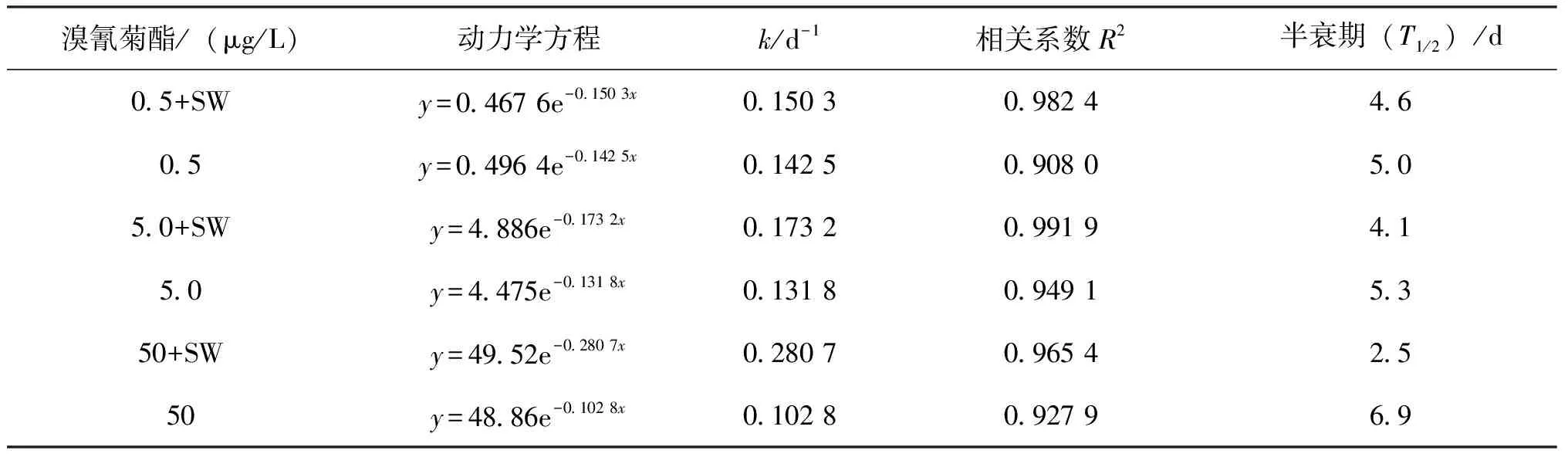
表3 菌株 SW对不同浓度溴氰菊酯的降解动力学参数Tab.3 Kinetic parameters of degradation of different content of deltamethrin by strain SW
注:y为溴氰菊酯残留量(μg/L);x为降解时间(d)。
2.5 不同浓度SW菌剂对养殖淡水中低浓度DM的降解效果
按照1.2.6的方法向含有0.5 μg/L(T1组)和5.0 μg/L(T2组)DM的养殖淡水中投放不同浓度菌剂SW,施用菌剂后2 h、1 d、3 d、5 d 养殖淡水中DM残留量及降解率如表4和表5所示。降解菌剂对养殖淡水中低浓度DM有一定的降解作用。随着菌剂SW投放量的增加,养殖淡水中DM浓度呈递减趋势,且降解率随时间的增加而增大。施用菌剂后5 d,T1-1、T1-2、T1-3的降解率分别为4.09%、10.0%、21.2%,T2-1、T2-2、T2-3的降解率分别为5.62%、14.9%、24.5%。分析可知,菌株SW对养殖淡水中低浓度DM的降解效果随菌剂用量的增加而增加,综合2.4的结果可知,不同浓度菌剂SW对养殖淡水中0.5和5.0 μg/L DM的降解率没有显著性差异,当菌剂SW投放量为4%(养殖水中SW浓度为2.6×107cfu/mL)时,SW对50 μg/L DM降解效果最好,施用菌剂后5 d降解率达53.8%。

表4 菌剂SW投放量对养殖淡水中溴氰菊酯(0.5 μg/L)降解效果的影响Tab.4 Effect of bacterial concentration on degradation of 0.5 μg/L deltamethrin in the freshwater

表5 菌剂SW投放量对养殖淡水中溴氰菊酯(5.0 μg/L)降解效果的影响Tab.5 Effect of bacterial concentration on degradation of 5.0 μg/L deltamethrin in the freshwater
3 讨论
微生物修复目前已成为去除农药残留污染的一种重要方法。而筛选高效农药降解菌是开展农药污染生物修复工作的重要前提,利用高浓度农药筛选出相关降解菌是目前较为普遍的方法[17]。本研究通过高浓度溴氰菊酯(50~300 mg/L)筛选驯化出能高度耐受并降解药物的菌株SW。农药的浓度与微生物的降解活性息息相关,高浓度会抑制甚至杀灭降解菌,而浓度过低则难以满足微生物的营养需求从而影响降解效率[18],因此选择在0.5 mg/L溴氰菊酯浓度下测定菌株SW对药物的降解能力并以此研究菌株的降解特性和最佳降解条件。降解菌能否运用于生产实际,在外界环境中保持稳定的数量和较高的降解活性是生物修复技术亟待解决的问题。影响微生物降解农药的因素有微生物自身性质、农药结构以及环境条件(温度、pH、接种量、底物浓度等)。张松柏等[19]从活性污泥中分离得到能有效降解甲氰菊酯、联苯菊酯等拟除虫菊酯类农药的菌株PSB07-21,其最佳降解条件是在pH7.0、35 ℃,培养15 d,降解率分别为66.63%和50.18%。菌株SW对溴氰菊酯降解影响因素的研究结果也证明了这一点,其降解效果受到温度、pH、接种量、农药初始浓度等环境条件的影响。在pH为7.0的基础盐培养基中,30 ℃、180 r/min摇床培养5 d,SW对1.0 mg/L溴氰菊酯的降解率达76.4%。农药除被微生物降解外,还会发生光解、化学分解及共代谢作用等,因此只有当菌株的生长和农药的降解出现同步关系时,才能确定农药被微生物降解了[20]。菌株SW生长与降解溴氰菊酯的关系曲线表明(图2),该菌生长与溴氰菊酯降解基本一致,显示出良好的同步关系,表明该菌能够以溴氰菊酯为唯一碳源生长,具有潜在的应用价值[21]。
目前有关溴氰菊酯杀虫剂在水体中的代谢残留还鲜见报道,在养殖用水水质标准中,也没有关于溴氰菊酯的规定[22]。本文通过研究菌株SW对养殖淡水中不同浓度溴氰菊酯的降解效果,结果表明降解菌SW对溴氰菊酯有一定的降解作用,且降解率随时间的增加而增大。SW对0.5、5.0和50 μg/L溴氰菊酯作用5 d后的降解率为21.6%,26.4%和53.8%。SW对0.5、5.0和50 μg/L溴氰菊酯的降解半衰期(T1/2)分别为4.6、4.1和2.5 d,不同浓度菌剂SW对养殖淡水中0.5和5.0 μg/L溴氰菊酯降解效果没有显著性差异,当菌剂SW投放量为4%(养殖水中SW浓度为2.6×107cfu/mL)时,SW对50 μg/L溴氰菊酯降解效果最好。在养殖淡水中对高浓度溴氰菊酯的降解比低浓度快,可能是由于低浓度的溴氰菊酯作为菌株SW生长的唯一碳源相对不足,难以满足微生物的营养需求从而影响降解效率[18]。迟恒等[23]研究表明:5.0 μg/L溴氰菊酯在水环境中的消除半衰期为4.28~5.99 d,本研究分离筛选的多食鞘氨醇杆菌菌株SW对相同条件下养殖淡水中5.0 μg/L溴氰菊酯的降解半衰期(T1/2)为4.1 d,其降解半衰期更短,表明其在控制水环境中拟除虫菊酯类农药残留方面具有一定的应用潜力。自然环境可能有诸多因素对农药残留以及降解菌剂降解效果存在影响,菌剂用量及环境影响等因素仍需进一步研究[24]。

