新生儿脓毒症无休克和休克关键基因筛选及验证
陈慧,陈光辉,孙丽丽,黄培坚,黄秋芳(南方医科大学附属小榄医院检验科,广东中山510515)
脓毒症(neonatal sepsis)是指细菌、病毒及真菌等入侵机体血液循环,产生毒素导致全身严重感染和器官损伤的临床综合征,是造成新生儿死亡的重要原因[1-2]。新生儿脓毒症可进展成新生儿急性呼吸窘迫综合征、难治性新生儿呼吸衰竭、脓毒症休克,甚至导致死亡[3-4]。尽管有创/无创呼吸支持技术和肺泡表面活性物质的临床应用在一定程度上提高了新生儿脓毒症的存活率,但新生儿脓毒症的发生率和发生后遗症的概率仍然较高,主要是由于新生儿肺部对感染敏感性增强、免疫功能不全[5-6]。加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)旨在寻找协同表达的基因模块(module),并探索基因网络与关注的表型之间的关系及关键基因(hub基因)[7]。本研究通过WGCNA分析脓毒症有、无休克患儿基因模块,确定hub基因,为新生儿脓毒症诊断提供潜在的分子标志物。
1 材料和方法
1.1数据下载 从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载与脓毒症患儿相关的表达矩阵。筛选标准:(1)具有对照和脓毒症患儿样本;(2)样本总个数≥50。最终选取脓毒症患儿相关基因表达矩阵(gene set enrichment,GSE)119217用于本研究,其中对照12例,脓毒症无休克患儿81例,脓毒症休克患儿41例,共134例,样本类型为外周血。对于该芯片数据,首先根据芯片对应的平台信息进行ID转换,然后使用具有原始数据读取、数据质量控制、数据预处理、对多种实验设计进行差异分析等功能的limma程序包进行校正。
1.2WGCNA分析 WGCNA通过基因在样本中表达的相似性确定基因模块后,提供相应的函数关联基因模块与临床信息,进而识别有临床意义的基因模块。与临床特征有显著意义(gene significance,GS)和作为模块成员(module membership,MM)的基因定义为模块基因。选择与临床特征相关程度最高的基因模块,根据模块成员相关值(correlation with module membership,cor.MM)>0.8和基因显著意义相关值(correlation with gene significance,cor.GS)>0.45筛选模块基因。拓扑重叠矩阵(topology overlap matrix,TOM)根据软阈值构建共表达网络。
1.3差异表达基因分析 将样本数据分为:对照组和脓毒症无休克组,对照组和脓毒症休克组。使用R包的limma筛选差异表达基因(differentially expressed gene,DEG)。DEG的筛选阈值均设定为log2Fold Change>2和P<0.05。
1.4DEG富集分析 2个分组间DEG分别用R包clusterProfiler进行基因本体(gene ontology,GO)和KEGG(kyoto encyclopedia of genes and genomes, KEGG)富集分析,设置条件均为P<0.05。
1.5hub基因筛选 模块基因和差异基因取交集,即为hub基因。采用R语言对hub基因进行表达量分析。
1.6hub基因检测 取南方医科大学附属小榄医院收集的健康儿血液样本、脓毒症休克患儿血液样本和脓毒症无休克患儿血液样本外周静脉血,3 000 r/min离心10 min,取上层血清液进行实时定量荧光PCR(qRT-PCR)实验(Bio-Rad,#CFX96),具体步骤为:Trizol法提取总RNA,稀释后根据反转录试剂盒[PrimeScript RT Master Mix(Takara, #RR036A)]逆转录合成cDNA,其反应体系包括RTace 0.5 μL,RT 5×Buffer 4 μL,RNase抑制剂0.5 μL,稀释后的RNA 12 μL,逆转录引物RT prime 1 μL,dNTP 2 mL,逆转录条件:42 ℃ 60 min,72 ℃ 10 min,4 ℃保存;将hub基因的核苷酸序列导入Primer express 2.0生物软件,结合引物的设计原则进行设计。引物均由上海生工生物工程公司合成,并使用生物染料法荧光定量试剂盒 [SYBR Premix Ex Taq Ⅱ(Takara,#RR420A)]进行扩增,其反应体系包括cDNA 2 μL,realtime PCR Master Mix 12.5 μL,Forward引物0. 5 μL,Reverse引物0.5 μL, ddH2O 9.5 μL, PCR 扩增程序:95 ℃变性3 min,60 ℃退火,40个扩增循环(95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30s荧光信号收集)。采用相对定量的比较Ct法,即2-△△Ct法检测hub基因相对水平,以GAPDH的表达作为内参。 qRT-PCR 引物如表1所示。

表1 引物序列
2 结果
2.1WGCNA分析 对样本进行聚类分析,查看是否有离群样本,设置cut-off值为80,去除4个离群样本。样本聚类信息结合样本特征,得到聚类特征热图(图1A)。使用网络拓扑分析确定软阀值为5。根据软阈值构建共表达网络(图1B),分析样本特征与模块的关系。根据样本特征,挑选与脓毒症无休克患儿显著相关的棕色模块,进行相关性分析,相关值(Correlation,cor)=0.53,P<0.001,图1C;根据样本特征,挑选与脓毒症休克患儿显著相关的黄色模块,进行相关性分析,cor=0.55,P<0.001,见图1D。
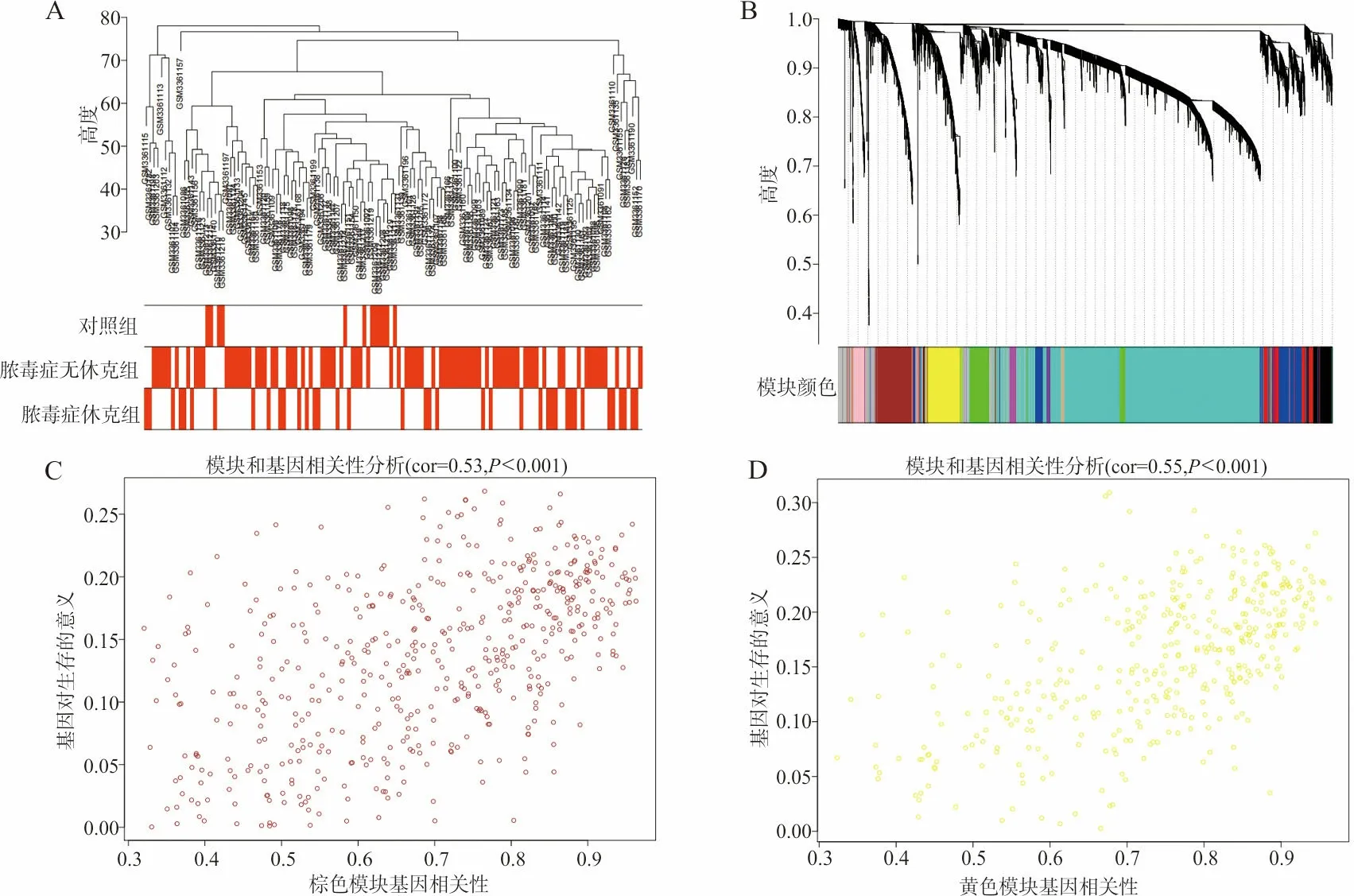
注:A,聚类特征热图;B,共表达网络构建结果;C,棕色(brown)模块;D,黄色(yellow)模块。
2.2DEG分析 对照样本与脓毒症无休克患儿样本存在41个DEG,包括35个上调DEG和6个下调DEG(图2A和图2B)。对照样本与脓毒症休克患儿样本存在109个DEG,包括73个上调DEG和36个下调DEG (图3A和图3B)。
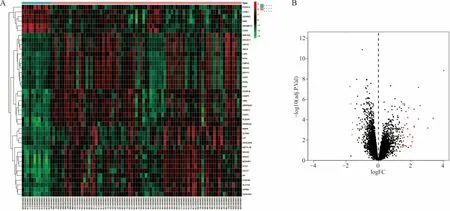
注:A,DEG热图;B,DEG火山图。

A,DEG热图;B,DEG火山图。
2.3DEG富集分析 用R程序包的ClusterProfiler进行GO富集分析,发现脓毒症无休克患儿DEG与脓毒症休克患儿DEG主要富集于中性粒细胞脱粒,中性粒细胞活化参与的免疫反应(图4A和图4C),参与调控NOD样受体信号通路和哮喘(图4B和图4D)。

注:A,对照样本和脓毒症无休克样本DEG GO富集分析;B,对照样本和脓毒症休克样本DEG GO富集分析;C,对照样本和脓毒症无休克样本DEG KEGG富集分析;D,对照样本和脓毒症休克样本DEG KEGG富集分析。
2.4脓毒症无休克患儿样本hub基因分析 51个棕色模块基因与41个DEG取交集得到8个hub基因(AIM2、CARD17、CMPK2、IFI44、IFI44L、LAP3、RTP4和SERPING1),均在脓毒症无休克患儿血液样本中高表达(表2);qRT-PCR结果表明8个hub基因在脓毒症无休克患儿血液样本中水平升高(表3)。

表2 hub基因在对照样本和脓毒症无休克患儿样本中的水平

表3 qRT-PCR检测hub基因在对照样本和脓毒症无休克患儿样本中的水平
2.5脓毒症休克患儿样本hub基因分析 74个黄色模块基因与109个DEG取交集得到2个hub基因(AHSP和HBD),均在脓毒症休克患儿血液样本中高表达(表4);qRT-PCR结果表明AHSP和HBD基因在脓毒症休克患儿血液样本中水平升高(表5)。

表4 hub基因在对照样本和脓毒症休克患儿样本中的水平
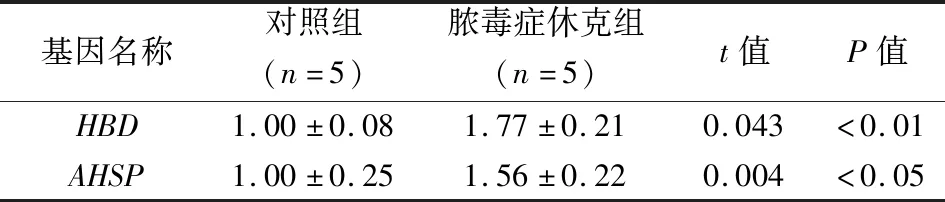
表5 qRT-PCR检测hub基因在对照样本和脓毒症休克患儿样本中的水平
3 讨论
脓毒症是导致新生儿死亡的常见疾病,如未得到快速且正确的治疗,新生儿脓毒症可进展至多器官衰竭,增加死亡风险[8]。因此寻找新生儿脓毒症诊断标记物具有重要的临床意义。在本研究中,我们证实脓毒症无休克患儿8个hub基因(AIM2、CARD17、CMPK2、IFI44、IFI44L、LAP3、RTP4和SERPING1)和脓毒症休克患儿2个hub基因(AHSP和HBD)可能参与新生儿脓毒症发展。
黑素瘤缺乏因子2(absent in melanoma 2,AIM2)主要定位于细胞质,通过招募凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC),诱导炎性小体组装,加重炎症反应[9-10]。通过分析关节炎患儿嗜中性粒细胞转录组发现AIM2水平上调,与免疫失调相关[11]。笔者分析发现脓毒症无休克患儿样本DEG调控炎性小体相关的NOD样受体信号,且AIM2水平在脓毒症无休克患儿血液样本中显著升高。干扰素诱导蛋白44(interferon-inducible 44,IFI44)和干扰素诱导样蛋白44(interferon-inducible 44 like,IFI44L)参与机体抗病毒感染过程,急性呼吸窘迫综合征患者的全血转录组中IFI44水平升高[12],在感染性休克患者外周血单核细胞中转录组中IFI44、IFI44L等基因水平异常[13]。本研究结果发现IFI44和IFI44L水平在脓毒症无休克患儿血液样本中升高。血清蛋白质组学分析发现COVID-19患者C1抑制蛋白(SERPING1)表达增加[14]。Leite等[15]利用生物信息学和转录组学分析发现脓毒症患者α-血红蛋白稳定蛋白 (α-hemoglobin stabilizing Protein,AHSP)和人β-防御素 (human β-defensin,HBD)水平升高。与该研究相似,本次实验证实脓毒症休克患儿血液样本中AHSP和HBD基因水平显著升高。
此外,本研究结果发现新生儿脓毒症的差异基因主要富集于中性粒细胞脱粒,中性粒细胞活化以及中性粒细胞激活等反应,调控NOD样受体信号等通路。已有研究证实中性粒细胞活化和脱粒介导的免疫功能障碍是导致新生儿脓毒症发生的重要原因[16-18]。最后本研究确定了与脓毒症无休克患儿临床特征相关联的51个棕色模块基因和与脓毒症休克患儿临床特征相关联的74个黄色模块基因,与本分析方法类似,Cheng等[19]利用脓毒症患者的全血RNA表达谱中鉴定出23个脓毒症差异表达模块基因。这些结果突出临床相关模块基因在新生儿脓毒症进展中的重要性。
综上所述,通过WGCNA和生物信息学分析新生儿脓毒症相关的模块基因与差异基因,确定8个脓毒症无休克患儿hub基因和2个脓毒症休克患儿hub基因均高表达,为新生儿脓毒症诊断提供潜在的标志物,但其调控机制还需进一步研究。

